
ПРИМЕР. Рассчитать энтальпию реакции по данным теплотам сгорания Δс Н0298:
С2Н2(г) + Н2 (г) = С2Н4(г)
Табличные данные
вещество |
С2Н2 |
Н2 |
С2Н4 |
Δс Н0298, кДж/моль |
-1299,63 |
-241,84 |
-1410,97 |
Dr Н°298 = Δс Н0298 (С2Н2) + Δс Н0298 (Н2) – Δс Н0298 (С2Н4) =
(-1299,63) + (-241,84) – (1410,97) = -129,87 кДж
ЗАДАЧА. Рассчитать ∆r H0298 и ∆r H01000 реакции
С(к) + СО2(г) = 2СО(г),
считая изменение теплоемкости системы в данном температурном интервале равным нулю (∆r С0р= 0).
Решение:
∆rН0Т = ∆rН0298
По табличным данным находим:
Вещество Δf Н0298,кДж/моль
С(графит) 0
СО2 (г) -393,5
СО (г) -110,5
Δr Н0298 = 2Δf Н0298, СО г – Δf Н0298 Ск - Δf Н0298, СО2г =
= 2(-110,5) – 0 – (-393,5) = 172,5 кДж.
Δr Н0298 > 0 реакция эндотермическая.
ЗАДАЧА.
Определить ∆r H0298 реакции
С(к) + СО2(г) = 2СО(г) (1),
если известно:
2С(к) + О2(г) = 2СО(г) , ∆r H0298 = – 221 кДж (2)
2СО(г) + О2(г) = 2СО2(г) , ∆r H0298 = – 566,1 кДж (3)
Решение.
К термохимическим уравнениям можно применять любые
алгебраические действия: ур.1 = ½ ур.2 – ½ ур.3
½(2С(к) + О2(г)) – ½(2СО(г) + О2(г)) = ½ · 2СО(г) – ½ · 2СО2(г)
∆r H01 = ½(∆r H02 – ∆r H03) = ½[ –221 – (–566,1)] = 172,5 кДж
ПРИМЕР
Ст + СО2,г® 2СОг ; DS0 = 87 Дж/К > 0
! увеличение объема системы
3Н2,г + N2,г® 2NH3,г ; DS0 = –90 Дж/ < 0
! уменьшение объема системы
Alк + Sbк = AlSbк; DS0 = –1,1 Дж/К @ 0
! объем системы практически не изменяется
Задача. Рассчитать ∆r S0Т реакции:
С(к) + СО2(г) = 2СО(г)
при 298 К и при 1000 К, считая ∆r С0р= 0 в рассматриваемом температурном интервале.
Решение.
Вещество S0298,Дж/(моль.K)
С (графит) 5,74
СО2 (г) 213,68
СО (г) 197,54
Δr S0298 = 2 S0298, СО г - S0298,С к - S0298,СО2 г =
= 2(197,54) – 5,74 – 213,68 = 175,66 Дж/K.
∆r S01000 = ∆r S0298 = 175,66 Дж/К
обратите внимание на размерность!
Расчет стандартной энергии Гиббса Δr G0
(все вещества находятся в стандартном состоянии)
1. По следствию из закона Гесса (используя справочные данные):
Δr G0298=∑νiΔf G0298, i продуктов-∑νjΔf G 0298, j исх веществ
2. По уравнению:
Δr G = ∆r H − T∆r S
при Т = 298 К
Δr G0298 = ∆r H0298 – T∆r S0298
принимая, что ∆r С0р= 0, т.е. теплоемкость системы не изменяется при прохождении реакции
Δr G0Т = ∆r H0298 – T∆r S0298
Если вещества, участвующие в реакции, находятся в нестандартном состоянии расчет Δr G по уравнению изотермы Вант Гоффа:
для реакции
aA (г) + bB(г) + dD(к) = eE(г) + fF(г)
Δr
GТ
= ∆r
G0Т
+
RT
ln
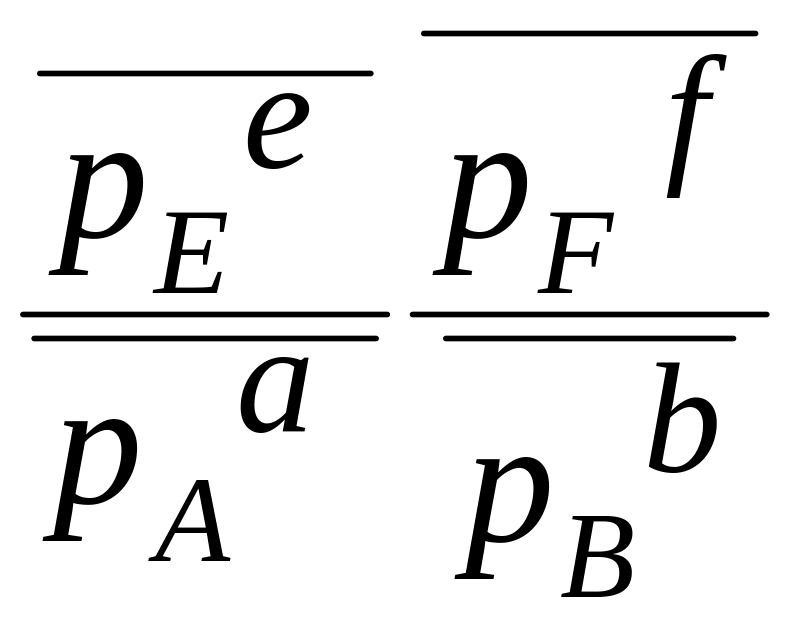
![]() – исходные
относительные
парциальные давления
– исходные
относительные
парциальные давления
газообразных веществ
= p атм/1 атм = p кПа/100 кПа = p Па/105 Па
! В уравнение изотермы Вант Гоффа входят только относительные парциальные давления газообразных веществ
Если относительные давления всех газов равны 1 (стандартное состояние), то Δr GТ = ∆r G0Т
Δr G0298 ≠ Δr G0Т при Т отличной от 298 К
Δr G0298 , Δr G0Т не являются критериями направления или предела самопроизвольного протекания реакции в условиях отличных от стандартных
ЗАДАЧА.
Определите возможность самопроизвольного протекания реакции
С(к) + СО2(г) = 2СО(г)
при 298 К и 1000 К и стандартных состояниях всех компонентов (∆r Н0Т и ∆r S0T - не зависят от Т).
Решение. Возможность самопроизвольного протекания реакции определяется неравенством ∆rG0T<0
∆r G0Т = ∆r H0Т - T∆rS0Т = ∆r H0298 - T∆r S0298
∆r G0298 = 172,5 – 298 .175,66.10-3 = 120,15 кДж > 0 –
реакция в прямом направлении невозможна (энтальпийный фактор преобладает и не способствует самопроизвольному протеканию прямой реакции).
∆r G01000 = 172,5 – 1000.175,66.10-3 = -3,16 кДж < 0 - реакция в прямом направлении возможна (энтропийный фактор преобладает при высоких температурах и способствует самопроизвольному протеканию прямой реакции).
ЗАДАЧА.
При каком соотношении парциальных давлений газообразных компонентов реакции и 298 К
С(к) + СО2(г) = 2СО(г)
возможно ее протекание в прямом направлении?
Решение. Возможность самопроизвольного протекания реакции: Δr G298 < 0
По уравнению изотермы Вант-Гоффа:
ΔrG298
=
∆rG0298
+ RTln![]() < 0.
< 0.
120,15 + 8,31.10-3.298 ln < 0
ln < - 48,5 < 10-21
ЗАДАЧА.
Определить температурную область самопроизвольного протекания реакции:
С (к) + СО2 (г) = 2СО (г)
при стандартных состояниях компонентов.
Решение.
Реакция протекает самопроизвольно при стандартных состояниях компонентов (∆rH0 и ∆rS0 не зависят от температуры), если:
∆rG0Т = ∆rH0298 - Т∆rS0298 < 0
(172,5 – Т.175,66.10-3) < 0 (размерность!)
Т > 982 К
Температурный интервал (из справочных данных):
