3.3 Определение бактериальной обсемененности воздуха
Цель работы. Освоить определение бактериальной обсемененности
воздуха методами оседания.
Материалы и оборудование. Стерильные чашки Петри с МПА, термостат с температурой 37 С.
Определяют количество мезофильных аэробных и факультативно-анаэробных микроорганизмов (КМАФАнМ) и содержание микроскопических грибов и дрожжей.
Ход выполнения работы
1. Для каждого определения готовят по 2 чашки Петри с 10-15 см3 мясопептонного агара или среды для определения КМАФАнМ или среды Сабуро. Чашки переносят в исследуемое помещение и помещают на развернутую бумагу, в которой они стерилизовались. Далее сдвигают крышки на самый край бортика чашки так, чтобы вся поверхность агаризованной среды была открыта полностью.
2. Чашки оставляют открытыми 5, 10 или 15 минут (время экспозиции) в зависимости от загрязненности воздуха. Затем их закрывают крышками, переворачивают вверх дном и помещают в термостат. Чашки с МПА выдерживают в течение 24-48 часов при 370С, а со средой Сабуро – в течение 2-3 суток при 250С.
3. Подсчет колоний производят визуально и с помощью лупы. Подсчет колоний грибов и дрожжей ведут отдельно. Для определения содержания микроорганизмов в 1 м3 пользуются формулой, предложенной Омелянским, согласно которой на поверхности чашки площадью 100 см2 оседает в течение 5 минут столько микроорганизмов, сколько их содержится в 10 л воздуха.
Формула Омелянского:
Х = а×100×5×100 / ST,
где а – число выросших в чашках колоний (среднее из двух);
S – площадь чашки Петри, см2;
Т – время экспозиции, мин;
100 – пересчет площади чашки на 100 см2;
5 – время экспозиции по Омелянскому, мин;
100 – пересчет на 1 м3 воздуха.
4. Полученные результаты запишите в табл. 3.
Таблица 3
Определение бактериальной обменности воздуха
Номер пробы |
Общее микробное число в воздухе |
|
|
|
|
|
|
СПОСОБЫ КУЛЬТИВИРОВАНИЯ И ИДЕНТИФИКАЦИИ
МИКРООРГАНИЗМОВ РАЗНЫХ ФИЗИОЛОГИЧЕСКИХ ГРУПП
Для объективности оценки качества и безопасности пищевых продуктов определяющее значение имеет выбор способа культивирования и эффективность идентификации производственной и посторонней микрофлоры.
При идентификации микроорганизмов учитывают:
морфолого-цитологические признаки. К ним относятся строение, форма и размеры клеток, их взаимное расположение, тинкториальные свойства (особенности при окрашивании различными красителями), способность к образованию спор и капсул, подвижность, наличие жгутиков, образование в клетках некоторых включений, особенности размножения;
физиолого-биохимические признаки. При изучении физиолого-биохимических признаков устанавливают отношение микроорганизмов к различным источникам углерода и азота, потребность в кислороде, температурные границы роста, солеустойчивость, чувствительность к антибиотикам, ферментативные тесты;
культуральные признаки. К таким признакам относятся особенности роста микроорганизмов на плотных и жидких питательных средах.
К настоящему времени разработано несколько способов культивирования микроорганизмов на средах: периодическое, непрерывное культивирование и культивирование иммобилизованных клеток.
Наиболее распространен способ периодического культивирования. При данном способе инокулят вносится в питательную среду, которая содержит заданное количество всех необходимых питательных веществ. При этом ни один из существенных компонентов питательной среды не поступает в систему в процессе культивирования, т.е. это закрытая система. Периодическое культивирование возможно как поверхностных культур (на поверхности твердой питательной среды), так и глубинных культур (в жидкой питательной среде). При внесении микроорганизмов в питательную среду их рост прекращается тогда, когда содержание какого-нибудь из необходимых компонентов среды достигает минимума или в среде накапливаются продукты метаболизма, ингибирующие рост микроорганизмов.
Второй способ культивирования микроорганизмов - рост в непрерывной культуре. Все компоненты питательной среды постоянно поступают в систему и выводятся из нее. Это открытая система осуществляется только в глубинной культуре, чаще всего аэрируемой.
Третий - культивирование иммобилизованных клеток. Клетки микроорганизмов прикрепляются (иммобилизуются) на каких-либо инертных носителях. Питательная среда постоянно поступает в систему и выводится из нее, т.е. это тоже открытая система.
Для выделения микроорганизмов определенных физиологических групп предложена техника так называемых «накопительных культур». Техника накопительных культур основана на использовании элективных методов культивирования, т.е. создания таких условий выращивания бактерий, которые будут максимально благоприятны для развития микроорганизмов определенной физиологической группы, а другие организмы в этих условиях развиваться не могут или их рост будет незначителен.
Подбирая определенный состав питательной среды и параметры культивирования инокулируют среду смесью, содержащей микроорганизмы, выдерживают некоторое время при оптимальной температуре, рН и аэрации, в результате чего получают обогащенную накопительную культуру. Последовательные пересевы на такую же элективную среду предотвращают рост сопутствующей микрофлоры. О получении накопительной культуры свидетельствуют помутнение среды, получение осадка, пленки, выделение газообразных веществ.
Для роста микроорганизмов существенное значение имеет не только состав питательной среды, но и такие факторы, как кислотность среды, аэрация, температура, свет, влажность. Развитие микроорганизмов возможно лишь в определенных пределах каждого фактора, причем для различных групп микроорганизмов эти пределы неодинаковы.
Активная кислотность среды. Активная кислотность среды (рН) имеет решающее значение для роста многих микроорганизмов. Большинство бактерий лучше растет при рН, близком к 7,0. В случае необходимости рН среды доводят до нужного значения растворами кислот (HCl. H2SO4), щелочей (NaOH, KOH) или солей, имеющих щелочную реакцию (Na2CO3, NaHCO3).
Аэрация. Кислород входит в состав воды и многих соединений, поэтому поступает в клетки в больших количествах. Значительная часть микроорганизмов нуждается в постоянном притоке молекулярного кислорода. Такие микроорганизмы принято объединять в группу облигатных анаэробов. Развитие других микроорганизмов, напротив, возможно только в отсутствии кислорода. Получение энергии у них не связано с использованием молекулярного кислорода, а для некоторых из них кислород токсичен. Такие микроорганизмы называются облигатными анаэробами.
Температура. Интервалы температур, в которых возможен рост различных микроорганизмов, заметно варьируют. У мезофиллов температурный оптимум лежит в интервале от 25 до 370С, у термофилов он значительно выше - от 38 до 450С. Психрофилы хорошо развиваются в интервале температур 5-100 С. Отклонения температуры культивирования от оптимальной неблагоприятно влияет на развитие микроорганизмов, поэтому микроорганизмы выращивают в термостатах, где поддерживается постоянная температура.
Свет. Для роста подавляющего большинства микроорганизмов освещение не требуется. Напротив, прямые солнечные лучи отрицательно влияют на их развитие. Свет необходим для роста фототрофных микроорганизмов, однако естественное освещение для этих целей используется крайне редко, т.к. его трудно контролировать. Как правило, фототрофы выращивают в люминостатах.
Вода. Рост микроорганизмов невозможен без присутствия в окружающей среде воды, причем вода должна находиться в доступной для клетки форме, т.е. жидкой фазе. Доступность воды в субстрате для роста микроорганизмов выражают величиной активности воды:
(аw): аw=Р/Р0,
где Р – давление пара над раствором, мм рт.ст; Р0 – давление пара чистой водой при данной температуре, мм рт.ст.
Микроорганизмы могут расти на средах, где аw=0,99-0,61.
Рост культур на различных средах
Рост в жидких средах. При выращивании в жидких средах микроорганизмы вызывают их помутнение, образуют осадок, кольцо, «островки» пленки или цельную пленку. Рост в виде пленки характеризует способность клеток объединяться в мицелиальные структуры (дрожжи, плесени). Пленка может быть тонкой тусклой, иногда сморщенной и всползающей на стенки пробирки, или блестящей, влажной при длительном культивировании. У микроорганизмов, образующих истинный мицелий, формируется толстая прочная пленка, которая впоследствии может превращаться в слизистую массу.
Рост на агаризованных средах. Выращенные на агаризованных питательных средах культуры по консистенции могут быть пастообразными, маслянистыми, слизистыми, рыхлыми, крошащимися, тянущимися, волокнистыми, кожистыми. Цвет штриха зависит от образования некоторых пигментов, как внутриклеточных, так и выделяющихся в среду культивирования.
Метод культивирования на стекле. Расплавленный картофельно-глюкозный агар наливают в чашку Петри и в него, зажав пинцетом, опускают и быстро вынимают стерильные предметные стекла. Покрытые пленкой среды стекла помещают на стеклянную подставку в другой чашке Петри. Посевы делают тонкими штрихами: по три на каждой пластине параллельно короткой стороне стекла или по одному вдоль длинной стороны стекла. Стерильные покровные стекла накладывают на штрихи так, чтобы под ними не было пузырьков воздуха и чтобы часть штриха оставалась свободной. На дно чашки наливают стерильную воду, чтобы избежать пересыхания слоя среды на пластине. Через 6 суток инкубирования при 25оС нижнюю поверхность стекла очищают от среды и микроскопируют. Образование мицелия и псевдомицелия наблюдают в анаэробных (под покровным стеклом) и аэробных (вне стекла) условиях.
Метод пластинок Далмау (в модификации Уикерема). В чашки Петри разливают картофельно-глюкозный агар и подсушивают для избавления от конденсата. Затем в верхней части агаровой пластинки наносят длинный штрих негустой дрожжевой суспензии. В нижней части пластинки с двух сторон делают еще два точечных посева. Центральную часть штриха и одну из точек накрывают стерильными покровными стеклами. Через 6 суток инкубирования при 25оС готовые препараты исследуют под микроскопом.
Культуральные признаки основных видов
микроорганизмов, влияющих на качество продуктов
Пищевые продукты во время хранения подвергаются порче в результате попадания и развития в них различных сапрофитных микроорганизмов. Видовой состав микроорганизмов весьма разнообразен: гнилостные бактерии, микрококки, молочнокислые, маслянокислые, уксуснокислые, пропионовокислые бактерии, плесневые грибы, дрожжи, актиномицеты.
Наряду с сапрофитами в продуктах могут содержаться патогенные и условно-патогенные микроорганизмы – возбудители зооантропонозных болезней, пищевых токсикоинфекций и токсикозов.
Гнилостные микроорганизмы развиваются в продуктах, а также в кишечнике человека и животных. Они вызывают распад белков с образованием токсичных продуктов распада, что может привести к возникновению различных пороков пищевых продуктов: неприятный запах, ослизнение. Употребление таких продуктов приводит к острым пищевым отравлениям. К гнилостным бактериям относят аэробные спорообразующие и неспорообразующие палочки, спорообразующие анаэробы, факультативно-анаэробные неспорообразующие палочки.
Аэробные спорообразующие палочки. Типичные представители - палочки цереус, грибовидная, капустная, картофельная и сенная.
Палочка цереус (Вас. cereus) - это грамположительная палочка длиной 8 мкм, шириной 0,9-1,5 мкм, подвижная, образует споры (рис.5). Отдельные штаммы этого микроорганизма могут формировать капсулу. Может развиваться и при недостатке кислорода воздуха.
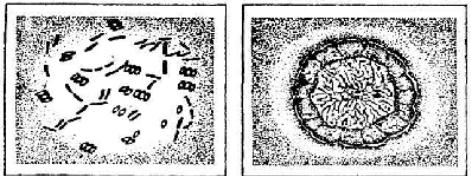
Рис. 5. Грибовидная палочка (Вас. cereus):
а - клетки; б - колония
На поверхности МПА вырастают крупные колонии с изрезанными краями, некоторые штаммы выделяют розово-коричневый пигмент; на кровяном агаре вокруг колоний наблюдается резко очерченная зона гемолиза. При развитии микроорганизм образует нежную пленку, пристеночное кольцо, равномерное помутнение и хлопьевидный осадок на дне пробирки.
Все штаммы интенсивно растут при рН (9-9,5), при рН (4,5-5) прекращают свое развитие. Могут развиваться при концентрации поваренной соли в среде 10-15 %, сахара - до 30-60 %. Оптимальная температура развития (30-32)°С. Палочка свертывает и пептонизирует молоко, быстро разжижает желатин, способна образовывать ацетилметилкарбинол, утилизировать цитратные соли, ферментировать мальтозу и сахарозу. Некоторые штаммы расщепляют лактозу, галактозу, инулин, арабинозу, глицерин.
Капустная палочка (Вас. megatherium) - это грамположительная палочка длиной 3,5-7 мкм и шириной 1,5- 2 мкм. Она располагается одиночно, попарно или цепочками, подвижна, образует споры, капсул не формирует. На МПА вырастают колонии серо-белого цвета, гладкие, блестящие с ровными краями. Капустная палочка вызывает помутнение МПБ с образованием незначительного осадка. Микроб чувствителен к кислой реакции среды. Оптимальная температура развития 25-30оС. Палочка быстро разжижает желатин, свертывает и пептонизирует молоко, вызывает гемолиз эритроцитов, гидролиз крахмала. На средах с глюкозой и лактозой микроб дает кислую реакцию. При развитии капустной палочки выделяются сероводород, аммиак, но индола не образуется.
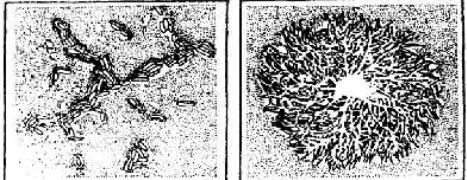
Б
Рис. 6. Картофельная палочка (Вас. mesentericus):
а - клетки; б - колония
Картофельная палочка (Вас. Mesentencus) - это грубая грамположительная палочка с закругленными концами, длиной 1,6-6 и шириной 0,5-0,8 мкм (рис. 6), образует споры, капсул не формирует, подвижна. Картофельная палочка на МПА образует сочные, с морщинистой поверхностью слизистые колонии серо-белого цвета с волнистыми краями. Микроб разжижает желатин, свертывает и пептонизирует молоко, вызывает гидролиз крахмала, выделяет при развитии сероводород, индола не образует, не ферментирует глюкозы и лактозы.
Сенная палочка (Вас. subtilis) - это грамположительная короткая палочка с закругленными концами длиной 3-5, шириной 0,6 мкм, иногда располагается цепочками, образует споры, капсул не образует, подвижна. На МПА вырастают сухие бугристые колонии серо-белого цвета. При росте в МПБ появляется сухая, морщинистая беловатая пленка; бульон сначала мутнеет, а затем становится прозрачным. Микроб чувствителен к кислой реакции среды. Оптимальная температура развития 37оС. Может развиваться и при (5-20)оС.
Палочка характеризуется высокой протеолитической активностью: разжижает желатин и свернутую кровяную сыворотку, свертывает и пептонизирует молоко, выделяет аммиак, иногда сероводород, но не образует индола, вызывает посинение лакмусового молока и гидролиз крахмала, разлагает глицерин, дает кислую реакцию на средах с лактозой, глюкозой, сахарозой. Аэробные неспорообразующие палочки. К этой группе микроорганизмов относятся чудесная, флуоресцирующая, синегнойная палочки.
Флуоресцирующие бактерии (рис. 7) характеризуются высокой ферментативной активностью: разжижают желатин и свернутую кровяную сыворотку, свертывают и пептонизируют молоко; большинство их штаммов способны расщеплять клетчатку и крахмал.
При развитии они образуют сероводород и аммиак, не выделяют индола, глюкозы и лактозы не ферментируют. Бактерии вызывают посинение лакмусового молока. Многие штаммы флуоресцирующих бактерий продуцируют ферменты липазу, лецитиназу; дают положительную реакцию на каталазу, цитохромоксидазу, оксидазу. Флуоресцирующие бактерии – сильные аммонификаторы.

Рис. 7. Флуоресцирующая палочка (Ps. Fluorescehs)
Синегнойная палочка (Ps. aeruginosa) - это грамотрицательная небольшая палочка длиной 2-3, толщиной 0,6 мкм, спор и капсул не формирует, подвижная. На МПА вырастают расплывчатые, непрозрачные, окрашенные в зеленовато-синий или бирюзово-синий цвет колонии. Цвет колоний обусловлен образованием пигментов (желтого - флуоресцина и голубого - пиоцианина). Микроб вызывает помутнение МПБ и выделяет пигменты, иногда на поверхности среды появляется пленка. Пигменты растворимы в хлороформе. Как и все гнилостные бактерии, синегнойная палочка чувствительна к кислой реакции среды, оптимальная температура ее развития 37 °С. Микроб быстро разжижает желатин и свернутую кровяную сыворотку, свертывает и пептонизирует молоко, вызывает посинение лакмусового молока, образует аммиак и сероводород, но не выделяет индола.
Синегнойная палочка обладает липолитической способностью. Она дает положительные реакции на каталазу, оксидазу, цитохромоксидазу (эти свойства присущи представителям рода псевдомонас). Некоторые штаммы микроорганизма расщепляют крахмал и клетчатку, но не ферментируют лактозы и сахарозы.
Спорообразующие анаэробы. К спорообразующим анаэробам относят палочки путрификус и спорогенес.
Палочка путрификус (Cl. putrificus) – это грамположительная палочка длиной 7-9 и шириной 0,4-0,7 мкм, иногда формирует цепочки, образует довольно термоустойчивые споры, превышающие диаметр вегетативной формы, капсул не образует, подвижная. Колонии на МПА имеют вид клубка волос, непрозрачные, вязкие, при росте в МПБ вызывают его помутнение.
Протеолитические свойства микроорганизма ярко выражены: разжижает желатин и кровяную сыворотку, свертывает и пептонизирует молоко. Палочка путрификус образует сероводород, аммиак, индол; вызывает почернение мозговой среды, на кровяном агаре вокруг колоний образуются зоны гемолиза; характеризуется липолитической активностью, но не обладает сахаролитическими свойствами.
Палочка спорогенес (Cl. sporogenes) - это крупная палочка с закругленными концами длиной 3-7 и шириной 0,6-0,9 мкм. В мазках она располагается одиночно или формирует цепочки. Палочка спорогенес быстро образует споры, которые сохраняют жизнеспособность после 30-минутного нагревания на водяной бане, а также после 20-минутного выдерживания в автоклаве при 120°С, капсул не образует. Микроб подвижный, грамположительный. На МПА вырастают мелкие вначале прозрачные колонии, по мере старения культуры они становятся непрозрачными. Оптимальная температура роста микроорганизма 37°С, но может расти и при 50 ° С. Палочка спорогенес обладает очень сильной протеолитической активностью: вызывает гнилостный распад белков с образованием газов; разжижает желатин и свернутую кровяную сыворотку, свертывает и пептонизирует молоко. Микроорганизм образует сероводород, разлагает с образованием кислоты и газа галактозу, мальтозу, декстрин, левулезу, маннит, сорбит, глицерин.
Факультативно-анаэробные неспорообразующие палочки. К ним относят палочку протея обыкновенного (Proteus vulgaris) и кишечную палочку (Escherichia coli).
П алочка
протея (Рг.
vulgaris) обладает полиморфностью, т.е. может
образовывать нити длиной 1;2-3 и шириной
0,5-0,6 мкм. Спор и капсул не формирует.
Палочка обладает активной подвижностью
(перитрихи), грамотрицательна (рис. 8).
При посеве материала, содержащего
палочку протея, в конденсационную воду
свежескошенного агара (метод Шукевича)
через несколько часов отмечается роение
микроба, ползучий рост (Н-форма).
Поверхность МПА покрывается тонкой
нежной, прозрачной пленкой. Посев по
методу Шукевича широко применяют в
диагностических лабораториях при
выделении палочки протея из объектов
внешней среды и продуктов. Этот
микроорганизм сбраживает глюкозу с
образованием кислоты и газа, но не
ферментирует лактозы и маннита. Расщепляет
мочевину, разжижает желатин, выделяет
сероводород, образует индол, сбраживает
мальтозу.
алочка
протея (Рг.
vulgaris) обладает полиморфностью, т.е. может
образовывать нити длиной 1;2-3 и шириной
0,5-0,6 мкм. Спор и капсул не формирует.
Палочка обладает активной подвижностью
(перитрихи), грамотрицательна (рис. 8).
При посеве материала, содержащего
палочку протея, в конденсационную воду
свежескошенного агара (метод Шукевича)
через несколько часов отмечается роение
микроба, ползучий рост (Н-форма).
Поверхность МПА покрывается тонкой
нежной, прозрачной пленкой. Посев по
методу Шукевича широко применяют в
диагностических лабораториях при
выделении палочки протея из объектов
внешней среды и продуктов. Этот
микроорганизм сбраживает глюкозу с
образованием кислоты и газа, но не
ферментирует лактозы и маннита. Расщепляет
мочевину, разжижает желатин, выделяет
сероводород, образует индол, сбраживает
мальтозу.

Рис. 8. Палочка протея обыкновенного (Pr. Vulgaris)
К ишечная
палочка (Е. coli)
- это короткая (длина 1-3, ширина 0,5-0,8 мкм),
полиморфная, грамотрицательная, не
образующая спор, подвижная палочка
(рис. 9). Хорошо растет на простых
питательных средах: на МПА - колонии
прозрачные, с серовато голубым отливом,
легко сливающиеся между собой. В МПБ
микроорганизм дает обильный рост при
значительном помутнении среды, образует
пристеночное кольцо, пленка на поверхности
бульона обычно отсутствует. На плотной
дифференциально-диагностической среде
Эндо, содержащей лактозу, кишечная
палочка образует плоские красные колонии
с темным металлическим блеском. Не
разжижает желатина, не дает роста на
средах, содержащих лимонную кислоту
или ее соли, свертывает молоко, расщепляет
пептоны с образованием аминов, аммиака,
сероводорода, индола, обладает высокой
ферментативной активностью по отношению
к лактозе, глюкозе и другим сахарам, а
также спиртам.
ишечная
палочка (Е. coli)
- это короткая (длина 1-3, ширина 0,5-0,8 мкм),
полиморфная, грамотрицательная, не
образующая спор, подвижная палочка
(рис. 9). Хорошо растет на простых
питательных средах: на МПА - колонии
прозрачные, с серовато голубым отливом,
легко сливающиеся между собой. В МПБ
микроорганизм дает обильный рост при
значительном помутнении среды, образует
пристеночное кольцо, пленка на поверхности
бульона обычно отсутствует. На плотной
дифференциально-диагностической среде
Эндо, содержащей лактозу, кишечная
палочка образует плоские красные колонии
с темным металлическим блеском. Не
разжижает желатина, не дает роста на
средах, содержащих лимонную кислоту
или ее соли, свертывает молоко, расщепляет
пептоны с образованием аминов, аммиака,
сероводорода, индола, обладает высокой
ферментативной активностью по отношению
к лактозе, глюкозе и другим сахарам, а
также спиртам.

Рис. 9. Кишечная палочка (Е. coli)
Грибы. В природе насчитывается более 100 тыс. видов грибов (рис 10). В основном это сапрофиты, микроорганизмы не развиваются на живых существах. Плесневые грибы и многие виды дрожжей могут быть возбудителями пороков пищевых продуктов.
Плесневые грибы. Они являются постоянными обитателями внешней среды, на поверхности субстрата образуют ползучие, стелющиеся, бархатистые, пушистые, войлокообразные колонии, которые сливаются в сплошной налет. Наиболее благоприятные условия для развития плесневых грибов - свободный доступ кислорода и кислая реакция среды. Они могут развиваться при влажности окружающей среды 10-15%, рН 1,5-11, температуре до -11°С (из рода мукоровых), высоком осмотическом давлении, а отдельные виды плесневых грибов - при ограниченном доступе кислорода. Плесневые грибы обладают ферментативной активностью (протеолитической, липолитической и др.), вызывают глубокий распад белков и белковых веществ, разлагают жиры до жирных кислот и альдегидов. При их развитии на мясе происходит его ослизнение и плесневение, сопровождающиеся химическими превращениями, которые обусловливают изменение его запаха и вкуса. Снижается товарный вид мяса.
а |
б |
в |
г |
Рис. 10. Морфологические особенности грибов различных классов:
а - Mucor; б - Penicillium; в - Aspergillus; г - Alternaria
Д рожжи.
Это факультативные
анаэробы, лучше развиваются в кислой
среде, оптимальная температура роста
20-30° С, но многие из них способны
развиваться и при -10 °С. Вегетативные
формы дрожжей погибают при 60-65°С, а споры
- при 70-75 °С. Дрожжи распространены во
внешней среде, откуда попадают на
продукты. Различные виды дрожжей
сбраживают большинство углеводов
(глюкозу, лактозу, сахарозу, декстрозу,
мальтозу). Микроорганизмы рода микодерма
(Mycoderma), не сбраживающие углеводов,
получили название пленчатых дрожжей.
Клетки пленчатых дрожжей имеют вытянутую
форму. Эти дрожжи широко распространены
в природе, попадая на продукты, вызывают
их порчу. Так, развиваясь на мясе,
дрожжевые клетки используют молочную
кислоту, изменяют рН мяса, а также портят
его товарный вид. При расщеплении жиров
образуются свободные жирные кислоты,
что ведет к прогорканию продукта. Многие
дрожжи обладают липолитической
способностью. Гнилостной порчи эти
микроорганизмы не вызывают, но в
результате плесневения и ослизнения
мяса сокращаются сроки его хранения в
охлажденном и замороженном состоянии.
рожжи.
Это факультативные
анаэробы, лучше развиваются в кислой
среде, оптимальная температура роста
20-30° С, но многие из них способны
развиваться и при -10 °С. Вегетативные
формы дрожжей погибают при 60-65°С, а споры
- при 70-75 °С. Дрожжи распространены во
внешней среде, откуда попадают на
продукты. Различные виды дрожжей
сбраживают большинство углеводов
(глюкозу, лактозу, сахарозу, декстрозу,
мальтозу). Микроорганизмы рода микодерма
(Mycoderma), не сбраживающие углеводов,
получили название пленчатых дрожжей.
Клетки пленчатых дрожжей имеют вытянутую
форму. Эти дрожжи широко распространены
в природе, попадая на продукты, вызывают
их порчу. Так, развиваясь на мясе,
дрожжевые клетки используют молочную
кислоту, изменяют рН мяса, а также портят
его товарный вид. При расщеплении жиров
образуются свободные жирные кислоты,
что ведет к прогорканию продукта. Многие
дрожжи обладают липолитической
способностью. Гнилостной порчи эти
микроорганизмы не вызывают, но в
результате плесневения и ослизнения
мяса сокращаются сроки его хранения в
охлажденном и замороженном состоянии.
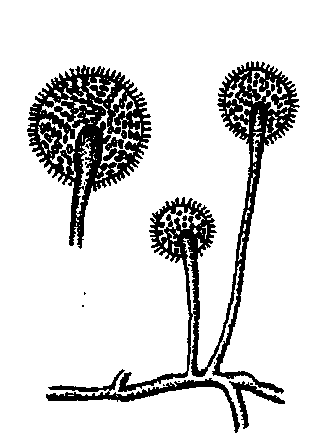
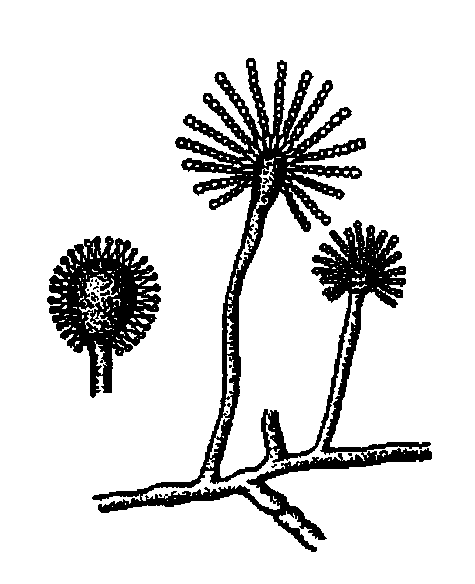
Актиномицеты. Большинство видов актиномицетов хорошо развиваются при 25-30 °С, для патогенных видов температурный оптимум составляет 37-40°С. Актиномицеты широко распространены в природе - это одни из многочисленных гнилостных микроорганизмов. Они способны вызывать гниение белковых субстратов, гидролиз жира. Развиваясь на мясе при -2-3°C , актиномицеты придают ему неприятный землистый запах.
Микрококки. Семейство микрококки (Micrococcaceae) включает роды: микрококкус (Micrococcus), стафилококкус (Staphylococcus), capцина (Sarcina). Кокки этого семейства обычно имеют форму шара. Большинство представителей семейства микрококкацее - аэробы и факультативные анаэробы. Небольшое число видов относится к облигатным анаэробам. Микроорганизмы семейства микрококкацее широко распространены в природе. Наряду с сапрофитными обнаруживаются и патогенные виды, которые могут вызвать различные патологические процессы в организме человека и животного, а также быть причиной пищевых отравлений. Микрококки - строгие аэробы в отличие от стафилококков. На МПА образуют средней величины круглые белого, желтого или розового цвета колонии. Встречаются также различные оттенки от красного до оранжевого цвета. Большинство сапрофитов выделяют розовый и желтый пигменты. Оптимальная температура развития 20-25° С. Многие виды могут развиваться при 5-8°С. Микрококки характеризуются высокой устойчивостью к соли и сахару, относятся к пептонизирующим микроорганизмам. Некоторые виды разлагают жир и придают продукту прогорклый вкус.
Микробактерии. Мелкие палочки неправильной формы, при окрашивании метиленовым синим наблюдается зернистость. Палочки развиваются при 15-35° С; оптимальная температура роста 30 °С: Эти микроорганизмы являются наиболее устойчивыми к высокой температуре из всех известных бесспоровых бактерий.
Маслянокислые бактерии. Представляют собой палочки цилиндрической формы, длиной от 5-7 до 7-12 мкм и толщиной 0,5-1,5 мкм (рис. 11). Бактерии подвижны, образуют споры (клостридии), капсул не образуют. Споры выдерживают кипячение 1-2 мин, не погибают при пастеризации. Маслянокислые бактерии по Граму красятся положительно, содержат гранулезу (крахмалоподобное вещество), являются анаэробами. Оптимальная температура развития бактерий 30-35°С, минимальная 8-10, максимальная 45 °С. Характерными признаками этих бактерий являются бурное газообразование при развитии, неприятный запах масляной кислоты. Маслянокислые бактерии сбраживают молочный сахар и расщепляют соли молочной кислоты. При этом образуются масляная, уксусная, пропионовая, муравьиная кислоты и небольшое количество спирта (этилового, бутилового, пропилового). Маслянокислые бактерии способны усваивать белковый, аминокислотный и аммонийный азот, а некоторые виды - даже азот воздуха. Они чувствительны к кислой реакции среды.
Р ис.
11. Маслянокислые бактерии
ис.
11. Маслянокислые бактерии
Уксуснокислые бактерии. Уксуснокислые бактерии представляют собой палочки, не образующие спор, подвижные (встречаются и неподвижные), располагаются одиночно или цепочками. Это строгие аэробы. Оптимальная температура развития бактерий 30°С. Колонии уксуснокислых бактерий вырастают только на поверхности питательной среды, на жидких питательных средах они образуют пленку (на поверхности свернувшегося молока появляется оранжевое кольцо). При доступе воздуха бактерии легко окисляют спирт в уксусную кислоту. Возбудителями уксуснокислого брожения являются бактериум ацети (Bact. aceti), бактериум орлеанзе (Bact. orleanse) и др.
Задание 1. Изучить морфологию микроорганизмов в предложенных вариантах накопительного субстрата.
Вариант 1. Накопительная культура картофельной палочки Bacillus subtilis, полученная следующим образом: очищенный картофель нарезают ломтиками, помещают в чашки Петри и прогревают 10 мин при температуре 100оС в стерилизаторе (инактивируются все вегетативные клетки микроорганизмов), после чего помещают в термостат на 2-3 дня при температуре 25-30оС. На картофеле прорастают споры и образуется крепкая морщинистая пленка, при микроскопировании которой видны подвижные палочки длиной до 4-5 мкм, часто соединенные в цепочки.
Вариант 2. Накопительная культура уксуснокислых бактерий, полученная следующим образом: в пробирку со стерильным молоком, подкисленным до рН 5,5-5,8, вносят петлей кефирную закваску, выдержанную 48 ч. при комнатной температуре. Получение биомассы выражается в свертывании молока и образовании желтого кольца на поверхности сгустка.
Вариант 3. Накопительная культура маслянокислых бактерий (род Clostridium), полученная следующим образом: в большую пробирку или колбу на 50 мл помещают несколько кусочков неочищенного картофеля, четверть чайной ложки мела, заливают водопроводной водой (расстояние до пробки 2-3 см), закрывают ватной пробкой и пастеризуют при 80оС в течение 10 мин в водяной бане, после чего помещают в термостат при температуре 37оС.Через 1-2 суток в жидкости на дне пробирки при микроскопировании обнаруживается большое количество подвижных палочек. Для микроскопирования берут культуральную жидкость со дна пробирки, вблизи ломтиков картофеля.
Задание 2. Изучить биохимические методы идентификации бактерий в предложенных вариантах накопительного субстрата:
а. Изучить способность к ферментации углеводов методом «пестрого ряда».
Для определения сахаролитической активности применяют среды Хисса; в их состав входят 1% пептонная вода, индикатор Андраде и один из углеводов. При расщеплении углевода происходит изменение цвета среды с жёлтого на красный. Поскольку бактерии различают по способности ферментировать те или иные углеводы, то ряды пробирок приобретают пёстрый вид. Поэтому этот набор сред и называют «пёстрый» (или цветной) ряд.
При определении способности микроорганизмов к ферментации углеводов в пронумерованный ряд пробирок с разным количеством лактозы засевают одинаковое количество накопительной культуры (1 микробиологическая петля). Результаты оценивают через 72 ч.
б. Изучить способность бактерий к расщеплению белков.
Некоторые бактерии проявляют протеолитическую активность, выделяя протеазы, катализирующие расщепление белков. Наличие у культуры протеолитических ферментов из группы коллагеназ определяют при посеве уколом на среду КМАФАнМ. При положительном результате наблюдают ее разжижение в виде воронки либо послойно сверху вниз. Способность к расщеплению белков и аминокислот также можно оценивать по изменению окраски среды, так как образующиеся продукты - аммиак, индол и сероводород - сдвигают рН в щелочную сторону, вызывая изменение окраски индикатора.
Пробирки со средой после засева культуры ставят в термостат на 37оС на 72 ч. По истечении этого времени отмечают разжижение среды вокруг укола петлей.
в. Изучить способность микроорганизмов к образованию аммиака. Для определения способности к образованию NH3 проводят посев на среду КМАФАнМ, и между ее поверхностью и пробкой закрепляют полоску лакмусовой бумаги. При положительном результате бумажка синеет.
Рекомендуется поместить лакмусовую бумажку в вариант засева по пункту б) для избежания дублирования засева.
г. Определить пектолитическую активность.
Исследуемые бактериальные культуры засевают «медальонами” на поверхность полноценной питательной агаризованной среды, содержащей ионы Са2+, с нанесенным на нее пектиновым гелем. После инкубирования в течение 72 ч при 37оС продукцию пектолитических ферментов регистрируют по образованию лунок на поверхности геля.
Контрольные вопросы
Характеристика метода «накопительных культур».
Методы культивирования при получении биомассы микроорганизмов.
Факторы, влияющие на интенсивность роста микроорганизмов при получении накопительной культуры.
Рост культур на различных средах.
Культуральные признаки микроорганизмов, влияющие на качество пищевых продуктов
Методы получения отдельных видов накопительных культур.
Биохимические методы идентификации бактерий.
Лабораторная работа № 4
ИЗУЧЕНИЕ МИКРОФЛОРЫ ЗЕРНОМУЧНЫХ
ИЗДЕЛИЙ И МЕТОДОВ ПРЕДОТВРАЩЕНИЯ
КАРТОФЕЛЬНОЙ БОЛЕЗНИ ХЛЕБА
Цель занятия: Провести первичную оценку хлеба на признаки микробиологической порчи. Провести анализ представленных образцов хлеба на присутствие бацилл картофельной палочки.
Требования к качеству ржано-пшеничного хлеба
Качество хлеба оценивают органолептически (по внешнему виду, состоянию мякиша, вкусу и запаху) и по физико-химическим показателям (влажности, кислотности, содержанию сахара, жира, пористости). Форма изделий должна соответствовать их наименованию, быть нерасплывчатой, без боковых наплывов. Поверхность гладкая, без трещин, окраска корок равномерная, небледная и неподгоревшая.
Состояние мякиша изделий характеризуется его пропеченностью, промесом, пористостью, эластичностью и свежестью. У пропеченных изделий мякиш сухой, нелипкий, невлажный на ощупь, без комочков и следов непромеса, эластичный, нечерствый и некрошливый. Пористость объективно определяют как отношение объема пор мякиша к общему объему хлебного мякиша, выраженное в процентах. Пористость ржано-пшеничного хлеба – 46-62 %. Мякиш с хорошей эластичностью у остывшего хлеба быстро приобретает первоначальную форму после продавливания.
Свежие изделия имеют сухую корку с ровной поверхностью, мякиш однотонный, эластичный, мягкий, вкус и запах, свойственные названию изделий, без признаков горечи, посторонних привкусов и запахов. Массовая доля влаги в ржано-пшеничном хлебе 45-50 %. Кислотность ржано-пшеничного хлеба – 7-11°Н. Пористость ржано-пшеничного хлеба – 49-62%.
Различают дефекты внешнего вида, мякиша, дефекты вкуса и запаха. Дефекты внешнего вида – неправильная форма хлеба, трещины, надрывы на корке, горелая или бледная корка, отсутствие глянца на ней. Дефекты мякиша - непромес, отставание корки от мякиша, закал, крошливость, неравномерная пористость и непропеченность мякиша. Дефекты вкуса – излишне пресный, кислый, солёный, горький – возникают при нарушении рецептуры.
Болезни хлеба вызывают микроорганизмы.
Картофельная болезнь вызывается картофельной палочкой, содержащейся в муке. Мякиш такого пшеничного хлеба имеет неприятный запах и темную, тягучую массу. Такой хлеб не пригоден к употреблению.
Меловая болезнь вызывается дрожжевыми грибами, и в мякише образуются белые пятна, которые преобразуются в порошок, похожий на мел.
Плесневение хлеба возникает при длительном и неправильном хранении. На хлебе появляется белая, черная или зеленая плесень, которая придает ему неприятный вкус и запах.
Физиолого-биохимические свойства возбудителя
картофельной болезни хлеба
Картофельная палочка широко распространена в природе, особенно в картофеле, куда она попадает из почвы. Картофельная палочка вызывает «тягучую» болезнь хлеба, которая наносит большой экономический ущерб пищевой промышленности и потребителям.
Bac. mesentericus образует очень стойкие центральные споры, которые выдерживают нагревание при 100оС в течение 6 ч. Это грубая палочка с закругленными концами, подвижна, споры ее совпадают размерами с поперечным размером клетки.
На питательной среде Bac. mesentericus образуют слизистые колонии матового или сероватого цвета с волнистыми краями и радиальной складкой, отходящей от центра. Отдельные штаммы выделяют серо-бурый или коричневатый пигмент, они вызывают слабое помутнение или появление пленки на питательной среде. В жидкой среде на поверхности образуется морщинистая беловатая пленка.
Бактерии чувствительны к кислой реакции среды, поэтому актуальным направлением пищевой промышленности является разработка технологий получения заквасок для хлебопекарной промышленности, с применением микроорганизмов, обладающих антагонистическим действием по отношению к картофельной палочке. Все способы подавления размножения бацилл основаны на биологических принципах. С этой целью применяются также консерванты: соли пропионовой, молочной и уксусной кислот, а также бромат калия и др.
Бактерии относятся к классу гнилостных, они аэробны, обладают протеолитической активностью, т.к. выделяют ферменты класса протеаз, разлагая белки с выделением дурнопахнущих веществ. Палочки восстанавливают нитраты до нитритов, имеют высокую каталазообразующую способность, активно гидролизируют крахмал (что делает мякиш хлебобулочных изделий липким и тянущимся), свертывают и пептонизируют молоко, при разложении белка выделяют сероводород.
Причинами развития картофельной палочки в хлебобулочных изделиях являются:
- сильное обсеменение муки спорами картофельной палочки в результате плохой очистки и мойки зерна на мельнице, а также при несоблюдении режимов хранения муки и зерна, особенно при повышении температуры воздуха в летнее время года;
- обсемененность оборудования или помещения хлебозавода зараженной мукой, при несоблюдении санитарных режимов обработки на предприятии;
- нарушение режимов и условий вторичной переработки хлеба: сушка брака при низкой температуре, приготовление сухарной крошки из зараженного хлеба, поступление большого количества брака из торговой сети;
- нарушение технологических параметров при производстве и реализации хлеба: кислотности, влажности, пропеченности, режима хранения хлеба в экспедиции хлебозавода и торговой сети.
Изучение особенностей возбудителя и источников его попадания в зерномучные изделия позволят разработать новые способы и рекомендации по предупреждению развития данного заболевания и меры по ликвидации его последствий.