Методическое указание к лабораторной работе № 1-3
по дисциплине Пищевая микробиология
для студентов 2 курса 260800
Технология продуктов общественного питания
Уфа 2012
Лабораторная работа № 1
МИКРОБИОЛОГИЧЕСКАЯ ЛАБОРАТОРИЯ И ПРАВИЛА РАБОТЫ В НЕЙ
В учебных заведениях не разрешается работать с живыми патогенными микроорганизмами. Необходимо помнить, что при посеве сапрофитных микроорганизмов из окружающей среды случайно может быть внесена и патогенная микрофлора. Кроме того, работа с сапрофитными бактериями в ряде случаев требует абсолютной стерильности для получения надежных результатов опыта. В микробиологической практике используют главным образом чистые культуры микроорганизмов. Культуру, содержащую микроорганизмы одного вида, называют чистой. Если в культуре содержится более одного вида микроорганизмов, она носит название смешанной.
Микробиологическая лаборатория включает ряд помещений, где проводят работу с микроорганизмами или подготовку к ней. Поверхность столов и пол всех лабораторных помещений покрывают легко моющимся материалом. В основном рабочем помещении находятся аппаратура, посуда и реактивы. Столы имеют подводку электроэнергии и снабжены газовыми горелками. Кроме основного рабочего помещения лаборатория имеет стерилизационную, где размещены автоклавы и сушильные шкафы, бокс, моечную, холодильную комнату, термостаты или термостатированные комнаты для выращивания микроорганизмов, помещение для хранения культур и т.д.
Подготовка микробиологической лаборатории к работе
Для того чтобы снизить количество микроорганизмов в воздухе и на различных поверхностях, в лабораторных помещениях применяют различные способы дезинфекции. Слово «дезинфекция» означает обеззараживание, то есть уничтожение возбудителей инфекционных болезней на объектах внешней среды.
Пол, стены и мебель в микробиологической лаборатории протирают растворами различных дезинфицирующих веществ, в качестве которых чаще всего используют 2 - 3%-ный раствор соды (бикарбоната натрия), 3 - 5%-ный раствор фенола (карболовой кислоты) или лизола (препарат фенола с добавлением зеленого мыла), 0,5 - 3%-ный водный раствор хлорамина и некоторые другие дезинфектанты.
Воздух в лаборатории наиболее просто дезинфицировать проветриванием. Продолжительная вентиляция помещения через форточку (не менее 30-60 мин) приводит к резкому снижению количества микроорганизмов в воздухе, особенно при значительной разнице в температуре между наружным воздухом и воздухом помещения. Более эффективный и наиболее часто применяемый способ дезинфекции воздуха - облучение ультрафиолетовыми лучами с длиной волны от 200 до 400 нм. Ультрафиолетовые лучи обладают слабой проникающей способностью, поэтому в зависимости от степени загрязненности воздуха для его стерилизации требуется облучение от 30 мин до нескольких часов. Необходимо иметь в виду, что ультрафиолетовые лучи могут вызвать тяжелые поражения глаз. Поэтому при работе с бактерицидными лампами нужно строго следить за тем, чтобы ни прямые, ни отраженные ультрафиолетовые лучи не попадали в глаза. В небольших помещениях при включенной бактерицидной лампе находиться нельзя.
Рабочее место, где непосредственно проводится работа с культурами микроорганизмов, требует особенно тщательной обработки. Рабочий стол следует дезинфицировать не только до начала работы, но и после ее окончания. Для протирания поверхности стола можно использовать растворы лизола и хлорамина, а также 70%-ные (по объему) растворы изопропилового или этилового спиртов. В лаборатории не разрешается курить, хранить и употреблять еду, напитки, жевательную резинку. Работать следует в халатах.
Правила работы с культурами микроорганизмов
В лаборатории микроорганизмы выращивают в питательных средах, которые разливают в пробирки, колбы, матрацы и чашки Петри. Внесение микроорганизмов в стерильную среду называется посевом, или инокуляцией. Перед посевом следует тщательно надписать на пробирке (колбе или чашке Петри) название микроорганизма и дату посева. Надпись делают маркером на стекле или на наклеенной этикетке. Клетки микроорганизмов для посева или приготовления препаратов берут бактериологической петлей, если микроорганизмы выращены на плотной среде. В том случае, когда пересевают культуры микроорганизмов, выросшие в жидкой питательной среде, пользуются стерильной пипеткой. Использованную пипетку следует немедленно перенести в дезинфицирующий раствор, например 3 - 5%-ный водный раствор фенола или 2%-ный раствор хлорамина, не касаясь ею окружающих предметов.
Все манипуляции при посеве следует проводить около пламени горелки (но не в пламени). Нельзя делать резкие движения и ходить около лица, работающего с чистой культурой, так как движение воздуха увеличивает вероятность случайного ее загрязнения.
2. Методы стерилизации питательных сред и посуды
Стерилизация является одним из важнейших и необходимых прие-мов в микробиологической практике. Слово «стерилизация» в переводе с латинского означает обеспложивание. В практической работе под стерилизацией понимают методы, применяемые для уничтожения всех форм жизни как на поверхности, так и внутри стерилизуемых объектов. Различают термическую и холодную стерилизацию. Способы термической стерилизации: прокаливание в пламени и обжигание, сухожаровая стерилизация (горячим воздухом), стерилизация насыщенным паром под давлением (автоклавирование), дробная стерилизация (тиндализация), кипячение. Методы холодной стерилизации: стерилизация фильтрованием, газообразными средствами, ультрафиолетовыми лучами и другими видами излучений.
Возможность и целесообразность применения того или иного способа определяется в первую очередь физико-химическими свойствами материала, подлежащего стерилизации, а иногда и целью исследования.
Стерилизация питательных сред насыщенным паром под давле-
нием (автоклавирование)
Совместное действие высокой температуры и давления пара обеспе-
чивает особую эффективность данного способа (табл. 1).
Таблица 1 Температура насыщенного пара при разных давлениях
Давление |
Температура, °С |
|
нормальное, атм |
кПа |
|
1,0 |
101,32 |
100 |
1,5 |
151,98 |
111 |
2,0 |
202,65 |
121 |
2,5 |
251,20 |
128 |
3,0 |
299,75 |
134 |
При этом погибают и вегетативные клетки, и споры микроорганизмов. Установлено, что споры большинства микроорганизмов не выдерживают и 5-минутную экспозицию в насыщенном паре при 121 °С. Стерилизацию текучим паром под давлением осуществляют в автоклавах. Автоклав представляет собой металлический двустенный резервуар, способный выдерживать высокое давление, в который помещают стерилизуемый материал на специальную подставку. Предметы следует размещать не слишком плотно, так как пар должен проходить между ними, иначе они не нагреваются до нужной температуры и могут остаться нестерильными. По окончании времени стерилизации автоклав открывают, когда давление в нем сравняется с атмосферным. Преждевременное открывание крана автоклава недопустимо, так как перегретые среды при резком снижении давления сразу же бурно закипают, смачивают и даже иногда выталкивают ватные пробки, что нарушает впоследствии стерильность материала.
К работе с автоклавом допускаются только подготовленные лица!
Подготовка сред к стерилизации. При автоклавировании 3 - 5 % жидкости теряются в результате испарения, поэтому рекомендуется в приготавливаемые среды добавлять сверх объема примерно 5% дистиллированной воды. Тогда после стерилизации среда (раствор) будет иметь требуемую концентрацию. Среды обычно стерилизуют в пробирках, колбах, бутылях. Емкости заполняют средой не более чем на половину их высоты, чтобы предотвратить смачивание пробок. Сосуды со средами закрывают ватными пробками с бумажными колпачками. Стеклянные, резиновые, корковые и другие пробки завертывают в двойной слой оберточной бумаги и стерилизуют привязанными к склянке, закрытой ватной пробкой.
Выбор режима автоклавирования. В микробиологической практике стерилизацию в автоклавах осуществляют при температуре в пределах 111-138 °С, т.е. от 0,5 до 2,5 атм. Температура ниже 111 °С не может считаться надежной; а выше 138 0С, как правило, не является необходимой, к тому же, чем выше давление пара, тем сложнее условия эксплуатации автоклава. Микробиологи чаще всего стерилизуют среды при 0,5 и 1 атм.Температура и длительность автоклавирования питательных сред определяются, прежде всего, их составом, термоустойчивостью или термолабильностью компонентов. Такие легко разрушающиеся субстраты, как молоко или желатиновые среды, а также субстраты, содержащие сахара, витамины (пивное сусло, соки, дрожжевой автолизат и др.) обычно стерилизуют при 0,5 атм в течение 1 5 - 3 0 мин. Мясопептонные среды можно стерилизовать при 1,0 атм 20 мин. С трудом поддаются стерилизации в автоклаве различные порошки (например тальк) и вязкие жидкости (глицерин, вазелиновое масло), поэтому их лучше стерилизовать в сушильных шкафах при 160 °С в течение 2 или 1 ч при 170 °С. В этом случае слой масла или порошка в сосуде не должен превышать 1,5 см. После автоклавирования среды для проверки стерильности выдерживают 2 - 3 сут в термостате при 30 0С. Если в средах обнаруживается рост микроорганизмов, их готовят заново.
Дробная стерилизация (тиндализация) и пастеризация
Она применяется для сред, портящихся под действием температур выше 100 °С. Тиндализацию осуществляют текучим паром а автоклаве с незавинченной крышкой. Среды прогревают несколько раз по 10 - 15 мин. Между прогреваниями среды ставят в термостат при температуре 3 0°С н а 8 - 1 2 ч для прорастания жизнеспособных спор. Среды, не выдерживающие нагревания при 100 °С, прогревают более осторожно при 60 - 80°С через каждые 8 - 1 2 ч 4 - 5 дней подряд.
Однократный прогрев материала при температуре ниже 100°С известен под названием пастеризация. Этот метод, предложенный Пастером, предназначен для уничтожения только бесспоровых форм микроорганизмов. Следовательно, в подавляющем большинстве случаев он не обеспечивает стерильности. Пастеризацию проводят при 60-80°С 10 - 30 мин. Этот процесс используют в пищевой промышленности для обработки молока, фруктовых соков, вина, пива и др.
Стерилизация стеклянной посуды. Основным способом стерилизации стеклянной посуды является обработка ее сухим горячим воздухом при температуре не выше 180 ° в течение 1 - 3 ч (табл. 2). При этом погибают и вегетативные клетки, и споры микроорганизмов. Стерилизацию осуществляют в специальных суховоздушных (сухожаровых) стерилизаторах и сушильных шкафах, приспособленных для стерилизации и обеспечивающих автоматическое поддержание необходимой температуры.
Таблица 2
Время, необходимое для стерилизации стеклянной посуды сухим жаром
Температура, °С |
Время, мин |
140 |
180 |
150 |
150 |
160 |
120 |
170 |
60 |
Посуда перед стерилизацией должна быть тщательно вымыта и завернута в бумагу для сохранения стерильности после прогревания. После этого ее загружают в стерилизатор (или в сушильный шкаф) не слишком плотно, чтобы обеспечить циркуляцию воздуха и равномерный надежный прогрев стерилизуемого материала. По окончании стерилизации шкаф не открывают до тех пор, пока температура в нем не упадет до 80 °С, так как при резком охлаждении иногда нарушается стерильность материала, а сильно нагретое стекло может растрескаться.
Стерилизация инструментов и приборов. Мелкие металлические инструменты - петли, иглы, пинцеты, ножницы, шпатели - стерилизуют прокаливанием в пламени (т.е. нагреванием докрасна) непосредственно перед использованием. На пламени кратковременно обжигают предметные и покровные стекла, стеклянные шпатели и палочки, фарфоровые ступки и пестики, горлышки колб, пробирок, бутылок, а также ватные пробки при посевах культур и разливе сред. В пламени погибают и вегетативные клетки, и споры микроорганизмов.
Стерилизация облучением В микробиологической практике используют ультрафиолетовое облучение. Мощность ультрафиолета измеряется в бактах. Доза УФ-излучения, губительная для различных видов микроорганизмов (кроме спор), составляет 5 мкб/см.
УСТРОЙСТВО МИКРОСКОПА И ПРАВИЛА РАБОТЫ С НИМ.
Цель работы: Изучить устройство светового биологического микроскопа и освоить правила работы с ним. Ознакомиться с различными видами микроскопии. Приобрести навыки по приготовлению фиксированных препаратов дрожжей.
Оборудование, материалы: Микроскоп; бактериологические петли; предметные стекла; спиртовка; иммерсионное масло; фильтровальная бумага; промывалка; дрожжи Sascharomyces, 96 %-ный этиловый спирт.
2.1 КРАТКИЕ ТЕОРЕТИЧЕСКИЕ ПОЛОЖЕНИЯ
2.1.1 Устройство микроскопа и правила работы с ним
Микроскоп (от греч. micros – малый и scopio – смотрю) – это оптический прибор, состоящий из трех основных частей: механической, оптической и осветительной.
Устройство микроскопа
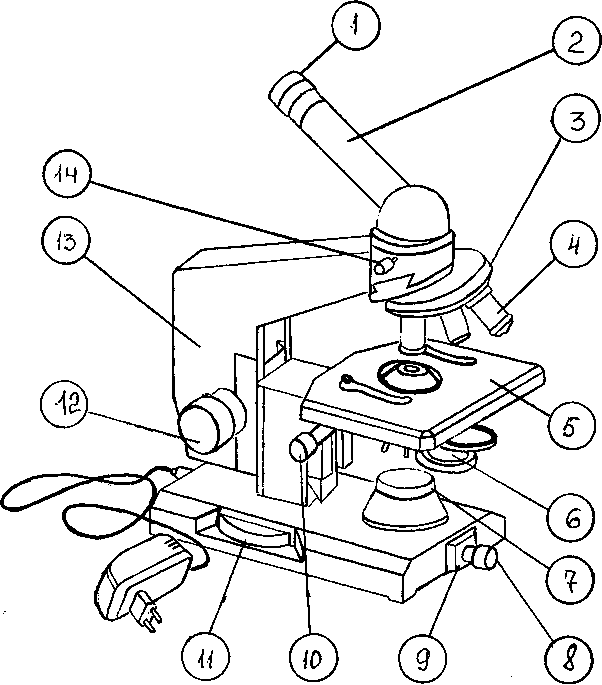
Схема светового биологического микроскопа представлена на рис. 1.
Механическая часть или штатив состоит из ножки, основания, тубусодержателя, предметного столика, монокулярной насадки (тубуса), револьверного устройства, рукоятки грубой фокусировки (макрометрического винта), рукоятки тонкой фокусировки (микрометрического винта).
Тубус – зрительная труба микроскопа. В верхнее отверстие тубуса свободно вставляется окуляр, на нижнем конце тубуса находится вращающееся вокруг своей оси револьверное устройство (револьвер), в которое ввинчиваются объективы. Вращая револьвер, можно быстро сменить объективы во время работы с микроскопом, подводя любой объектив под тубус. Объектив должен быть центрирован, т.е. установлен на оптическую ось микроскопа. Для этого револьвер поворачивают вокруг своей оси до появления щелчка.
Предметный столик служит для размещения на нем изучаемого препарата. Препарат закрепляют на столике зажимами (клеммами). В центре предметного столика находится отверстие для прохождения лучей света и освещения препарата. В некоторых конструкциях микроскопа предметный столик может передвигаться с помощью винтов, расположенных по периферии предметного столика. Это дает возможность рассмотреть препарат в различных полях зрения.
Рукоятки грубой и тонкой фокусировки (макро- и микровинты) служат для перемещения тубуса вверх и вниз, что позволяет установить его на необходимом расстоянии от препарата. При вращении винтов по часовой стрелке тубус опускается, а при вращении против часовой стрелки – поднимается. При вращении макрометрического винта объектив ориентировочно устанавливается на фокус, т.е. на то расстояние от препарата, при котором он делается видимым. Оборот макровинта позволяет переместить тубус на 20 мм. Микрометрический винт служит для точной установки на фокус. Полный оборот его перемещает тубус на 0,1 мм. С микровинтом следует обращаться очень осторожно: допустимо вращение микровинта не более чем на 180 0С в ту или иную сторону.
Оптическая часть является наиболее ценной частью микроскопа. Она состоит из объективов и окуляра.
Окуляр (от лат. oculus – глаз) состоит их двух плосковыпуклых линз, заключенных в общую металлическую оправу. Верхняя линза – глазная (увеличивающая), нижняя – собирающая. Расстояние между линзами равно полусумме их фокусного расстояния. У окуляров с большим увеличением
|
1 – окуляр 2 – монокулярная насадка (тубус) 3 – револьверное устройство 4 - объектив 5 – предметный столик 6 - конденсор 7 – корпус коллекторной линзы 8 – патрон с лампой 9 - шарнир 10 –рукоятка перемещения кронштейна конденсора 11– рукоятка тонкой фокусировки (микрометрический винт) 12 – рукоятка грубой фокусировки (макрометрический винт) 13 - тубусодержатель 14 – винт для крепления насадки
|
Рис. 1 Схема устройства светового биологического микроскопа
фокус короче, поэтому меньше и длина окуляра. Между линзами имеется диафрагма, ограничивающая поле зрения и задерживающая краевые лучи света. Отечественные микроскопы снабжены тремя сменными окулярами, увеличение которых указано на корпусе окуляра (х7; х10; х15).
Объективы ввинчиваются в гнезда револьверного устройства и состоят из системы линз, заключенных в металлическую оправу. Передняя (фронтальная) линза объектива является самой маленькой и единственной, дающей увеличение. Остальные линзы в объективе только исправляют недостатки полученного изображения (явления сферической и хроматической аберрации) и называются коррекционными.
В гнезда револьверного устройства ввинчиваются четыре объектива, увеличение которых указано на корпусе объектива (х8; х20; х40; х90 или 100). Каждый объектив характеризуется своим фокусным расстоянием (расстоянием между предметным стеклом и фронтальной линзой): объектив х8 имеет фокусное расстояние около 9 мм, объектив х40 – 0,65 мм, объектив х90 – 0,15 мм.
Объективы подразделяются на сухие и иммерсионные.
При работе с сухими объективами (х8, х20, х40) между фронтальной линзой и препаратом находится воздух. В этом случае лучи света проходят среды с различными показателями преломления (покровное стекло, воздух), часть их отклоняется и не попадает в объектив.
При работе с иммерсионными объективами (х90 или х100) для устранения светорассеяния расстояние между фронтальной линзой объектива и препаратом заполняют иммерсионным (кедровым) маслом, показатель преломления лучей света которого близок к показателю преломления лучей света, проходящего через стекло.
Общее увеличение микроскопа определяется как произведение увеличения объектива на увеличение окуляра. Например, если в работе используют окуляр х15, а под тубусом находится объектив х90, то увеличение рассматриваемого с помощью микроскопа объекта составит х1350.
Осветительная часть микроскопа состоит из двухлинзового конденсора, ирис-диафрагмы и патрона с низковольтной лампочкой накаливания, питающейся через понижающий трансформатор от сети напряжения 120…220 В.
Конденсор служит для лучшего освещения препарата. Он собирает световые лучи в пучок и направляет их через отверстие предметного столика на препарат. С помощью рукоятки для перемещения кронштейна конденсора его можно перемещать вверх и вниз, благодаря чему меняется угол сходимости лучей и, следовательно, степень освещения объекта. Чем выше положение конденсора, тем лучше освещен препарат.
Ирис-диафрагма располагается под конденсором и служит для регулировки потока света, поступающего в конденсор. Она состоит из металлических серповидных пластинок. Расширить или сузить отверстие диафрагмы можно с помощью специального рычажка. При вращении его по часовой стрелке отверстие ирис-диафрагмы увеличивается и, следовательно, увеличивается степень освещения объекта.
При работе с иммерсионными объективами степень освещения препарата должна быть максимальной, поэтому шторку ирис-диафрагмы открывают, а конденсор поднимают в крайнее верхнее положение.
При работе с сухими объективами, как правило, рассматривают неокрашенные объекты. Для достижения контрастности конденсор опускают вниз, а отверстие ирис-диафрагмы уменьшают.
Правила работы с микроскопом
На рабочем столе микроскоп ставят тубусодержателем к себе на расстоянии 3…5 см от края стола;
Включают микроскоп в сеть и устанавливают правильное освещение (см. раздел 2.1.1);
На предметный столик помещают исследуемый препарат и закрепляют его клеммами;
Под тубус помещают нужный объектив и с помощью макро и микровинтов устанавливают фокусное расстояние. Так, при работе с иммерсионными объективами на препарат предварительно наносят каплю иммерсионного масла и осторожно опускают тубусодержатель макровинтом до соприкосновения со стеклом. Затем, внимательно смотря в окуляр, очень медленно поднимают тубусодержатель, вращая его против часовой стрелки, до тех пор, пока не увидят изображение. Точную наводку объектива на фокус производят микрометрическим винтом. При работе с сухими объективами препарат вначале рассматривают с объективом х8. Поднимая с помощью макровинта тубусодержатель и внимательно смотря в окуляр, устанавливают фокусное расстояние (около 9 мм) и добиваются четкости изображения, используя микрометрический винт. Далее, двигая предметный столик или предметное стекло, устанавливают в центр поля тот участок препарата, в котором лучше всего виден изучаемый объект. Затем, вращая револьверное устройство вокруг своей оси, под тубус помещают объектив на х20 или х40. При этом под тубус не должен попасть объектив х90. В револьверном устройстве объективы располагаются таким образом, что если найдено изображение с объективом х8, то при рассмотрении препарата с объективами большего увеличения нужно слегка подрегулировать четкость изображения с помощью макро- и микрометрических винтов;
Во время микроскопирования необходимо держать оба глаза открытыми и пользоваться ими попеременно;
После окончания работы следует убрать препарат с предметного столика, опустить вниз конденсор, поставить под тубус объектив х8, удалить мягкой тканью или марлей, смоченной в спирте, иммерсионное масло с фронтальной линзы объектива х90, под объектив положить марлевую салфетку, опустить тубусодержатель.
Техника отбора чистых культур микроорганизмов
Отбор проб чистых культур бактерий и дрожжей, которые вырастают на поверхности плотной среды в виде мазеобразного налета или в жидкой среде ведут в следующей последовательности:
Зажигают спиртовку.
Пробирку с культурой помещают в левую руку между большим и указательным пальцами в наклонном положении. Поверхность с налетом микроорганизмов должна быть обращена вверх и хорошо видна.
Петлю держат вертикально в пламени горелки и прокаливают докрасна, затем наклоняют и обжигают примыкающую к ней часть петледержателя.
Мизинцем и безымянным пальцем правой руки прижимают к ладони наружную часть ватной пробки, вынимают ее из пробирки и держа в таком положении, не касаясь окружающих предметов.
Края открытой пробки обжигают в пламени горелки.
Осторожно вводят стерильную петлю в пробирку с культурой и охлаждают ее о стенки пробирки или прикоснувшись к питательной среде, свободной от микроорганизмов. Немного отстранив пробирку с культурой от пламени горелки, легким движением осторожно отбирают небольшое количество микробной массы с поверхности среды или каплю жидкости с клетками. Вынимая петлю из пробирки, следят за тем, чтобы отобранный материал не касался стенок и петля не оказалась над пламенем горелки.
Снова обжигают в пламени горелки край пробирки, затем, легким круговым движением, обжигают ватно-марлевую пробку и закрывают пробирку.
Пробирку с культурой ставят в штатив, а извлеченный материал используют для приготовления препарата.
Клетки микроорганизмов, оставшиеся не петле, сжигают в пламени горелки.
Отбор чистых культур микроскопических грибов ведут с использованием препаровальной иглы в той же последовательности, что и отбор одноклеточных организмов. Из пробирки отбирают кусочек мицелия, слегка погружая иглу в питательную среду таким образом, чтобы не нарушить структуру мицелия.
Приготовление препаратов фиксированных клеток
Фиксированными считают клетки микроорганизмов, в которых прерваны жизненные процессы, но полностью сохранена тонкая структура.
Для получения фиксированных препаратов важно правильно подготовить предметные стекла. Они должны быть чистыми и тщательно обезжиренными. Для этого стекла, бывшие в употреблении, выдерживают 1-2 часа в хромовой смеси (в 1 л воды вносят 50 г бихромата калия и 100 г технической серной кислоты), после чего ополаскивают теплой водой и спиртом. Можно также кипятить стекла в течение 15 мин. в растворе соды или мыльной воды. Для проверки чистоты стекла на его поверхность наносят каплю воды. При достаточном обезжиривании капля растекается равномерно и не собирается в выпуклые, медленно высыхающие пузырьки. Берут стекла пинцетом или аккуратно за грани, так как пальцы оставляют на поверхности жирные пятна.
Приготовление фиксированных препаратов ведут в следующей последовательности:
На середину чистого обезжиренного предметного стекла стерильной петлей наносят небольшую каплю воды. В нее вносят исследуемый материал, отобранный по методике, описанной в разделе 2.2.1. Полученную суспензию равномерно распределяют по поверхности стекла тонким слоем таким образом, чтобы препарат распределился на площади примерно 2…3 см2.
Полученный мазок высушивают при комнатной температуре на воздухе.
Производят фиксацию мазка. Для этого стекло с высохшим мазком проводят 3-4 раза над пламенем горелки той стороной, где мазок отсутствует. Цель фиксации:
умертвить клетки микроорганизмов и сделать их безопасными (что особенно важно при работе с патогенными микроорганизмами);
зафиксировать (закрепить) мазок на стекле (чтобы они не смывались при окрашивании);
улучшить окрашивание, поскольку мертвые клетки лучше адсорбируют на своей поверхности различные красители.
Приготовление фиксированных препаратов из естественных мест обитания микроорганизмов проводится так же, как и из чистых культур.
Помимо термической обработки, применяют также фиксацию химическими веществами: погружают предметное стекло с мазком в мензурку с 96 %-ным этанолом на 15-20 мин, с ацетоном на 5 мин, со смесью 96 % -ного этанола и 40%-ного формалина (соотношение 95:5) на 2 мин. и др.
Окраска фиксированных препаратов микроорганизмов
простыми методами
Фиксированные препараты нельзя рассмотреть под микроскопом, так как они являются бесцветными и пропускают световые лучи. Поэтому их окрашивают, используя простые или сложные методы.
При окрашивании фиксированных мазков простыми методами используют один краситель (фуксин, краска Муромцева, генцианвиолет, метиленовая синь и др.).
Последовательность окрашивания мазка простыми методами следующая:
На фиксированный препарат наносят несколько капель красителя таким образом, чтобы он покрывал всю поверхность мазка и выдерживают в течение определенного времени. Так, при окраске фуксином на мазок наносят несколько капель красителя и выдерживают его на мазке 2…3 мин. При окрашивании препарата из кефира на него краску Муромцева наносят на мазок через полоску фильтровальной бумаги на 3…5 мин.
Краску смывают с мазка слабой струей до бесцветной смывной воды. При этом стекло держат в наклонном положении над лотком.
Мазок подсушивают фильтровальной бумагой, которую осторожно прикладывают к стеклу, и досушивают на воздухе.
На окрашенный мазок наносят каплю иммерсионного масла и рассматривают препарат с объективом х90 или х100.
ПОРЯДОК ВЫПОЛНЕНИЯ РАБОТЫ
На 1 объем жидких дрожжей взять 3-5 объемов воды. Смесь энергично взболтать и оставить на 1 мин.
Из верхнего слоя дрожжевой жидкости стеклянной палочкой перенести небольшую каплю на предметное стекло, добавить 1 каплю раствора Люголя. Накрыть покровным стеклом и слегка прижать его сухим концом стеклянной палочки для удаления пузырьков воздуха. Препараты рассмотреть под микроскопом при увеличении в 500—1000 раз (объективы Х40 и Х90).
4.Написать отчет о проделанной работе.
Микроскопирование препаратов дрожжей позволяет следить за их состоянием и размножением. Молодые и зрелые дрожжи крупнее состарившихся. Оболочка у них едва заметна, вакуоли отсутствуют или очень малы. Они имеют большое количество почкующихся клеток. О старении культуры дрожжей можно судить по следующим признакам: их оболочка имеет вид утолщенного ободка, строение цитоплазмы зернистое, присутствуют капельки жира.
Оформление и анализ результатов исследований
В отчете студенты должны кратко законспектировать теоретических материал. Наблюдаемые под микроскопом картины нужно зарисовать. Под рисунками необходимо указать увеличение и подписать название изучаемого объекта.
Контрольные вопросы
Каково устройство биологического микроскопа?
Из каких частей и механизмов состоит механическая часть микроскопа?
Назовите основные характеристики микроскопа.
Что понимают под разрешающей способностью микроскопа? Как она определяется?
Что составляет оптическую систему микроскопа?
Объективы бывают сухие и иммерсионные. Что это значит?
Как определяется общее увеличение микроскопа?
Что входит в состав осветительной системы микроскопа?
Как следует настроить осветительную систему при работе с иммерсионным объективом?
Какие существуют правила работы с микроскопом?
Какие особенности устройства и принципы работы темнопольного, фазово-контрастного, люминесцентного и электронного микроскопов?
Чем определяется четкость получаемого изображения?
Перечислить основные правила работы с микроскопом.
Как проводится отбор проб чистой культуры микроорганизма?
Перечислите основные этапы приготовления фиксированного окрашенного препарата.
Лабораторная работа 2
МЕТОДЫ АНАЛИЗА МИКРОФЛОРЫ ОКРУЖАЮЩЕЙ СРЕДЫ
Определение числа клеток микроорганизмов высевом
на питательные среды
В отличие от подсчета микроорганизмов под микроскопом этот метод дает возможность определить только число жизнеспособных клеток в популяции. Поскольку сред, пригодных для роста всех микроорганизмов, не существует, метод высева дает возможность определить число микроорганизмов, способных расти на среде данного состава, но не позволяет учесть те микроорганизмы, которые не растут или растут крайне медленно. Это важно помнить при анализе таких естественных субстратов, как почва, вода и т.п.
О пределение
количества клеток высевом на плотные
питательные среды (чашечный метод Коха).
Метод широко применяют
для определения численности жизнеспособных
клеток в различных
естественных
субстратах и в лабораторных культурах.
В
его основе лежит принцип Коха, согласно
которому каждая колония
является потомством одной клетки. Это
позволяет на основании
числа
колоний, выросших после посева на плотную
питательную
среду
определенного объема исследуемой
суспензии, судить
об исходном содержании в ней клеток
микроорганизмов.
Результаты
количественного учета микроорганизмов,
проведенного
методом Коха, часто выражают не в числе
клеток, а в условных
единицах - так называемых колониеобразующих
единицах (КОЕ).
Определение
числа микроорганизмов этим методом
включает три этапа:
приготовление разведений, посев на
плотную среду в чашки
Петри и подсчет выросших колоний.
пределение
количества клеток высевом на плотные
питательные среды (чашечный метод Коха).
Метод широко применяют
для определения численности жизнеспособных
клеток в различных
естественных
субстратах и в лабораторных культурах.
В
его основе лежит принцип Коха, согласно
которому каждая колония
является потомством одной клетки. Это
позволяет на основании
числа
колоний, выросших после посева на плотную
питательную
среду
определенного объема исследуемой
суспензии, судить
об исходном содержании в ней клеток
микроорганизмов.
Результаты
количественного учета микроорганизмов,
проведенного
методом Коха, часто выражают не в числе
клеток, а в условных
единицах - так называемых колониеобразующих
единицах (КОЕ).
Определение
числа микроорганизмов этим методом
включает три этапа:
приготовление разведений, посев на
плотную среду в чашки
Петри и подсчет выросших колоний.
Приготовление разведений. Численность популяции микроорганизмов обычно велика, поэтому для получения изолированных колоний необходимо приготовить ряд последовательных разведений. Разведения готовят в стерильной водопроводной воде или 0,85%-ном растворе NaCl (физрастворе). В ходе опыта целесообразно использовать один и тот же коэффициент разведения, например 10, что уменьшает вероятность ошибки.
Для приготовления разведений стерильную водопроводную воду разливают по 9 мл в стерильные сухие пробирки. Затем 1мл исследуемой суспензии стерильной пипеткой переносят в пробирку с 9 мл стерильной воды - это 1-е разведение, 10-1.
Полученное разведение тщательно перемешивают новой стерильной пипеткой, вбирая в пипетку и выпуская из нее полученную взвесь. Эту процедуру выполняют 3-5 раз, затем той же пипеткой отбирают 1 мл полученной суспензии и переносят во 2-ю пробирку, получают 2-е разведение (10-2). Таким же образом готовят и последующие разведения. Степень разведения зависит от плотности исследуемой популяции микроорганизмов; соответственно она тем больше, чем больше плотность популяции. Для приготовления каждого разведения следует обязательно использовать новую пипетку. Пренебрежение этим правилом приводит к получению ошибочного результата.
Посев. Высевать суспензию можно поверхностным или глубинным способом. Перед посевом поверхностным способом (рис. 4) разливают расплавленную, чаще всего агаризованную, питательную среду в ряд стерильных чашек Петри по 15-20 мл в каждую. Чашки оставляют на горизонтальной поверхности, пока среда не застынет. Поверхность агаризованных сред перед посевом рекомендуется подсушивать для удаления конденсационной воды. Среду можно подсушить, поместив чашки в термостат на 2-3 суток крышками вниз.
После того как среда готова, на ее поверхность стерильной пипеткой наносят точно измеренный объем (0,05 или 0,1 мл) соответствующего разведения и распределяют его стерильным стеклянным шпателем по поверхности среды. Высевы на плотную среду проводят, как правило, из трех последних разведений, причем из каждого делают 2-4 параллельных высева. Посевы можно делать одной пипеткой, но при этом начинать следует обязательно с большего разведения. Для каждого разведения используют новый стерильный шпатель. После посева чашки Петри помещают в термостат крышками вниз.
При глубинном посеве точно измеренный объем (как правило 0,1; 0,5 или 1,0 мл) исходной суспензии или разведения вносят в расплавленную и остуженную до (48-50)°С агаризованную среду, тщательно перемешивают и затем немедленно выливают в чашку Петри. Среде дают застыть. В случае глубинного посева пользуются средой, разлитой в пробирки. При больших масштабах работы среду по пробиркам не разливают, а поступают следующих образом.
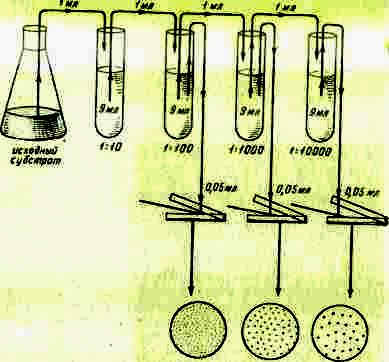
Рис 4. Схема приготовления разведений и рассева суспензии
микроорганизмов шпателем
По 1 мл из соответствующего разведения переносят стерильной пипеткой в 2-4 стерильные чашки Петри. Затем заливают чашки 15-20 мл расплавленной и остуженной до (48-50)°С плотной средой и тщательно смешивают питательную среду с посевным материалом легким вращательным движением чашки по поверхности стола, после чего чашки оставляют на горизонтальной поверхности до застывания. Когда среда застынет, чашки Петри в перевернутом виде помещают в термостат.
Для определения количества клеток анаэробных микроорганизмов чашки Петри с плотной средой после посева помещают в анаэростаты. Иногда для определения численности анаэробов плотную среду после засева оставляют в пробирках. Поверхность застывшей среды заливают парафином. Для лучшего рассмотрения колонии микроорганизмов диагностические среды рекомендуется осветлять.
Подсчет выросших колоний. Колонии микроорганизмов в зависимости от скорости роста подсчитывают через 2-15 суток инкубации. Подсчет, как правило, проводят, не открывая чашек Петри. Для удобства каждую посчитанную колонию отмечают точкой на наружной стороне дна чашки. При большом количестве колоний дно чашки Петри делят на секторы, просчитывают колонии в каждом секторе и суммируют результаты. Иногда для подсчета колоний используют специальные полуавтоматические счетчики.
Лучшим разведением следует считать, когда при высеве в чашке Петри вырастает от 30-50 до 100-150 колоний. Если число выросших колоний оказалось меньше 10, то эти результаты для расчета количества клеток в исходном материале не используют. Результаты параллельных высевов из одного и того же разведения суммируют и определяют среднее число колоний, выросшее при высеве из разведения на одной чашке. Количество клеток в 1 мл исследуемого субстрата вычисляют по формуле:
![]() ,
(1)
,
(1)
где М - количество клеток в 1 мл; а - среднее число колоний при высеве разведения, из которого сделан высев; V — объем суспензии, взятый для посева, в мл; 10n — коэффициент разведений.
Определение количества клеток высевом в жидкие среды (метод предельных разведений). Метод используют для подсчета микроорганизмов, которые плохо или совсем не растут на плотных питательных средах. В пробирки с жидкой средой вносят строго измеренный объем из различных разведений исследуемого субстрата. После инкубации, исходя из числа пробирок, в которых наблюдался или отсутствовал рост, рассчитывают наиболее вероятное число клеток, содержащихся в 1 мл исследуемого субстрата.
Таким образом, определение количества микроорганизмов методом предельных разведений включает приготовление разведений, посев в жидкую среду, регистрацию наличия или отсутствия роста после инкубации и расчет наиболее вероятного числа клеток в единице объема исходного субстрата. Разведения исходной суспензии готовят, как и для чашечного метода.
Посев и регистрация результатов. Стерильную среду предварительно разливают в пробирки (колбы) и стерилизуют. В пробирки (колбы) следует наливать одинаковый объем среды. Посев проводят из каждого разведения или из 4-5 последних, причем каждое разведение высевают в 3-5 повторностях (параллельных пробирках). Количество посевного материала везде одинаково и, как правило, составляет 1 мл. Засеянные пробирки помещают в термостат. Время инкубации колеблется от 2 до 15 суток и зависит от скорости роста микроорганизмов, численность которых определяют.
3.1 Качественно-количественный учет микрофлоры почвы
Цель работы. Освоить метод посева проб почвы на питательные среды, метод определения количества микроорганизмов в почве и выделения чистых культур бактерий из проб почвы.
Материалы и оборудование. Весы, ступка, резиновые перчатки,
колба со стерильной дистиллированной водой, пипетки на 10 мл и 1 мл, стерильные пробирки, колба вместимостью 250 мл, чашки Петри с МПА.
Ход выполнения работы
1. Приготовьте суспензию почвы. Для этого отвесьте 10 г почвы и перенесите навеску в стерильную ступку, добавьте 2 - 3 мл стерильной воды и разотрите до пастообразного состояния.
2. Полученную пробу почвы (10 г) перенесите в стерильную колбу,
содержащую 90 мл стерильной воды, размешайте в течение 5 мин и дайте отстояться 30 мин. Это первое разведение исследуемой пробы почвы.
3. Приготовьте ряд последующих 10-кратных разведений этой пробы в пробирках в зависимости от предполагаемой численности микроорганизмов в пробе. Для приготовления каждого последующего разведения используйте новую пипетку.
4. Полученные разведения в объеме 0,1 мл посейте (на каждое разведение по 2 - 3 чашки):
на МПА для определения общего числа бактерий;
5. Равномерно распределите каплю инокулята на поверхности агара,
покачивая чашку, и оставьте на 30 мин для адсорбции при комнатной температуре.
6. Засеянные чашки Петри через 30 минут переверните вверх дном и
поместите в термостат при температуре 28 - 37 °С для выращивания мезофильной микрофлоры. Количество бактерий на МПА учитывайте через 1 - 5 сут.
7. Учитывайте количество колоний следующим образом: дно чашки
Петри маркером разделите на равные секторы, учтенные колонии отмечайте точками на стекле. Подсчитайте среднее число колоний на чашке.
Результаты работы внесите в табл. 1.
Таблица 1
Качественно-количественный учет микрофлоры почвы
Номер пробы |
Общее число бактерий |
1 |
|
2 |
|
3.2 Количественный учет бактерий в пробах воды.
Определение титра и индекса кишечной палочки.
Цель работы. Освоить методы отбора проб воды, их посева и определения бактериальной загрязненности воды.
Материалы и оборудование. Микроскоп, предметные стекла, бак-
териологические петли, спиртовка, стерильные чашки Петри с МПА и сре-
дой Эндо, исследуемые пробы воды, столик для окрашивания препаратов,
промывалка с водой, красители для окраски по Грамму; термостат с температурой 37 °С.
Ход выполнения работы:
Микробиологическое исследование воды
Отбор проб
1. Кран или край спускной трубы обжигают зажженным ватным тампоном, пропитанным спиртом. Открывают кран и в течение 10-15 минут воду спускают, после чего производят отбор пробы в стерильную колбу (объем пробы не менее 500 см3). Колбу закрывают ватно-марлевой пробкой над огнем.
2. Отберите пробы воды в стерильные флаконы: а) пробу водопроводной воды; б) пробу из отрытого водоема (ручей, ключ, пруд). До начала занятия (посева) пробы можно хранить не более 3 ч при температуре не выше 4 °С.
2. Приготовьте ряд последующих 10-кратных разведений отобранных проб в пробирках, в зависимости от предполагаемой численности микроорганизмов в пробе. Для приготовления каждого последующего разведения используйте новую пипетку.
3. Полученные разведения в объеме 0,1 мл посейте (на каждое разведение по 2 - 3 чашки):
а) на МПА для определения общего числа бактерий;
б) на среду Эндо для учета БГКП (бактерии группы кишечной палочки или энтеробактерии).
4. В чашки Петри с МПА и средой Эндо внесите по 0,1 мл последнего и предпоследнего разведений, равномерно распределите каплю инокулята на поверхности агара, покачивая чашку, и оставьте на 30 мин для адсорбции при комнатной температуре.
5. Засеянные чашки Петри через 30 мин переверните вверх дном и поместите в термостат при температуре 28 - 37 °С для выращивания мезофильной микрофлоры. Количество бактерий учитывайте через 1-2 сут.
8. Учитывайте количество колоний следующим образом: дно чашки
Петри маркером разделите на равные секторы, учтенные колонии отмечай
те точками на стекле. Для определения титра подсчитайте среднее число
колоний на чашке и умножьте на разведение.
9. Для подтверждения принадлежности к БГКП из колоний, выросших на среде Эндо, приготовьте фиксированные мазки, окрасьте их по Граму, промикроскопируйте. Грамотрицательные бактерии протестируйте по биохимическим свойствам с системой индикаторной бумажной (СИБ) для идентификации энтеробактерий.
10. Подсчитайте количество колоний кишечной палочки на 1 мл воды
по формуле (1).
11. Результаты запишите в табл. 11.
Таблица 11
Количественный учет бактерий в пробах воды
Номер пробы |
Общее число бактерий в 1 мл воды |
Коли-титр
|
|
|
|
|
|
|