
- •Государственное образовательное учреждение высшего профессионального образования «южный федеральный университет» Геолого-географический факультет
- •Курс лекций по кристаллографии
- •Ростов-на-Дону
- •Кристаллическое и аморфное состояния вещества.
- •Симметрия кристаллов
- •Формы огранки кристаллов
- •Структурные особенности кристаллов
- •Химический состав кристаллов минералов
- •Глоссарий
- •Заключение
Структурные особенности кристаллов
Цель модуля: Показать особенности внутреннего строения кристаллов с позиций кристаллохимии, дать понятие об элементарной ячейке как базовой составляющей кристаллической решетки и ее роли в идентификации кристаллического вещества, познакомить с явлениями фазовых переходов в кристаллических структурах, как реакции на изменение параметров среды, отметив роль явлений полиморфизма и политипии в систематике минералов.
В предыдущих разделах курса мы неоднократно подчеркивали наличие связи между упорядоченным строением кристаллического вещества и его физическими свойствами. Практически все физические свойства кристаллов, их параметры и особенности проявления, в частности анизотропия, определяются кристаллической структурой, объемной моделью которой служит кристаллическая решетка данного кристалла. Раздел кристаллографии, изучающий связь между атомным строением (структурой) кристаллов и их химическими, физическими и геометрическими свойствами называется кристаллохимия. Далее речь пойдет об особенностях и общих принципах строения кристаллической решетки.
Итак, в основе внутреннего строения любого кристаллического вещества лежит трехмерная пространственная кристаллическая решетка, сложенная закономерно расположенными материальными частицами – атомами, ионами или молекулами, связанными в единую структуру соответствующими типами химических связей.
Гипотетически эти структурообразующие частицы имеют форму плотно уложенных шаров, характеризующихся определенными размерами радиусов, измеряемых в нанаметрах или ангстремах (1 Å = 0,001 мм). Отсюда эффективный атомный (ионный) радиус равен минимальному расстоянию, на которое центр сферы данного атома (иона) может приблизиться к поверхности сфер соседних атомов (ионов), слагающих кристаллическую решетку. В трехмерном пространстве каждый атом или ион кристаллической структуры окружен другими атомами или ионами, количество которых, находящихся в ближайшем окружении данного атома (иона), составляет его координационное число. Другими словами, координационное число – число атомов (ионов), находящихся в ближайшем окружении данного атома (иона). Максимально-возможное число таких атомов (ионов) соседей определяется соотношением их радиусов. В реальных кристаллических структурах минералов координационные числа варьируют от 2 до 12.
Атомы (ионы) входящие в координацию своим расположением образуют пространственную фигуру, называемую координационным многогранником. Фигура эта может быть плоской (например, треугольник), может быть объемной (например, куб или октаэдр).
Координационное число и координационный многогранник для одного и того же химического элемента может меняться в зависимости от его валентности и положения в кристаллической структуре.
Итак, с точки зрения кристаллохимии, пространственная кристаллическая структура может быть представлена в виде плотно уложенных шаров – атомов (ионов) определенного размера (атомного – ионного радиуса). Теоретически такая плотнейшая упаковка шаров может быть осуществлена двумя способами (рис. 7 ), носящими соответствующие названия кубическая или гексагональная. Если укладывать шары слой за слоем друг на друга, то слои, в зависимости от способа укладки, будут повторяться либо через три, либо через два. В первом случае получится структура последовательного наложения слой А + слой В + слой С- далее последует повторение слоя А. Это так называемая кубическая упаковка.
При гексагональной упаковке слой А перекрывается слоем В, затем снова следует слой А и т.д. В реальных кристаллических структурах такие идеальные плотнейшие упаковки встречаются редко.
Обычно ионные радиусы анионов значительно превышают размеры катионов, и потому плотность упаковки определяется именно анионами, а более мелкие катионы занимают пустоты между шарами-анионами. Отсюда важность гармонии в размерах ионных радиусов анионов и катионов. В идеале размеры катиона должны точно соответствовать занимаемому ими пространству между шарами-анионами. Отклонение в ту или иную сторону делает структуру неустойчивой и приводит к перестройке с изменением координационного числа для слишком крупных катионов, либо к искусственному увеличению ионного радиуса маленького катиона путем создания вокруг него рубашки из диполей молекул воды с образованием особых соединений – кристаллогидратов.
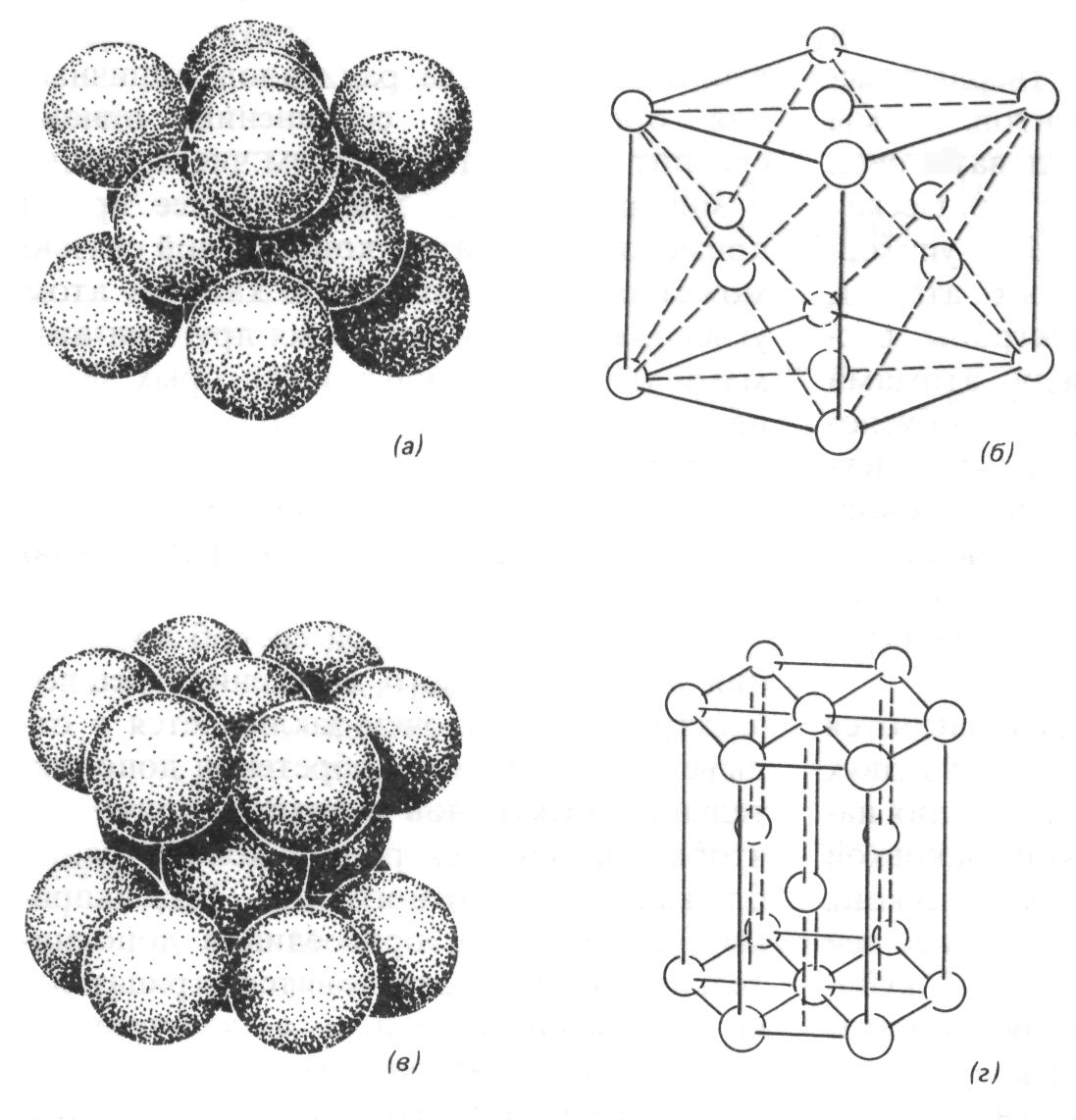
Рис. 7. Плотнейшие упаковки атомов, а – кубическая упаковка, в которой атомы показаны в том же масштабе, что и ребра кубической ячейки; б – та же решетка с выделенной сплошными линиями ячейкой; в – гексагональная упаковка, в которой диаметры атомов даны в том же масштабе, что и параметры ячейки; г – та же решетка с выделенной сплошными линиями ячейкой.
Согласно данному ранее определению, кристаллическая решетка – бесконечное трехмерное периодическое образование, представляющее собой модель закономерного распределения в пространстве материальных частиц (атомов, ионов, молекул), слагающих кристалл. Элементами строения кристаллической решетки являются узлы (отдельные закономерно повторяющиеся в пространстве точки, собственно образующие решетку), ряды (совокупность узлов, лежащих на одной прямой) и плоские сетки (плоскости, проходящие через любые три узла, не лежащие на одной прямой).
В любой кристаллической решетке имеется бесчисленное количество узлов, рядов и плоских сеток, поэтому для идентификации определенного кристаллического вещества необходимо мимитизировать число параметров, характеризующих его кристаллическую структуру.
Наиболее простым элементом кристаллической решетки является ряд, в пределах которого узлы повторяются через определенные промежутки расстояний. Таким образом, имея один узел (как отправную точку) и зная расстояние между узлами в ряду, можно путем перемещения (трансляции) узла вывести весь ряд. Отсюда, кратчайшее из возможных расстояний между одинаковыми точками (узлами) в ряду кристаллической решетки называется элементарной трансляцией или периодом идентичности.
Две элементарные трансляции, не лежащие на одной прямой, определяют ячейку плоской сетки, т. е. характеризуют кристаллическую структуру в одной плоскости.
Три элементарные трансляции, не лежащие в одной плоскости, определяют элементарный параллелепипед пространственной кристаллической решетки, т. е. характеризуют минимальную ее часть во всех трех измерениях. Следовательно, элементарный параллелепипед, транслируемый в трех измерениях, определяет всю пространственную кристаллическую решетку. В литературе встречаются равноценные понятия элементарный параллелепипед = параллелепипед повторяемости = элементарная ячейка кристаллической решетки.
Для характеристики любой кристаллической решетки достаточно установить параметры ее элементарной ячейки. Для характеристики любого параллелепипеда повторяемости (элементарной ячейки) достаточно знать размеры его ребер (т. е. величины элементарных трансляций в трех измерениях - a, b, c и углы между ребрами α, β, γ ). Симметрия элементарного параллелепипеда должна соответствовать симметрии всей кристаллической структуры, поэтому элементарные ячейки кристаллов различных сингоний будут отличаться своей формой и числовыми характеристиками параметров.
Наиболее сложной формой обладает элементарная ячейка триклинной сингонии. Здесь у элементарного параллелепипеда все ребра имеют различные размеры ( a ≠ b ≠ c ) и все углы между ребрами не равны между собой и не прямые ( α ≠ β ≠ γ ≠ 90о).
В элементарных параллелепипедах моноклинной сингонии также все ребра различны (a ≠ b ≠ c), но два угла из трех прямые (α ≠β = γ =90о).
В элементарной ячейке кристаллов ромбической сингонии все ребра параллелепипеда повторяемости разной величины (a≠ b ≠ c), но все углы прямые (α = β = γ =90о).
В кристаллах средней категории симметрии, при наличии одной оси симметрии высокого порядка, например в тетрагональной, два ребра элементарного параллелепипеда равны, а третье отлично от них, т. е. (a = b ≠ c) при всех прямых углах (α = β = γ = 90о).
В кристаллах кубической сингонии элементарная ячейка имеет форму куба и следовательно здесь все ребра равны (a = b = c) и все углы прямые (α = β = γ = 90о).
Кроме общих параметров элементарной ячейки необходимо учитывать положение узлов в пределах самой ячейки. По этому признаку выделяются следующие типы элементарных ячеек: примитивная, базоцентрированная, объемноцентрированная и гранецентрированная. Еще в XIX веке французским ученым О. Бравэ были исследованы возможные варианты построения кристаллических решеток в соответствии с законами их симметрии. Математически было доказано, что существует только 14 типов элементарных ячеек (решеток Бравэ) из которых можно собрать любую пространственную структуру.
Тип и параметры элементарной ячейки строго индивидуальны и являются своего рода паспортом, позволяющим идентифицировать любое кристаллическое вещество. Определение их производится с помощью рентгеноструктурного анализа.
Итак, повторим еще раз: вещество, находящееся в кристаллическом состоянии характеризуется высокой упорядоченностью распределения в пространстве слагающих его материальных частиц, образующих трехмерную конструкцию – кристаллическую решетку, причем, как было показано, параметры элементарных ячеек такой решетки строго индивидуальны для каждого химического соединения (в геологии - минерала).
В то же время, кристаллическая структура твердого тела (минерала) определяется не только природой самого вещества, но находится в тесной зависимости от физико-химических условий окружающей среды. Это значит, что вещество одного и того же химического состава способно строить свою кристаллическую решетку в зависимости от вариаций параметров среды кристаллизации (ТРХ) и менять ее при изменении этих параметров, приспосабливаясь к изменившимся условиям существования. В большинстве случаев при глубоком изменении структуры меняется сингония, а с ней и габитус кристаллов, отсюда и название явления – полиморфизм многоформность. Кристаллические вещества одного состава, но различной структуры носят наименование полиморфных модификаций. В минералогии они считаются самостоятельными минералами. Классическим примером полиморфизма могут служить полиморфные модификации углерода – алмаз и графит, хотя само явление полиморфизма распространено достаточно широко и примеров можно привести множество из всех классов минералов. Кальцит и арагонит, пирит и марказит, сфалерит и вюрцит, киноварь и метацинобарит, ортоклаз и микроклин, α- и β- кварцы и т.д.
Полиморфные модификации могут отличаться координационными числами отдельных, входящих в их состав компонентов. Например, силикат Al2SiO5 существует в трех полиморфных модификациях (дистен, андалузит, силлиманит), отличающихся координационными числами Al.
Полиморфные модификации могут отличаться поворотом отдельных фрагментов их структурных элементов (например, α и β кварцы, в структурах которых кремнекислородные тетраэдры SiO4, имеют различную ориентировку).

Рис. 8 Общепринятый выбор элементарных ячеек в 14 решетках Браве
Структуры полиморфных модификаций могут отличаться степенью упорядоченности самих структур (например, калиевые полевые шпаты – санидин, ортоклаз, микроклин).
Полиморфный переход от одной модификации к другой может осуществляться скачком, при этом одновременное существование обоих модификаций невозможно. Например, переход низкотемпературной модификации α – кварца в высокотемпературную β – кварц происходит мгновенно при нагревании до температуры 573оС. При охлаждении и обратном переходе этого температурного рубежа происходит обратное превращение высокотемпературного гексагонального β – кварца в низкотемпературный тригональный α – кварц. Обе полиморфные модификации совместно не существуют.
В то же время полиморфные модификации СаСО3 кальцит и арагонит или FeS2 – пирит и марказит, структурные перестройки которых зависят не только от температуры, но и от химизма среды, могут совместно существовать в течение длительного времени.
Полиморфные модификации всегда отличаются друг от друга в структурном отношении. Разница в энергиях кристаллических решеток двух веществ одинакового состава зависит от того, насколько велики различия в их структурах. Если эта разница невелика, как например у α – β кварцев, то переход осуществляется легко и быстро. Если же полиморфные модификации резко отличаются в структурном отношении друг от друга (например, алмаз и графит), то для осуществления фазового перехода требуются существенные энергетические затраты.
Если при изменениях параметров среды фазовые переходы происходят в прямом и обратном направлениях, как, например, с кварцем, то такие полиморфные превращения называют энантиотропными. Если же переход совершается в одну сторону, а обратное превращение требует значительных энергетических или иных затрат, то такой полиморфизм называют монотропным. Примерами монотропного полиморфизма могут служить переход марказита в пирит или арагонита в кальцит.
Полиморфные превращения характерны и для самородных элементов, здесь они носят название аллотропии и обозначаются буквами греческого алфавита (например, полиморфные модификации самородной серы).
При изменениях физико-химических параметров окружающей среды, достигающих критических величин, кристалл, приспосабливаясь к новым условиям, изменяет свою внутреннюю кристаллическую структуру, т.е. происходит его полиморфное превращение, но при этом сохраняет огранку прежней полиморфной модификации. Таким образом, возникает несоответствие структуры кристалла и его габитуса, т.е. образуется псевдоморфоза. Псевдоморфозы, образовавшиеся за счет полиморфных перестроек называют параморфозами (например, параморфоза пирита по марказиту или низкотемпературного α – кварца по высокотемпературному β – кварцу).
Иногда полиморфные разновидности отличаются по кристаллическим структурам не столь радикально. В элементарных ячейках их кристаллических решеток два параметра остаются неизменными и лишь третий параметр может меняться. Особенно это характерно для слоистых структур (графит, слюды, глинистые минералы). Такое явление носит название политипии, а сами модификации называют политипами.
Каждая кристаллическая структура имеет определенное поле устойчивости, т. е. сочетание параметров среды (ТРХ), при которых возможна кристаллизация с образованием определенной полиморфной модификации. Выход за пределы поля устойчивости (изменение температуры, давления, химизма среды) может сопровождаться различными реакциями кристаллической структуры на эти изменения.
Во-первых, структура может разрушиться и кристалл перестанет существовать (например, лед, внесенный в комнату, просто растает, поскольку температурная граница поля устойчивости его кристаллической решетки лежит ниже 0оС или кристалл поваренной соли, обладающий высокой растворимостью, перестанет существовать, если его бросить в воду).
Во-вторых, структура может приспособиться к новым условиям путем смены одной полиморфной модификации на другую (α – β превращения в кварце при переходе температурного рубежа 573 0оС ).
Наконец, кристаллическая решетка может сохраниться без изменения, несмотря на изменившиеся параметры среды. Такое состояние вещества называют метастабильным
(неустойчивым). Метастабильное состояние может сохраняться различное, иногда долгое даже по геологическим понятиям время. Например, алмаз может сохраняться в своей полиморфной модификации бесконечно долго, хотя при нормальных условиях он явно находится за пределами поля устойчивости. В метастабильном состоянии находятся и многие другие магматогенные и гидротермальные минералы при нормальной температуре земной поверхности.
В других случаях метастабильное состояние сохраняется ограниченное время, а затем происходит переход в более устойчивую полиморфную модификацию. Например, из двух полиморфных модификаций СаСО3 кальцит – арагонит, в нормальных условиях стабильным является кальцит, а арагонит находится в метастабильном состоянии и постепенно переходит в кальцит.
Полиморфные модификации минералов, сохраняющиеся в метастабильном состоянии, или их параморфозы могут быть использованы при генетических реконструкциях в качестве важных типоморфных критериев.
Проектное задание: Объясните, почему соотношение ионных радиусов катионов и анионов определяют устойчивость кристаллической структуры. Почему на земной поверхности в качестве полиморфной модификации устойчив гипс Ca[SO4]∙2H2O, а на глубине - ангидрит Ca[SO4] не содержащий воду.
Контрольные вопросы для самопроверки усвоения материала.
Какими проблемами занимается кристаллохимия?
Что такое ионный (атомный) радиус? В каких единицах он измеряется?
Что такое координационное число?
Что такое элементарная ячейка (параллелепипед повторяемости)?
В чем состоит индивидуальность элементарной ячейки каждого кристаллического вещества?
Что входит в состав понятия «параметры элементарной ячейки»?
Какие Вы знаете типы элементарных ячеек?
Почему среди возможных типов элементарных ячеек кристаллов кубической сингонии нет базоцентрированной?
Что такое полиморфизм как явление?
Каковы причины возникновения полиморфных модификаций?
Чем могут отличаться полиморфные модификации одного вещества?
Почему полиморфные превращения могут привести к возникновению псевдоморфоз? Как такие псевдоморфозы называются?
Что такое метастабильное состояние вещества?
Что такое аллотропия?
Что такое политипия? Для кристаллов с какими структурами характерны политипы?
Рекомендуемая литература.
Попов Г.М., Шафрановский И.И. Кристаллография. – М.: Высшая школа, 1972.
Стр. 224, 275 – 278, 281, 286, 299, 307 – 310
Шаскольская М.П. Кристаллография. – М.: Высшая школа, 1984.
Стр. 134 – 137, 168 – 176, 353 – 356
Буллах А.Г. Минералогия с основами кристаллографии. –М.: Недра, 1989.
Стр. 20 – 35, 75 - 76
Лекция (модуль) 5 2 часа
