
Методика эксперимента
В работе используется гравиметрический способ исследования, заключающийся в определении массы образца во времени в ходе опыта. Исследуемый образец (1) листовой стали 08ю содержит 0,05-0,08 %C, 0,2 %Mn, 0,05 %Alи не более 0,03% серы и фосфора, т.е. около 99,6 % железа. Взвешивание образца, находящегося в печи, осуществляется с помощью торсионных весов (4) с точностью до 1 мг. Схема установки приведена на рисунке 2. Температура в печи (3) измеряется хромель-алюмелевой термопарой в комплекте с милливольтметром (2) и определяется по градуировочному графику. В ходе опыта она должна быть постоянной в рабочем интервале 850-9000С.
В работе измеряется привес образца mот начала опыта, т.е. масса кислорода, прореагировавшего с железным образцом. Если считать, что окалина представлена вюститом, толщина ееyв любой момент определится из уравнения:
![]()
(7)
В уравнении (7):
72 и 16 – относительные молекулярные массы FeOи кислорода;
S– площадь реакционной поверхности;
- плотность пленки окалины.
Результаты работы и их обсуждение
В таблице представлены результаты исследования макрокинетики окисления стали 08ю на воздухе при температуре 850 0С. Площадь образца 5,5 см2.
Таблица. Макрокинетика окисления стали
|
Время ,мин.
|
Масса образца m, мг |
Привес образца m, мг |
Квадрат привеса образца m2, мг2 |
Изменение за один замер |
Скорость окисления dm/d, мг/мин | |
|
d, мин |
dm, мг | |||||
|
0 |
300 |
0 |
0 |
0 |
0 |
|
|
0,5 |
315 |
15 |
225 |
0,5 |
15 |
30 |
|
1,0 |
329 |
29 |
891 |
0,5 |
14 |
28 |
|
1,5 |
344 |
44 |
1936 |
0,5 |
15 |
30 |
|
2,0 |
355 |
55 |
3025 |
0,5 |
11 |
22 |
|
4,0 |
380 |
80 |
6400 |
2,0 |
25 |
12,5 |
|
6,0 |
403 |
103 |
9801 |
2,0 |
23 |
11,5 |
|
8,0 |
420 |
120 |
14400 |
2,0 |
17 |
8,5 |
|
10 |
434 |
134 |
18760 |
2,0 |
14 |
7 |
|
12 |
444 |
144 |
20736 |
2,0 |
10 |
5 |
|
15 |
451 |
151 |
22800 |
3,0 |
7 |
2,3 |
|
20 |
465 |
165 |
27225 |
5,0 |
14 |
2,8 |
На рисунке 3 представлено изменение во времени массы образца, т.е. количество кислорода, вступившего в реакцию к моменту времени от начала опыта. На рисунке видно, что начальный участок кривой удовлетворительно описывается прямой линиейm= А1.

Рисунок 3. Изменение массы образца во времени
Линейный характер кривой на начальном участке вызван протеканием реакции в кинетическом режиме. Уравнение прямой, исходящей из начала координат и проходящей через точку с координатами Х=1,5 мин,Y= 44 мг, имеет вид:
m= 44/1,5= 29.A1= 29 мг/мин.
Константа скорости кристаллохимических превращений, лимитирующих процесс окисления, определится из соотношений:
Кхим=4,5A1/(SPо2)= 4,52910-6/(51035,510-40,2)=
=23,610-5м/мин = 3,910-6м/c.
Р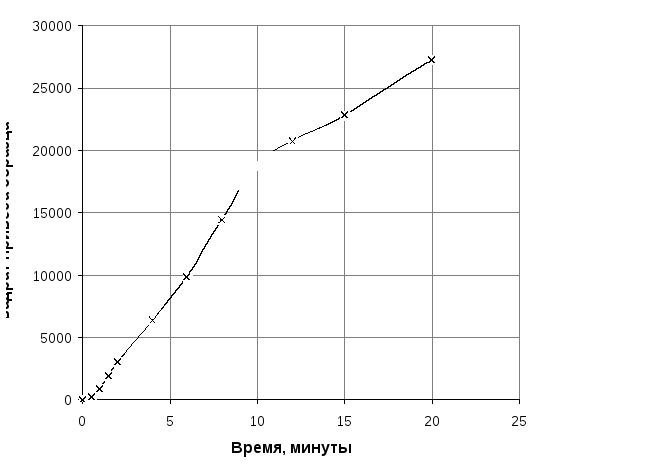 исунок
4. Изменение квадрата привеса образца
(мг2)
исунок
4. Изменение квадрата привеса образца
(мг2)
На рисунке 4 представлены результаты опыта в координатах m2-, и видно, что полученная зависимость относительно сложная. Участок кривой во временном интервале 8 – 20 минут близок к линейному, что соответствует закону квадратичной параболы, характерному для диффузионного режима реагирования. Определим угловой коэффициент А2прямой, проходящей через точки с координатами:X1=8 мин,Y1=18750мг2;X2=20 мин,Y2=27200 мг2.
А2= (27200-18750)/(20-8) = 704 мг2/мин.
Эффективный коэффициент диффузии кислорода в окалине определится из уравнения:
D= 10,1 А2/(2S2Po2)==10,170410-12/(521065,5210-40,2)= =3,610-12м2/мин = 610-14м2/c.
Р исунок
5. Скорость окисленияdm/dобразца при 8500С
исунок
5. Скорость окисленияdm/dобразца при 8500С
Скорость окисления стали (рисунок 5) в ходе опыта уменьшается, что вызвано нарастанием пленки продуктов реакции и протеканием процесса в переходном и диффузионном режимах.
Выводы
Изучена макрокинетика окисления листовой стали 08ю на воздухе при 850 0С.
Показано, что в первые 2 минуты окисление протекает в кинетическом режиме, а по истечении 8 минут наступает диффузионный режим реагирования. В интервале 2 – 8 минут имеет место переходный (смешанный) режим процесса.
Оценены значения константы кристаллохимических превращений и коэффициент диффузии кислорода в окалине.
Скорость реакции уменьшается во времени вследствие роста толщины слоя окалины и протеканием процесса в переходном и диффузионном режимах.
Контрольные вопросы
В чем заключаются различия гомогенных и гетерогенных реакций?
Из каких стадий складываются гетерогенные реакции?
Что называют режимом гетерогенной реакции?
Каковы особенности протекания реакций в различных режимах реагирования?
Как изменяется толщина пленки окалины при окислении металлов в различных
режимах реагирования?
В чем сущность гравиметрического метода исследования окисления металлов?
Какова структура железной окалины и от каких факторов она зависит?
Что такое вюстит и какова его роль в окислении железных сплавов?
Сформулируйте принцип жаростойкости железных сплавов.
Дайте определения константы скорости реакции и коэффициента диффузии.
В чем заключается реакционная диффузия и как она проявляется при окислении железа?
