
Министерство образования и науки Российской Федерации
Федеральное агентство по образованию
Государственное образовательное учреждение высшего профессионального образования
Московский институт стали и сплавов (технологический университет)
Новотроицкий филиал
Химическая кинетика
Расчетно-графическая работа 4 по физической химии
Выполнил студент гр. МЧМ-05-22
Принял доцент /Шерстобитов М. А./
Новотроицк, 2007
Задача 1
Рассматривается гомогенная реакция: А + В = продукты.
1. При температуре Т1= 325 К в моменты времениτ0, τ1, τ2,τ3 остаточная концентрация реагента А принимает значения: С0, С1, С2,С3...
При условии равенства исходных концентраций реагентов
определить порядок реакции методами:
аналитическим;
подбора координат;
периода полупревращения.
2. В момент времени τ1 при температурах Т1, Т4, Т5, Т6остаточная концентрация реагента А принимает значения: С1, С4,С5, С6.
Рассчитать значения константы скорости реакции при данных температурах, графическим методом определить энергию активации Е и получить уравнение зависимости константы скорости от температуры.
Оценить момент времени, по истечении которого прореагирует 90 % А при температуре Т7.
Таблица 1. Исходные данные к задаче 1
|
№ |
τ0 |
τ1 |
τ2 |
τ3 |
С0 |
С1 |
С2 |
С3 |
Т1 |
Т4 |
Т5 |
Т6 |
Т7 |
С4 |
С5 |
С6 |
|
13 |
0 |
10 |
20 |
30 |
1,2 |
0,6 |
0,3 |
0,15 |
325 |
330 |
335 |
340 |
345 |
0,53 |
0,46 |
0,39 |
Решение задачи
(Вариант 13)
Исходные данные при температуре Т1=325 представлены в таблице 2 и на рисунке 1.
Таблица 2. Изменение концентрации реагента А при 300 К
|
Время, мин |
0 |
10 |
20 |
30 |
|
Концентрация CA, моль/дм3 |
1,2 |
0,6 |
0,3 |
0,15 |

Определение порядка реакции
Порядком реакции называют сумм показателей степеней концентраций реагентов в уравнении зависимости скорости реакции от концентрации (выражение закона действующих масс).
![]() (1)
(1)
Порядок реакции редко равен сумме стехиометрических коэффициентов исходных веществ из-за сложности реакции и может быть дробным. Известны различные способы определения порядка реакции. В настоящей работе применяются три из них аналитический, подбора координат и метод периода полупревращений.
Метод подбора координат
Метод заключается в представлении зависимости концентрации реагента Сiот времени τ (кинетическая кривая реакции) в координатах, соответствующих реакциям разных порядков.
Если концентрация реагентов в начальный период времени одинакова, то кинетические уравнения реакции различных порядков имеют вид:
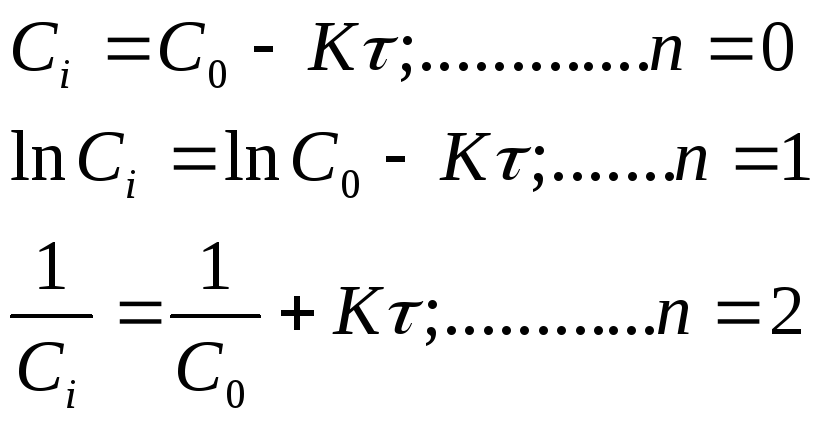 (2)
(2)
Кинетическая кривая реакции спрямляется в характерных координатах:
При n=0 это Сi–τ; приn=1 этоlnCi–τ; приn=2 ………1/Сi–τ.
На рисунке 1 видно что кинетическая кривая в координатах Сi–τне спрямилась, т.е реакция не нулевого порядка. В таблице 3 представлены изменения во времени для различных функций концентраций.
|
Время, мин |
0 |
10 |
20 |
30 |
|
Концентрация Сi моль/л |
1,2 |
0,6 |
0,3 |
0,15 |
|
Логарифм lnCi |
0,18 |
-0,51 |
-1,2 |
-1,9 |
|
Функция 1/Сiл/моль |
0,83 |
1,67 |
3,33 |
6,67 |
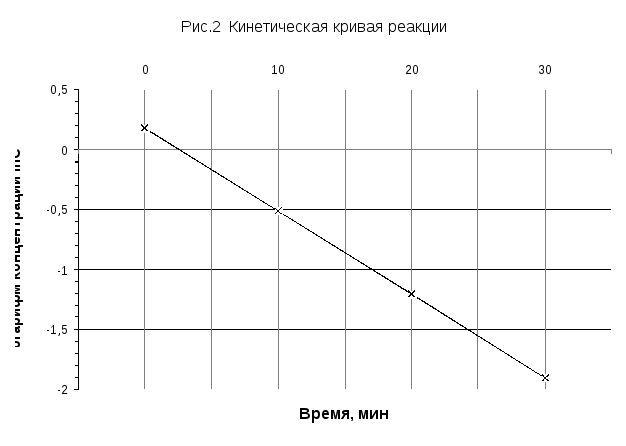
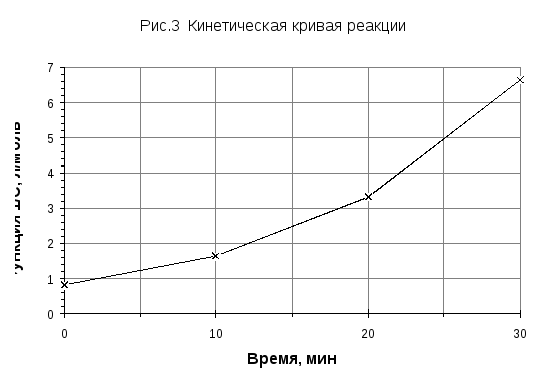
На рисунках 1-3 видно, что кинетическая кривая реакции спрямилась в координатах lnCi – τ, характерных для реакции 1-го порядка, т.е. порядокпервый.
Аналитический метод
Метод основан на законе действия масс согласно которому константа скорости не зависит от концентрации реагентов. Уравнения расчета констант скорости для реакций различных порядков имеют вид:
n=0 K=(C0-Ci)/ τi (3)
n=1 K=ln (C0/Ci)/ τi (4)
n=2 K=(1/ Ci-1/ C0)/ τi (5)
Данные об изменении концентрации реагентов во времени используются для расчета константы скорости по уравнениям реакции разного порядка. Предпочтение отдается тому варианту, в котором константа скорости не зависит от концентрации реагентов.
Пусть n=0.K1 = (C0-C1)/ τ1 = (1,2 – 0,6) / 10 = 0,06 моль/л*с
K2 = (1,2 – 0,3) / 20 = 0,045 моль/л*с
K3= (1,2 – 0,15) / 30 = 0,035 моль/л*с
Пусть n=1.K1 = ln (C0/C1) / τ1 = ln (1,2/0,6)/10 = 0,069 мин-1
K2 = ln (1,2/0,3) / 20 = 0,069 мин-1
K3 = ln (1,2/0,15) / 30 = 0,069 мин-1
Пусть n=2. K1= (1/C1-1/C0) / τ1= (1/0,6-1/1,2) / 10=0,083 л/моль*мин
K2= (1/0,3-1/1,2) / 20 = 0,125 л/моль*мин
K3= (1/0,15-1/1,2) / 30 = 0,194 л/моль*мин
Константа скорости получается не зависящей от концентрации при расчете по уравнению реакции первого порядка.
Метод периода полупревращений
Метод предложен Раковским и заключается в определении периода полупревращения реакции при различных начальных концентраций реагентов и основан на уравнении:
τ1/2~1/С0n-1(6)
Для определения порядка реакции достаточно знать период полупревращения при двух различных начальных концентрациях реагента:
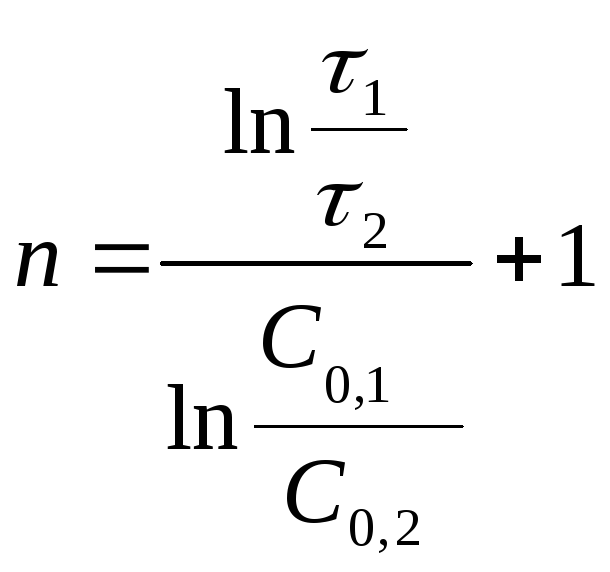 (7)
(7)
Согласно данных таблицы 1 при начальной концентрации С0,1=1,2 моль/л концентрация уменьшается в два раза к моменту времени 10 мин, при концентрации С0,2=0,3 моль/л концентрация уменьшается в два раза за период времени 10 мин. Таким образом, период полупревращения реакции не зависит от начальной концентрации, что характерно для реакции первого порядка.
n=(ln(10/10)/ln(1,2/0,3))+1=1
Таким образом все методы определения порядка реакции приводит к результату n=1.
Уравнение для расчета константы скорости:
K=ln(C0/Ci)/ τi
Влияние температуры
В таблице 4 приведены значения текущей концентрации реагента А в момент времени 10 минут при различных температурах.
Т=325 К. K=ln(1,2/0,6) / 10 =ln2 / 10 = 0,069 мин-1
Т=330 К K=ln(1,2/0,53) / 10 =ln2,26 / 10 = 0,082 мин-1
Т=335 К K=ln(1,2/0,46) / 10 =ln2,61 / 10 = 0,096 мин-1
Т=340 К K=ln(1,2/0,39) / 10 =ln3,08 / 10 = 0,112 мин-1
Таблица 4. Концентрация реагента А при различных температурах. (τ = 10 мин.)
|
Температура Т, К |
325 |
330 |
335 |
340 |
|
Концентрация СА, моль/л |
0,6 |
0,53 |
0,46 |
0,39 |
|
Константа скорости К мин-1 |
0,069 |
0,082 |
0,096 |
0,112 |
|
1000/Т , К-1 |
3,08 |
3,03 |
2,99 |
2,94 |
|
lnK |
-2,67 |
-2,5 |
-2,34 |
-2,19 |

Рисунок 4. Определение энергии активации реакции
На рисунке 4 зависимость lnK- 1/Tудовлетворительно описывается прямой проходящей через начальную и конечную точки с координатами:X1=2,94,Y1=--2,19;X2=3,08,Y2=-2,67. Угловой коэффициент прямой А=(Y2-Y1)/(X2-X1)=(-2,67+2,19)/(3,08-2,94)=-3,43
B=Y1-AX1 = -2,19 + 3,43*2,94 = 7,89
Энергия активации реакции E= -A*R= 3,43*8,31 = 28,5 кДж/моль = 28500 Дж/моль
Exp(B) =exp(7,89) = 2,67*103
Уравнение температурной зависимости константы скорости:
K = 2,67*103*exp(-28500/RT)
lnK = -3430/T+7,89
При температуре Т5 = 345 КK5= 2,67*103*exp(-28500/8.31*345) = 0,129 мин-1
При этой температуре прореагирует 90% вещества А т.е текущая концентрация равна СА=0,12 моль/л. Время реакции составит τ5=ln(C0/C5) /K=ln(1,2/0,12) / 0,129 = 17,85 мин.
