
Задача 2
Кинетика гетерогенной реакции
Цель работы.
- исследовать макрокинетику окисления железа при постоянной температуре;
- определить основные характеристики кинетического и диффузионного режимов реагирования.
Содержание работы
Гомогенные реакции в металлургических процессах весьма редки. Как правило, это реакции горения газов. Большинство реакций протекают на границах раздела фаз: металл-шлак, металл-газ, газ-шлак, металл-огнеупор и других, т.е. являются гетерогенными. Основной особенностью гетерогенных реакций является то, что место реагирования фиксировано в пространстве - это граница раздела фаз. Любая гетерогенная реакция складывается из двух последовательных этапов: подвода реагентов к месту реагирования (диффузионный) и химической реакции. Химический этап может быть сложным, многоступенчатым, включая и адсорбцию. Каждый из этих этапов имеет свои закономерности. Так, диффузионный этап описывается законами Фика, а химический – законами химической кинетики. Согласно первому закону Фика диффузионный поток вещества пропорционален градиенту концентрации dC/dx, гдеx– линейная координата в направлении диффузии. Коэффициент пропорциональностиD– количество вещества, диффундирующего за единицу времени через единичную площадку при единичном градиенте концентрации.
vдиф=DdC/dx(1)
Различают молекулярную диффузию (в неподвижной среде) и конвективную (в движущейся среде). Закономерности конвективной диффузии различны в зависимости от вида конвекции (ламинарная или турбулентная). Сложную в описании диффузию в подвижной среде заменяют молекулярной через неподвижный слой газа или жидкости условной толщины , зависящей от критерия РейнольтсаReсреды. Этот слой называют диффузионным.
Кинетический этап реагирования описывается законами химической кинетики или адсорбции: законом действия масс, основным законом кинетики, законами адсорбции.
Для математического описания гетерогенной реакции можно представить ее как сложную реакцию из последовательных стадий: диффузионной и химической со своими константами скоростей Кдиф=D/и Кхим. Диффузия подобна химической реакции первого порядка, и если химическая реакция имеет первый порядок, наблюдаемая константа скорости реакции определится выражением:
1/Кнаб=1/Кдиф+ 1/Кхим (2)
Если по каким-то причинам константы скоростей этапов разнятся очень сильно, наблюдаемая скорость реакции будет определяться закономерностями этапа с минимальной константой скорости.
При КхимКдифКнаб Кхим(кинетический режим)
При КдифКхимКнабКдиф(диффузионный режим)
При Кдиф Кхим (переходный режим реагирования)
В конкретном технологическом агрегате гетерогенная реакция протекает в одном из названных режимов реагирования. Возможен переход из одного режима реагирования в другой. Так, изотермическое окисление железа кислородом в начальные моменты протекает в кинетическом режиме, а в основном – в диффузионном.
При окислении металлов, например, кислородом воздуха на поверхности металла образуется пленка оксидов (окалина) толщиной y (рисунок 1). Наблюдаемую скорость реакции можно представить как линейную скорость роста окалиныdy/d.
В кинетическом режиме реагирования доставка кислорода к поверхности реакции протекает легко, и концентрация кислорода на реакционной поверхности Сповблизка к объемнойС0. В этом случае получаем:dy/d=KхимС0.Интегрирование этого уравнения приводит к результату:
y= КхимС0(3)
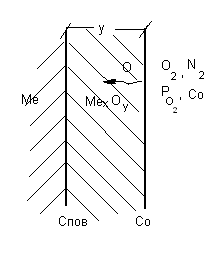
Рисунок 1.
Итак, в кинетическом режиме реагирования окалина нарастает во времени по линейному закону. В этом режиме окисляются щелочные и щелочноземельные металлы, магний и другие металлы, у которых объем сгоревшего металла меньше объема образовавшейся окалины, и пленка окалины получается пористой, не сдерживая диффузию кислорода к реакционной поверхности. Железо, у которого пленка окалины плотная, в первые моменты тоже может окисляться в кинетическом режиме.
Если пленка окалины достаточно плотная, и ее толщина такова, что Кдиф=D/yКхим, возможности реакции велики, и концентрация кислорода на реакционной поверхности близка к нулю. Окисление протекает в диффузионном режиме:
dy/d=D/y(C0–Cпов)D/yC0(4)
После интегрирования уравнения 4 получим:
y2= 2DC0(5)
В диффузионном режиме окалина нарастает по закону квадратичной параболы. В этом режиме окисляются многие металлы, в частности, железо.
В переходной области реагирования окисление металлов описывается более сложным законом:
0,5 Кхимy2 +Dy- КхимDC0= 0 (6)
Окисление железа сопровождается образованием окалины, в которой присутствуют все устойчивые оксиды железа. Так, при температуре выше 570 0С на воздухе образуется слоистая пленка, состоящая из вюстита (твердый растворFe3O4вFeO), магнетита (Fe3O4) и гематита (-Fe2O3). На границе магнетит/ гематит имеется переходная область метастабильного маггемита (-Fe2O3) толщиной в несколько параметров решетки. Из названных кристаллических фаз вюстит имеет дырчатую кристаллическую решетку, диффузия в которой протекает по вакансиям, поэтому при возникновении слоя вюстита он становится преобладающим в толщине окалины. При 8000С доля слоя вюстита превышает 90 %. Появление в окалине вюстита приводит к резкому увеличению скорости окисления железных сплавов. В соответствии с принципом жаростойкости Архарова для повышения жаропрочности сталей, к железу добавляют легирующие элементы (хром, никель и другие), исключающие образование вюстита, и образующие вместе с железом оксидные пленки с плотноупакованной кристаллической решеткой.
Окисление железа протекает в результате встречной диффузии катионов железа и атомов кислорода. На своем пути диффундирующие частицы встречают границы раздела фаз и участвуют в химических превращениях на этих границах. Например, катионыFe2+вюстита, внедряясь в решетку магнетита, увеличивают слой вюстита. Диффузия в слоистой среде, сопровождающаяся реакциями на границах слоев, называетсяреакционной диффузией.
Настоящая работа заключается в изучении реакции окисления железа, установлении режима реагирования и оценке основных физико-химических характеристик процесса: константы скорости реакции Кхим и коэффициента диффузииD.

Рисунок 2. Схема установки
