
- •2.3.1 Фракционный состав
- •2.3.2. Групповой состав
- •2.3.3. Гетероатомные соединения нефти и природного газа
- •2.3.4. Техническая характеристика нефтей
- •2.3.5. Классификация нефтей
- •3. Химизм и механизмы основных процессов технологии природных энергоносителей и углеродных материалов
- •3.1. Термические процессы
- •3.1.1. Термический крекинг и пиролиз углеводородов
- •3.1.2. Сажеобразование
- •3.1.3. Полукоксование и коксование тги
- •3.2. Каталитический крекинг и алкилирование углеводородов
- •3.2.1. Каталитический крекинг
- •3.2.2. Алкилирование парафинов олефинами
- •3.2.3. Алкилирование по ароматическому атому углерода
- •3.3. Процессы, связанные с переносом водорода
- •3.3.1. Гидрирование
- •3.3.2. Риформинг
- •3.3.3. Гидрокрекинг нефтяных остатков
- •3.3.4. Деструктивно-гидрогенизационная переработка тги
- •3.4. Окисление углеродсодержащих веществ
- •3.4.1. Выветривание и самовозгорание углей
- •3.4.2. Окисление и стабилизация топлив и масел
- •3.5. Газификация горючих ископаемых
- •3.6. Синтезы на основе оксида углерода и водорода
3.2.2. Алкилирование парафинов олефинами
Алкилирование парафинов олефинами можно рассматривать как обратный каталитическому крекингу процесс, также проходящий как ионно-цепная реакция. С позиции термодинамики ее выгодно проводить при сравнительно низкой температуре (до 100љњС), когда она практически необратима. Высокая скорость при этом достигается применением катализаторов, в качестве которых используют серную и безводную фтористоводородную кислоты, а также треххлористый алюминий. Исходными веществами служат изобутан и н-бутилены, приводящие к образованию смеси изооктановљ- компонентов высокооктанового моторного топлива. Для получения разветвленных углеводородов, выкипающих в тех же температурных пределах, что и авиационные бензины, изобутан и изопентан алкилируют не только индивидуальными олефинами, но и их смесями. н-Бутилены легко протонируются кислотой, давая карбокатион:
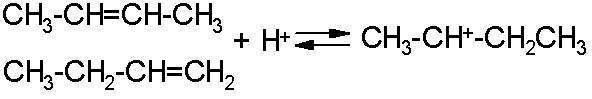
Вторичный карбокатион вступает в быстрый обмен гидрид-ионом с изобутаном, в результате получается более стабильный третичный катион:
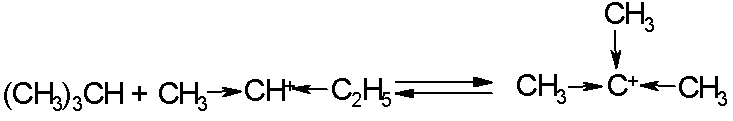
Совокупность этих двух реакций является стадией инициирования цепи, которая приводит к образованию активной частицы, вовлекающей олефин в цепь алкилирования:
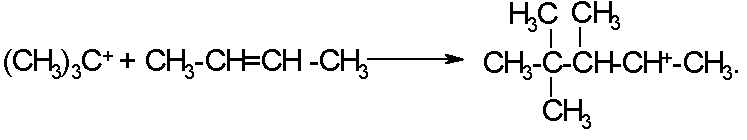
Разветвленный карбокатион вступает в
реакции изомеризации, приводящие к
набору продуктов в результате миграции
водорода и метильных групп:
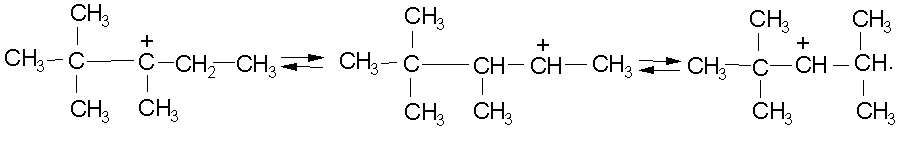 Каждый
из них может обмениваться водородом с
изобутаном, давая один из изомерных
изооктанов, и регенерируя трет-бутилкатион,
например:
Каждый
из них может обмениваться водородом с
изобутаном, давая один из изомерных
изооктанов, и регенерируя трет-бутилкатион,
например:
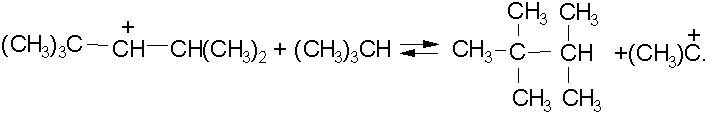
Таким образом продолжается цепной процесс. В данном случае получен 2,2,4-триметилпентан, называемый собственно изооктаном и служащий эталоном детонационной стойкости моторных топлив. Изооктильный катион может присоединить следующую молекулу олефина и образовать более высокомолекулярный продукт. Для уменьшения вклада этой побочной реакции, а также возможной катионной полимеризации олефина, применяют четырех- шестикратный избыток парафина по отношению к олефину. При этом из двух возможных параллельных реакций
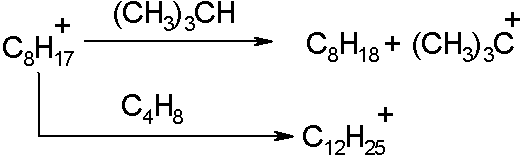
скорость второй снижается по сравнению с первой, что увеличивает селективность образования первого продукта. Температуру процесса выбирают так, чтобы подавить реакции деструкции при сохранении высокой скорости алкилирования. Поэтому, применяя достаточно активный катализатор (H2SO4), температуру поддерживают на уровне 0-10љњС. При менее активном катализаторе HF для увеличения скорости реакцию алкилирования проводят при 20-30љоС и повышают давление. Повышение давления увеличивает концентрацию газообразных реагентов, снижая вероятность деструктивных процессов.
3.2.3. Алкилирование по ароматическому атому углерода
Алкилирование может осуществляться не только по алифатическому, но и поароматическому атому углерода. Эта реакция протекает практически в тех же условиях, что и рассмотренная выше, по ионному механизму через промежуточное образование карбокатиона из олефина. Она также катализируется протонными и апротонными кислотами. В случае бензола катализатором, как правило, служит AlCl3. Эта реакция, как и другие процессы алкилирования-деалкилирования, обратима:
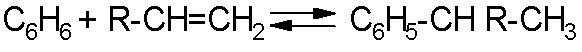
Вследствие высокой экзотермичности
равновесие при обычно используемых
условиях смещено вправо. Обратная
реакция в заметной мере начинает идти
только при ~300љњС.
Первая стадия
процесса, как и при алкилировании
парафинов,љ- протонирование двойной
связи олефина с образованием наиболее
устойчивого карбокатиона. Содержащие
более трех атомов углерода катионы
изомеризуются, поэтому в ядро ароматического
углеводорода вводится только разветвленный
радикал. В результате присоединения
карбокатиона к атому углерода бензольного
кольца ароматическая система разрушается,
и образуется положительно заряженный
промежуточный продукт с делокализованным
зарядом (![]() -комплекс):
-комплекс):
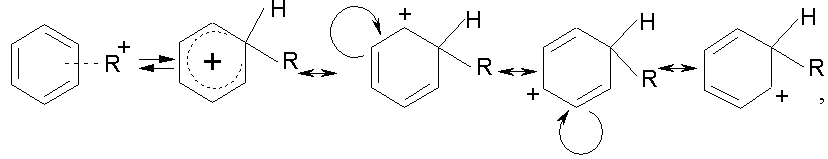
который стабилизируется за счет потери протона:
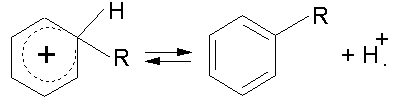
Алкилирование бензолаљ- нецепной каталитический ионный процесс, в котором одна молекула продукта образуется на каждый акт возникновения активной частицыљ- карбокатиона. Сходство в механизмах алкилирования ароматических и парафиновых углеводородов заключается в том, что активной промежуточной частицей в обоих случаях являются карбокатионы. Различие заключается в длине цепи: для ароматических углеводородов эта величина близка к единице, а для парафиновых к нескольким десяткам. Реализация цепного или нецепного путей алкилирования, по-видимому, определяется устойчивостью положительно заряженного продукта присоединения. Алифатический тон нестабилен, обладает большим запасом энергии и может отрывать протон от нейтральной молекулы. Ароматический катион сильно стабилизирован за счет делокализации связей, водород -комплекса достаточно прочно связан с атомом углерода кольца и не передается непосредственно нейтральной молекуле олефина по возможной реакции продолжения цепи:
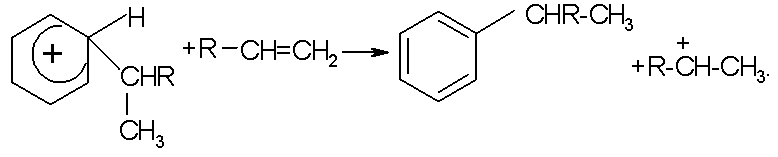
Из рассмотренных выше примеров обратимых реакций алкилирования-деалкилирования видно, что общее направление процесса обусловлено его термодинамикой, т.е. изменением свободной энергии реагентов в данной области температур и давлений. В то же время конкретные пути перехода от исходных веществ к продуктам (механизмы реакций) могут быть различными. Совокупность стадий превращения определяется свойствами реагирующих веществ и реакционной среды.
