
- •Основні закони хімічних перетворень. Найважливіші поняття хімічної кінетики
- •1. Хімічні і фазові рівноваги
- •2. Закон діючих мас
- •3. Константа рівноваги
- •4. Принцип Ле-Шательє. Фактори, що впливають на константу рівноваги і склад рівноважної системи
- •5. Каталітичні реакції. Гомогенний та гетерогенний каталіз. Ферментативний каталіз
- •6. Термодинамічна константа рівноваги. Вільна енергія Гіббса і константа рівноваги
- •7. Рівновага в гетерогенних системах
- •8. Добуток розчинності
- •9. Закон розподілу
- •10. Правило фаз
- •11. Фазові діаграми
- •12. Ланцюгові реакції. Фотохімічні реакції
- •Розчинення кальцій карбонату у хлоридній кислоті
- •Залежність швидкості реакції від концентрації речовин
- •Вплив температури на швидкість реакції
- •Вплив концентрації реагуючих речовин на хімічну рівновагу
- •Оборотність зміщення хімічної рівноваги
- •14. Контрольні запитання
6. Термодинамічна константа рівноваги. Вільна енергія Гіббса і константа рівноваги
Хімічна система у стані рівноваги відповідає найменшому запасу віль-ної енергії. Будь-яке відхилення від рівноважного стану супроводжується зростанням вільної енергії в системі. В цьому випадку, згідно з другим законом термодинаміки, виникає процес самовільного переходу даної системи в бік зменшення вільної енергії, за рахунок виділення якої можливе здійснення корисної роботи.
Максимальна робота ізотермічної реакції при постійному тиску і по-стійній температурі визначається зміною так званого ізобарного потенці-алу G (вільна енергія Гіббса). Ця величина характеризує максимальну корисну роботу реакції і вказує на напрямок перебігу реакції.
Максимальна робота реакції пов’язана з константою рівноваги простим співвідношенням, яке вперше було введено Вант-Гоффом у 1885 р. Він довів, що між константою хімічної рівноваги і різницею приросту вільної енергії існує логарифмічна залежність:
Аmax. = -G = RT lnK, (83)
де R – універсальна газова стала, Т – термодинамічна температура за Кель-віном.
Щоб довести зв’язок між константою рівноваги і максимальною корис-ною роботою, розглянемо окрему реакцію, наприклад, реакцію
mA + nB rС + qD,
яка протікає у газовій фазі при постійному тиску і температурі в умовах, що відрізняються від рівноважних. Припустимо, що в момент змішування брали участь два учасники реакції і в таких кількостях, що в результаті зменшилась кількість m і n моль вихідних речовин і утворилось r і q моль продуктів реакції. Склад і загальний тиск системи не змінились. Зміна енергії Гіббса в ході реакції визначається виразом:
![]() ,
(84)
,
(84)
а з урахуванням хімічного потенціалу системи i* , для якого характерна
залежність
![]() ,
(85)
,
(85)
де
![]() тиск
індивідуального газу;
тиск
індивідуального газу;
![]() стандартний
хімічний потенціал;
стандартний
хімічний потенціал;
![]() хімічний
потенціал, отримаємо вираз:
хімічний
потенціал, отримаємо вираз:
![]()
![]()
![]() (86)
(86)
Якщо уявити, що в системі вудбувається стан хімічної рівноваги, то G = 0, а (86) перетворюється у рівність:
![]() (87)
(87)
Права частина рівняння (87) є –RTlnKp. Підставивши це значення в (86), отримаємо
 .
(88)
.
(88)
Аналогічним чином отримують вираз зміни енергії Гіббса для процесів, що протікають при постійному об’ємі і температурі:
 .
(89)
.
(89)
Рівняння (88) і (89) називають рівняннями ізотерми хімічної реакції або рівняннями Вант-Гоффа. Вони показують залежність між зміною термодинамічного потенціалу G, константою хімічної рівноваги (Кр чи Кс) і умовами проведення реакції. Останні характеризуються першим членом у
дужках. До нього входять парціальні тиски (концентрації) учасників реакції у вихідному стані, що задаються самовільно. Другий член у дужках

*
Похідну термодинамічного потенціалу
усієї системи при зміні вмісту i-го
учасника на один моль за умови постійності
усіх інших учасників і зовнішніх
параметрів називають хімічним
потенціалом
системи
![]()
(ln Kp чи lnKc) містить ці величини у рівноважному стані. При заданих зовнішніх параметрах (р і Т) вони є величинами постійними.
За рівняням ізотерми хімічної реакції можна розраховувати зміну енергії Гіббса при відповідних умовах, тобто визначати можливість, напрямок і межу протікання самовільного процесу.
Щоб самовільно здійснювалась пряма реакція, зміна термодинамічного потенціалу повинна бути негативною (G 0), а це можливо за умови
 (90)
(90)
Якщо
 (91)
(91)
тоді самовільно пройде зворотна реакція. При встановленні рівноваги
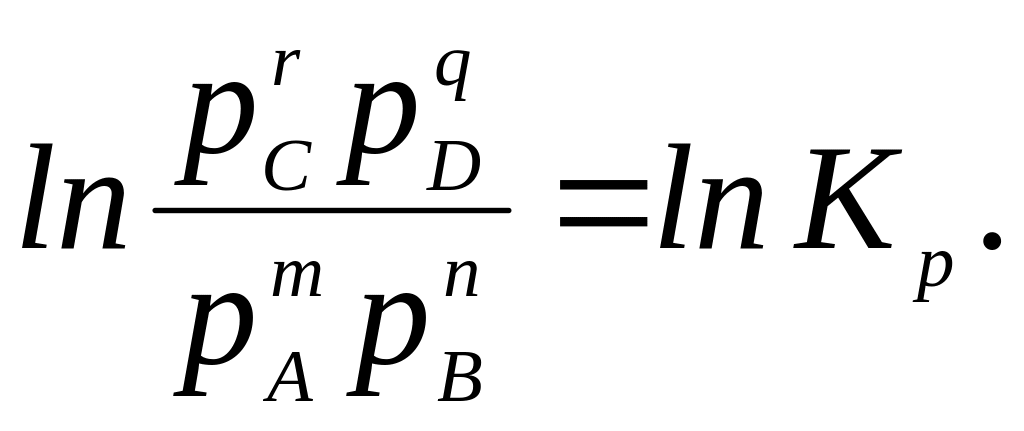 (92)
(92)
