
- •Гравиметрический анализ
- •Расчеты в гравиметрическом анализе
- •1. Фактор пересчета (гравиметрический фактор)
- •2. Расчет массы или объема пробы для анализа и объема раствора реагента-осадителя
- •3. Расчет растворимости осадка
- •3.1. Растворимость в воде и в присутствии электролитов
- •3.2. Растворимость и рН осаждения гидроксидов металлов
- •3.3. Растворимость солей слабых кислот
- •4. Расчет результатов анализа
- •Варианты индивидуальных заданий
- •Ответы к задачам
- •Раздел 2
- •Раздел 3.1
- •Раздел 3.2
- •Раздел 3.3
- •Раздел 4
- •Библиографический список
- •Оглавление
- •620002, Екатеринбург, ул. Мира, 19
- •620002, Екатеринбург, ул. Мира, 19
3. Расчет растворимости осадка
3.1. Растворимость в воде и в присутствии электролитов
Гетерогенное равновесие малорастворимого электролита АmBn с его насыщенным раствором, в котором он диссоциирует нацело:
АmBn (тв.) ⇄ АmBn (р-р) ⇄ mAn+ + nBm-
количественно может быть охарактеризовано термодинамической константой равновесия:
К0s = ПР0 = аm(Аn+)an(Bm-), где а(Аn+), a(Bm-) – активность ионов.
Активность ионов связана с истинной концентрацией этих ионов следующим соотношением: а(Аn+) = fi[A], где [A] – истинная концентрация иона в растворе, моль/л, fi – коэффициент его активности, который определяется ионной силой раствора , зарядом и радиусом иона.
Ионную силу раствора рассчитывают по
формуле
![]() (3.1),
(3.1),
где Сi – концентрация, моль/л, Zi – заряд каждого сорта ионов в растворе.
Коэффициенты активности индивидуальных ионов можно найти в справочной литературе или оценить по формулам Дебая-Хюккеля:
![]() ,
если < 0,01;
,
если < 0,01;
![]() ,
если 0,01<
<0,5.
,
если 0,01<
<0,5.
Величину Кs = ПР = [Аn+]m[Bm-]n называют концентрационным произведением растворимости.
Растворимостью (S) называется общая концентрация вещества в его насыщенном растворе. При растворении вещества АmBn в отсутствие одного из одноименных ионов (А или В) его ионы переходят в раствор в стехиометрических количествах: если в 1 л раствора перешло S моль АmBn, то общие концентрации ионов А и В составляют, соответственно, mS и nS моль/л.
АmBn (тв.) |
⇄ |
АmBn (р-р) |
⇄ |
mAn+ |
+ |
nBm- |
|
|
S моль/л |
|
mS моль/л |
|
nS моль/л |
Подставляя эти величины в выражение для ПР, получаем:
ПР = (mS)m(nS)n.
Отсюда растворимость равна:
![]() (3.2)
(3.2)
В присутствии избытка одноименного иона – например, иона В – имеем:
АmBn (тв.) |
⇄ |
АmBn (р-р) |
⇄ |
mAn+ |
+ |
nBm- |
|
|
S моль/л |
|
mS моль/л |
|
СВ моль/л |
ПР = (mS)m(СВ)n.
Отсюда растворимость равна:
![]() (3.3)
(3.3)
Если в системе не протекают побочные реакции, к тому же ионная сила раствора весьма мала и fA fВ 1, то для расчетов можно использовать непосредственно табличное значение ПР и формулы (3.2–3.3).
В присутствии сильных электролитов и при большой растворимости соединения (при большой ионной силе раствора) следует учитывать коэффициенты активности соответствующих ионов. Тогда выражение для ПР примет вид (в отсутствии избытка одноименных ионов):
ПР = (fAmS)m(fВnS)n.
Отсюда растворимость равна:
![]() .
.
Увеличение растворимости осадков в присутствии сильных электролитов ("солевой эффект") может привести к систематическому занижению результатов анализа.
Пример 3.1. Рассчитать растворимость и потерю осадка PbSO4 в 200 мл промывной жидкости: а) дистиллированной воды;
б) 0,01 М раствора серной кислоты;
в) 0,1 М раствора электролита KNO3.
Определить солевой эффект. Масса осадка PbSO4 0,2 г.
Решение. Примем, что при промывании осадка успевает установиться равновесие между твердой фазой и промывной жидкостью.
ПРPbSO4 = [Pb2+][SO42-] = 1,710-8
а) При промывании дистиллированной водой (отсутствуют одноименные ионы, ионная сила раствора незначительна) в насыщенном растворе сульфата свинца равновесные концентрации ионов металла и сульфат-ионов будут одинаковы [Pb2+] = [SO42-]. Тогда растворимость сульфата свинца составит:
![]() .
.
В 200 мл промывного раствора содержание сульфата свинца будет равно:
![]() .
.
Это составит потерю (масс. %) при промывке 0,2 г осадка PbSO4:
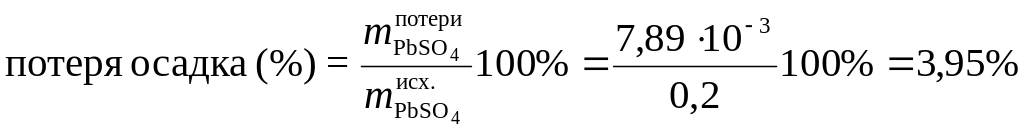 .
.
б) В присутствии в промывной жидкости 0,01 моль/л H2SO4 равновесная концентрация сульфат-ионов составит [SO42-] = 0,01 моль/л. Тогда растворимость осадка (без учета ионной силы раствора) составит:
![]()
Тогда в 200 мл промывного раствора содержание сульфата свинца будет равно:
![]() .
.
Это составит потерю (масс. %) при промывке 0,2 г осадка PbSO4:
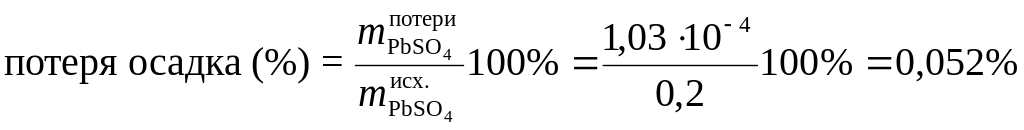 .
.
Для получения более точных результатов следует учесть ионную силу раствора. При расчете ионной силы по формуле (3.1) суммирование проводится по всем ионам, присутствующим в растворе. В нашем случае сильным электролитом, определяющим ионную силу раствора, является серная кислота концентрации 0,01 моль/л. Примем, что серная кислота диссоциирует нацело по обеим ступеням, тогда:
H2SO4 |
|
2 H+ |
+ |
SO42- |
0,01 М |
|
0,02 М |
|
0,01 М |
![]() .
.
Коэффициенты активности ионов Pb2+
и SO42- при
данном значении ионной силы раствора
равны
![]() .
.
Растворимость PbSO4 в 0,01 М растворе H2SO4 равна:
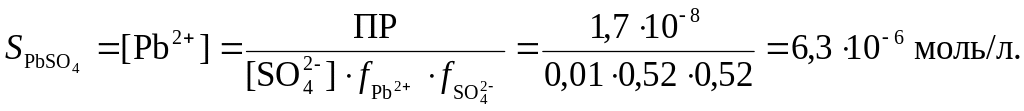
В 200 мл промывного раствора содержание сульфата свинца будет равно:
![]() .
.
Это составит потерю (масс. %) при промывке 0,2 г осадка PbSO4:
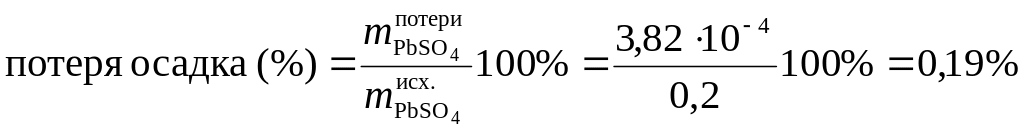 .
.
в) Растворимость осадка PbSO4
в промывном растворе сильного электролита
KNO3 (0,1 моль/л)
рассчитывают с учетом ионной силы
раствора. Концентрации ионов, учитываемые
при расчете ионной силы раствора,
составляют
![]() .
.
Тогда
![]() .
Для данной ионной силы раствора
коэффициенты активности равны
.
Для данной ионной силы раствора
коэффициенты активности равны
![]() .
.
Тогда растворимость сульфата свинца составит:
 .
.
В 200 мл промывного раствора содержание сульфата свинца будет равно:
![]() .
.
Это составит потерю (масс. %) при промывке 0,2 г осадка PbSO4:
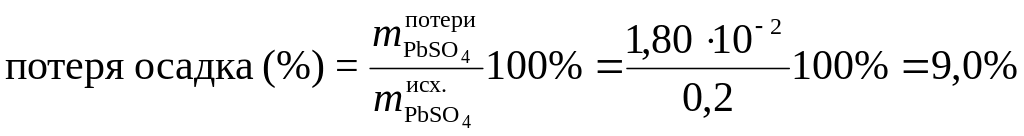 .
.
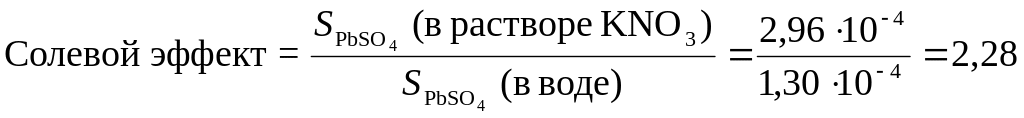 .
.
Таким образом, растворимость сульфата свинца в 0,1 М растворе KNO3 в 2,28 раза больше, чем в воде.
Вывод: При добавлении избыточного количества одноименного иона растворимость осадка уменьшается. В присутствии постороннего сильного электролита растворимость осадка увеличивается.
Задачи
В табл. 3.1. приведены задачи, в которых нужно рассчитать растворимость и потерю осадка (масс. %) при промывании:
а) дистиллированной водой (объем указан в столбце 4);
б) промывной жидкостью, содержащей одноименный ион ,без учета ионной силы раствора (промывной раствор и его объем указаны в столбцах 5 и 4 соответственно);
в) раствором сильного электролита (промывной раствор и его объем указаны в столбцах 6 и 4 соответственно). Рассчитать солевой эффект, т.е. определить во сколько раз растворимость осадка в растворе электролита больше, чем в воде.
Таблица 3.1
Данные для расчета растворимости осадка
Номер задачи |
Осаждаемая форма |
Промывная жидкость |
|||
формула |
масса, г |
объем, мл |
Электролит с одноименным ионом и его концентрация |
Посторонний электролит и его концентрация, моль/л |
|
81 |
BaSO4 |
0,4 |
150 |
H2SO4, 0,001 M |
KCl, 0,04 М |
82 |
СаС2О4 |
0,3 |
100 |
(NH4)2C2O4, 1г/л |
KNO3, 0,01 M |
83 |
Ce(IO3)4 |
0,3 |
200 |
KIO3, 1 % (масс.) |
KNO3, 0,05 M |
84 |
SrCO3 |
0,3 |
250 |
(NH4)2CO3, 0,05 M |
NaCl, 0,1 M |
85 |
SrC2O4 |
0,4 |
200 |
(NH4)2C2O4, 1,24 г/л |
NaNO3, 0,1 M |
86 |
Ce2(C2O4)3 |
0,5 |
300 |
(NH4)2C2O4, 0,01 M |
KCl, 0,05 М |
87 |
Ag2CrO4 |
0,3 |
250 |
K2CrO4, 0,01 M |
KNO3, 0,05 M |
88 |
Ag2CO3 |
0,5 |
200 |
(NH4)2CO3, 10 г/л |
KNO3, 0,05 M |
89 |
MgNH4PO4 |
0,4 |
300 |
NH4NO3, 10 г/л |
NaCl, 0,1 M |
90 |
UO2NH4PO4 |
0,5 |
300 |
NH4NO3, 10 г/л |
NaCl, 0,05 M |
91 |
AgCl |
0,1 |
200 |
HCl, 0,01 M |
Ca(NO3)2, 0,03 M |
92 |
La2(C2O4)3 |
0,5 |
150 |
(NH4)2C2O4, 0,02 M |
NaNO3, 0,05 M |
93 |
PbCO3 |
0,4 |
200 |
(NH4)2CO3, 0,01 M |
NaNO3, 0,03 M |
94 |
CaCO3 |
0,3 |
200 |
(NH4)2CO3, 10 г/л |
KCl, 0,04 М |
95 |
FeS |
0,2 |
50 |
(NH4)2S, 4 M |
Na2SO4, 0,02 M |
96 |
MgC2O4 |
0,5 |
50 |
(NH4)2C2O4, 10 г/л |
NaCl, 0,05 M |
97 |
CaF2 |
0,3 |
100 |
NH4F, 0,01 M |
KCl, 0,1 М |
98 |
PbSO4 |
0,2 |
200 |
H2SO4, 0,01 M |
KNO3, 0,1 M |
99 |
Th(IO3)4 |
0,4 |
200 |
KIO3, 1 % (масс.) |
KNO3, 0,05 M |
К раствору, содержащему ионы Cl- и CrO42-, прибавляли по каплям раствор нитрата серебра. Концентрация ионов CrO42- в растворе равна 0,1 моль/л. Рассчитать при какой наименьшей концентрации ионов хлора в растворе начнется осаждение Ag2CrO4.
Сколько миллилитров 1 М раствора H2SO4 надо прибавить к одному литру воды, чтобы при промывании 0,1 г осадка BaSO4 этой жидкостью объемом 250 мл потери осадка не превышали 0,01 %.
Какой избыток (мл) раствора (NH4)2C2O4Н2О с массовой долей 4 % надо взять, чтобы в 400 мл раствора при осаждении СаС2О4 потерялось от растворения не более 0,00001 г кальция?
Вычислить потери PbSO4 (г и %) за счет растворимости осадка, полученного при добавлении к 20 мл 0,1 М Pb(NO3)2 полуторного избытка 0,1 М H2SO4 (расчеты провести без учета и с учетом ионной силы).
Какой объем раствора NH4NO3 с массовой долей 5 % надо взять, чтобы на 500 мл фильтрата при осаждении MgNH4PO4 потерялось не более 0,0002 г оксида магния? Каким образом и во сколько раз изменится растворимость осадка, если создать избыточную концентрацию нитрата аммония 0,1 моль/л (расчеты провести с учетом ионной силы раствора)?
Вычислить: а) потерю массы 100 мг осадка СаС2О4 при промывании его 250 мл воды; б) концентрацию оксалат-ионов в промывной жидкости, чтобы в 250 мл ее терялось не более 0,1 % от массы осадка; в) во сколько раз увеличится растворимость СаС2О4 при введении в 250 мл воды 0,025 моля KCl?
Во сколько раз растворимость BaSO4 в дистиллированной воде больше, чем в промывной жидкости, приготовленной из 200 мл воды и одной капли концентрированной серной кислоты ( = 1,83 г/см3). Объем капли принять равным 0,04 мл.
Сколько миллилитров 25 %-ного NH3 нужно добавить к 150 мл промывной жидкости, чтобы при промывании осадка MgNH4PO4 потери за счет растворимости составили не более 0,0001 г MgO?
Сколько миллилитров 0,1 М раствора (NH4)2C2O4 следует добавить в 1 л насыщенного водного раствора СаС2О4 для понижения его растворимости до 0,1 мг/л?
Во сколько раз уменьшится концентрация AgCl, если к его насыщенному раствору прибавить KCl в таком количестве, чтобы его молярная концентрация составила 0,1 моль/л?
Будет ли осаждаться SrSO4 при добавлении 5 мл насыщенного раствора CaSO4 к 20 мл раствора, содержащего 0,5 моль стронция?
К 90 мл раствора, содержащего фосфат-ионы, постепенно приливают 1,510-4 М раствор нитрата серебра. Осадок фосфата серебра появляется, когда добавлено около 2,4 мл этого раствора.
Рассчитать: а) приближенное значение молярной концентрации фосфат-ионов в растворе; б) растворимость Ag3PO4 в 0,1 М растворе KNO3.
Осадок, содержащий 0,3 г СаСО3, промыт 300 мл воды. Сколько граммов СаСО3 будет растворено при этом и какую часть от массы осадка (в процентах) составит потеря вследствие его растворимости? Во сколько раз уменьшится растворимость осадка, если вместо воды для промывания осадка использовать 0,01 М раствор карбоната аммония?
Для осаждения серебра из 100 мл раствора, содержащего 0,3398 г AgNO3 израсходовано 17 мл 0,1 М раствора HCl. Вычислить количество серебра, оставшегося неосажденным, и потери его (% масс.). Рассчитать потери серебра (% масс.), если при осаждении вместо 17 мл израсходовать 21 мл 0,1 М раствора HCl.
К 150 мл 0,05 М раствора K2SO4 прилито 100 мл раствора, содержащего 0,42 г хлорида бария. Вычислить: а) молярную концентрацию сульфат-ионов в растворе; б) потерю бария (% масс.) за счет растворимости осадка ( расчеты провести с учетом ионной силы раствора).
К раствору, содержащему ионы Cl- и CrO42-, постепенно добавляют раствор AgNO3. При какой исходной концентрации ионов CrO42- можно увидеть резкое изменение окраски белого осадка AgCl, вызванного начавшимся осаждение темного осадка Ag2CrO4 в момент, когда растворимость AgCl не превышает 10-5 моль/л?
Рассчитать массу серебра в растворе, если к 53 мл раствора, содержащего 82 мг AgNO3, прилить 47 мл 0,01 М раствора Na2CO3 (расчеты провести с учетом ионной силы раствора).
Насыщенный раствор CaSO4 смешали с равным объемом раствора, содержащего 0,0248 г (NH4)2C2O4 в 1 л. Произойдет ли образование осадка СаС2О4?
Осадок MgNH4PO46H2O массой 1,5 г промыт 250 мл промывной жидкости, приготовленной из 500 мл воды и 1 мл 10 %-ного раствора аммиака. Сколько процентов осадка перешло в раствор?
Сколько миллилитров воды потребуется при промывании 0,5 г осадка MgNH4PO46H2O, чтобы потери за счет растворимости не превышали 0,05 %?
Сколько миллилитров 0,05 М (NH4)2SO4 нужно прибавить к 300 мл воды, чтобы при промывании 0,5 г осадка BaSO4 этим раствором потери за счет растворимости не превышали 0,01 %?
