
Министерство образования и науки Российской Федерации
Государственное образовательное учреждение высшего
профессионального образования
«Ростовский государственный строительный университет»
Утверждено на заседании
кафедры химии 22.04.10
Методические указания
по курсу физико-химических методов исследования
«Комплексонометрия»
Ростов-на-Дону
2010
Методические указания по курсу физико-химических методов исследования «Комплексонометрия». - Ростов н/Д: Рост. гос. строит. ун-т, 2010. - 7 с.
Изложены теоретические вопросы комплексонометрического анализа. Рассчитаны на студентов III курса дневной и заочной форм обучения специальности «Производство стройматериалов».
УДК 541.2
Составители: канд. хим. наук, доц.
Е.А. ЛЕВИНСКАЯ
канд. хим. наук, доц.
М.Н. МИЦКАЯ
Редактор Т.М. Климчук
Темплан 2010 г., поз. 202
Подписано в печать 18.0610. Формат 60x84/16.
Бумага писчая. Ризограф. Уч.-изд. л. 0,6. Тираж 100 экз. Заказ
Редакционно-издательский центр РГСУ
344 022, Ростов-на-Дону, ул. Социалистическая, 162.
© Ростовский государственный
строительный университет, 2010
Комплексонометрия
Комплексонометрическое титрование (или комплексонометрия) основано на образовании прочных комплексных соединений хелатного типа ионов металлов со специальными органическими реагентами группы аминополикарбоновых кислот — комплексонами. Среди комплексонов наибольшее практическое значение имеет этилендиаминтетрауксусная кислота (ЭДТУ, комплексон II, трилон А):
НООСН2С──N──СН2──СН2──N──СН2СООН
НOOC Н2С СН2COOН
а также ее натриевая соль (ЭДТА, комплексон III, трилон Б):
НООСН2С──N──СН2──СН2──N──СН2СООН
NaOOC Н2С СН2COONa
Внутрикомплексные (хелатные) соединения с ЭДТУ образуются за счет, с одной стороны, замещения ионами металла-комплесообразователя активных атомов водорода карбоксильных групп, а с другой — взаимодействия с атомами азота, в результате образования донорно-акцепторных связей. При взаимодействии с ионами металлов ЭДТУ образует комплексные соединения постоянного состава 1:1 независимо от заряда катиона, что является ценным свойством ЭДТУ как титранта.
ЭДТУ — четырехосновная кислота. Ступенчатые константы ее диссоциации отвечают значениям рК: 2,0; 2,7; 6,2; 10,3. Произведение констант диссоциации характеризуется значением рКобщ= 21,2. Для написания формулы ЭДТУ и ее ионов часто используют сокращения Н4Y, Н3Y–, Н2Y2–, НY3–,Y4–.
В умеренно кислых растворах реакции титрования могут быть записаны в виде:
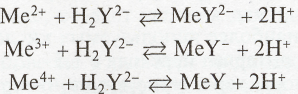
где Ме2+, Ме3+, Ме4+ — катионы металла-комплексообразователя. Образуя комплекс с ЭДТУ, катион металла замещает водородные атомы карбоксильных групп, поэтому рН раствора имеет большое значение при титровании ЭДТУ. Выделяющиеся при реакции ионы водорода сдвигают равновесие реакции образования комплекса влево, поэтому для полноты протекания реакции титрование проводят в буферных растворах при постоянном и подходящем значении рН.
Прочность комплексов металлов с ЭДТУ выражается константой диссоциации (константой устойчивости): =[Меn+][Y4-]/[MeYn-4], где Y4── анион ЭДТУ.
Для некоторых металлов lg комплексов имеют следующие значения:
магний — 8,7;
кальций — 10,7;
алюминий — 16,1;
цинк — 16,5;
железо (III) — 25,1.
ЭДТУ плохо растворима в воде, поэтому обычно в анализе используют ее кислую двунатриевую соль─ трилон Б.
Трилон Б образует прочные растворимые в воде комплексные соединения с катионами металлов, которые замещают водород в карбоксильных группах и связываются донорно-акцепторной связью с атомами азота:
СН2СОО─Me─ООСН2С
N— СН2— СН2—N
NaOOCН2С СН2COONa
В комплексонометрии используют методы прямого, обратного и заместительного титрования. Наиболее часто используют прямое титрование: большинство металлов можно определить прямым титрованием раствором ЭДТА.
Обратное титрование, основанное на добавлении избыточного количества ЭДТА и последующем определении избытка, применяется в тех случаях, когда образование комплекса с ЭДТА происходит медленно или нет подходящего металлоиндикатора для определения конечной точки титрования.
Метод заместительного титрования применяют для определения ионов, не образующих устойчивых комплексов с ЭДТА.
Методом прямого комплексонометрического титрования анализ проводится при определенном значении рН. В кислой среде проводят анализ ограниченного числа катионов, например алюминия и железа (III), образуют с комплексонами прочные комплексные соединения.
Большинство катионов в кислой среде образуют очень неустойчивые комплексные соединения. Поэтому титрование растворов определяемых катионов проводят, как правило, в щелочной среде (рН 8 — 13). Для обеспечения щелочной среды используют растворы щелочей или буферные растворы (например, аммонийный буферный раствор: NH4ОН + NH4C1).
В методе комплексонометрии при титровании точку эквивалентности устанавливают с помощью металлоиндикаторов. Металлоиндикаторы — это органические вещества, образующие с определяемыми катионами металлов растворимые в воде окрашенные комплексные соединения.
В качестве окрашенных металлоиндикаторов в комплексонометрическом методе применяют эриохром черный Т (синяя окраска), кислотный хром темносиний, мурексид (темнокрасная окраска) и др.
Некоторые металлоиндикаторы сами не имеют окраски, но образуют с ионами металлов окрашенные комплексы. Примерами неокрашенных металлоиндикаторов служат салициловая, сульфосалициловая и гидроксамовые кислоты.
Комплексные соединения катионов с металлоиндикаторами менее прочные, чем внутрикомплексные соединении, образуемые катионами металлов с комплексонами. При титровании неустойчивое комплексное соединение определяемого катиона металла с металлоиндикатором полностью разрушается и металлоиндикатор выделяется в свободном виде, цвет которого отличается от цвета комплексного соединения индикатора с определяемым катионом. Например, если к анализируемому раствору, содержащему ионы магния, добавить эриохром черный Т, раствор окрашивается в винно-красный цвет, так как образуется комплекс эриохрома с магнием:
HI2─ + Mg2+↔MgI─ + H+.
голубая красная
Протоны, выделяющиеся в ходе этой реакции, поглощаются компонентами буфера.В процессе титрования раствора трилоном Б комплекс эриохрома с магнием разрушается и ионы магния связываются в более прочный бесцветный комплекс с трилоном Б. Индикатор выделяется в свободной форме синего цвета. В точке эквивалентности весь магний связан трилоном Б
MgI─ + H2Y2─ ↔MgY2─ + HI2─
красная голубая
Положение области перехода окраски индикатора определяется величиной его константы устойчивости с ионом металла, подобно тому, как для кислотно-основных индикаторов — величиной константы кислотности. Для металлоиндикаторов границы рМ' области перехода окраски составляют:
рM'перехода= lgК±l (K — константа устойчивости комплекса металла с индикатором).
Индикаторы для комплексонометрического определения металлов
Ион металла рН Индикатор Переход окраски
Mg2+ 10 эриохромовый черный Т красная — голубая
Са2+ 12 мурексид розовая — фиолетовая
Zn2+ 10 эриохромовый черный Т красная — голубая
Bi3+ 1 ксиленоловый оранжевый красная — желтая
Комплексонометрическое определение жесткости воды
Вода природных источников содержит ряд катионов (Са2+, Mg2+, Fe2+, Fe3+, Zn2+ и др.), способных образовывать достаточно прочные внутрикомплексные соединения с трилоном Б. 1 моль эквивалента трилона Б всегда связывает 1 моль эквивалента металла, независимо от степени его окисления.
Комплексные соединения (комплексонаты), образуемые трилоном Б с катионами, присутствующими в воде, имеют различную прочность, количественно выражаемую величиной константы нестойкости. Константа нестойкости (Кнест) — это константа диссоциации комплексоната, и чем меньше ее величина, тем устойчивее комплекс. Удобнее прочность комлексных соединений выражать величиной, равной отрицательному логарифму константы нестойкости (рКнест).
При определении одного из катионов, присутствующих в воде, необходимо обязательно учитывать значения рКнест комплексонатов сопутствующих катионов, так как если значения рКнест комплексонатов сопутствующих катионов будут больше рКнест комплексоната определяемого катиона, то эти катионы будут мешать при титровании раствора трилоном Б. Катионы, мешающие определению анализируемого катиона, должны быть удалены из воды (обычно осаждением) или маскированы переводом в бесцветные устойчивые комплексы.
Жесткость воды обычно выражают числом ммоль эквивалентов кальция и магния в 1 л воды. При их определении сопутствующие катионы должны отсутствовать.
При добавлении к воде, содержащей только катионы Са2+ и Mg2+, металлоиндикатора эриохрома черного Т раствор окрашивается в винно-красный цвет. рН раствора должен быть выше 9. Не надо добавлять много индикатора, чтобы связать все катионы кальция и магния. Достаточно добавить небольшое количество индикатора, чтобы связать часть катионов кальция и магния до появления розовой или винно-красной окраски раствора.
При титровании анализируемого раствора трилоном Б в эквивалентной точке, когда полностью разрушаются комплексы металлоиндикатора с Са2+ и Mg2+, появляется синяя окраска самого индикатора. При определении Са2+ протекает реакция:
NaCaInd + Na2H2R = Na2CaR + NaH2Ind
комплекс индикатора трилон Б комплекс трилона индикатор
(винно-красный) (бесцветный) с кальцием (синий)
ХОД АНАЛИЗА
Для определения общей жесткости воды 25 мл анализируемой пробы пипеткой переносят в коническую колбу емкостью 250 мл, добавляют 5 мл аммиачноного буферного раствора и 7—8 капель индикатора. Содержимое колбы тщательно перемешивается до полного растворения индикатора. Пробу титруют раствором трилона Б до изменения окраски титруемого раствора из винно-красной в синюю.
Титрование проводят медленно, непрерывно перемешивая анализируемую пробу воды.
Жесткость воды (Жобщ, ммольэкв/л) рассчитывается по формуле:
Жобщ =V1N∙1000/V,
где N — нормальность раствора трилона Б, мольэкв/л; Vl — объем раствора трилона Б, израсходованный на титрование анализируемой пробы воды, мл; V— объем пробы воды, взятой на анализ, мл.
