
- •Предисловие
- •Введение
- •1. Техническая термодинамика
- •1.1 Основные понятия термодинамики
- •1.3 Теплота и работа как формы передачи энергии.
- •1.4 Вычисление работы деформации газа.
- •1.5 Теплоемкость. Количество тепла в термодинамических процессах.
- •1.6 Изменение внутренней энергии рабочего тела.
- •1.7. Энтальпия рабочего тела.
- •1.8. Энтропия рабочего тела
- •1.9 Первый закон термодинамики.
- •1.10 Исследование термодинамических процессов с идеальным газом.
- •Обратимый изотермический процесс.
- •1.11 Термодинамические циклы Круговые процессы
- •Цикл Карно
- •1.12. Цикл Карно.
- •3) Цикл со смешенным подводом тепла (цикл Тринклера).
- •Сравнение циклов двс.
- •1.13 Водяной пар.
- •Диаграмма I-s водяного пара.
- •Графоаналитический метод расчета процессов с водяным паром.
- •1.14 Паротурбинные установки
- •Тесты для самостоятельной работы
- •Термодинамические процессы
- •Вычисление работы деформации газа.
- •Идеальные циклы д.В.С.
- •2.Основы теории теплообмена
- •2.1 Способы распространения тепла.
- •2.2 Теплопроводность
- •Теплопроводность через плоскую однородную стенку.
- •Теплопроводность через многослойную стенку.
- •Удельный тепловой поток через многослойную стенку определяется по формуле:
- •Теплопроводность через цилиндрическую стенку
- •2.3 Конвективная теплоотдача
- •Теплоотдача при вынужденной конвекции
- •2.4 Излучение. Закон Стефана-Больцмана.
- •2..5 Сложный вид теплообмена теплопередача
- •Теплообменные аппараты:
- •Контрольные вопросы.
- •Тестовые задания для самостоятельной работы Понятие теплового потока, плотности теплового потока.
- •Теплопроводность в плоских одно- и многослойных стенках.
- •Теплопроводность в цилиндрических одно- и многослойных стенках.
- •Уравнение теплоотдачи.
- •Критерии подобия.
- •Теплообмен при свободной конвекции среды. Теплообмен при вынужденном движении среды в трубах.
- •Теплопередача через плоские одно- и многослойные стенки.
- •Теплопередача через многослойные стенки.
- •Назначение и классификация теплообменных аппаратов по способу передачи тепла.
- •Тепловой расчёт теплообменных аппаратов.
- •3. Теплоэнергетические установки.
- •3.1.Топливо и процессы его горения
- •Процесс горения топлива
- •3.2. Котельные установки.
- •3.3 Газотурбинные установки.
- •3.4 Турбореактивные двигатели.
- •3.5. Холодильные машины
- •3.6. Магнитогидродинамические генераторы
- •3.7. Тепловые электростанции (тэс)
- •3.8. Атомные электростанции Физические основы получения ядерной энергии
- •Ядерные реакторы
- •Контрольные вопросы.
- •4 Экологические вопросы энергетики
- •4.1 Тепловая энергетика.
- •4.2 Атомная энергетика.
- •4.3 Гидроэнергетика.
- •4.4 Антропогенное влияние на тепловой баланс Земли.
- •Контрольные вопросы.
- •Глава 1. Техническая термодинамика…………………………………….3
- •Глава 2. Основы теории теплообмена…………………………………...57
- •Глава 3. Теплоэнергетические установки……………………………….86
- •Глава 4. Экологические вопросы энергетики………………………….106
1.9 Первый закон термодинамики.
Первый закон термодинамики является частным случаем всеобщего закона сохранения энергии.
Теплота, подведенная к телу, расходуется на изменение внутренней энергии и на совершение работы против внешних сил.
![]() (1.45)
(1.45)
Для удельных величин уравнение (1.34) запишется в виде:
![]() (1.46)
(1.46)
Выражение (1.46) показывает, что без подвода и отвода тепла внешняя работа может совершаться только за счет изменения внутренней энергии системы .
Пользуясь выражением первого закона термодинамики, найдем формулу для вычисления изменения энтропии. По определению:
Согласно
первого закона термодинамики:
![]() где
где
![]() ,
,
![]()
Тогда
![]() (1.47)
(1.47)
![]()
![]() (1.48)
(1.48)
![]() (1.49)
(1.49)
Данное выражение применимо для всех видов термодинамических процессов, так как энтропия зависит только от параметров состояния и следовательно сама является параметром состояния.
1.10 Исследование термодинамических процессов с идеальным газом.
Порядок исследования термодинамических процессов.
Записывается уравнение процесса в P-V координатах.
Выводятся соотношения между параметрами состояния рабочего тела.
Определяются изменения внутренней энергии, энтальпии и энтропии.
Вычисляется работа деформации газа в процессе.
Вычисляется количество теплоты, участвующей в процессе.
Процесс изображается на pV диаграммах.
Обратимый изобарный процесс идеального газа.
1. При изобарном процессе давление остается постоянным : p=const
Для проведения обратимого процесса требуется множество источников теплоты разной температуры.
2.
Из уравнения состояния идеального газа
![]() при
p=const
находим:
при
p=const
находим: ![]() ,
(1.50)
,
(1.50)
Выражение (1.47) называется законом Гей-Люссака, в изобарном процессе объем газа меняется прямо пропорционально температуре.
3.
Изменение удельной внутренней энергии
определяется одинаково для всех
процессов, так как
![]() является параметром состояния рабочего
тела:
является параметром состояния рабочего
тела:
![]() (1.51)
(1.51)
Изменение энтальпии определяется выражением:
(1.52)
Изменение энтропии в изобарном процессе определяется из формулы (1.49):
![]() (1.53)
(1.53)
4. Удельная работа расширения или сжатия газа:
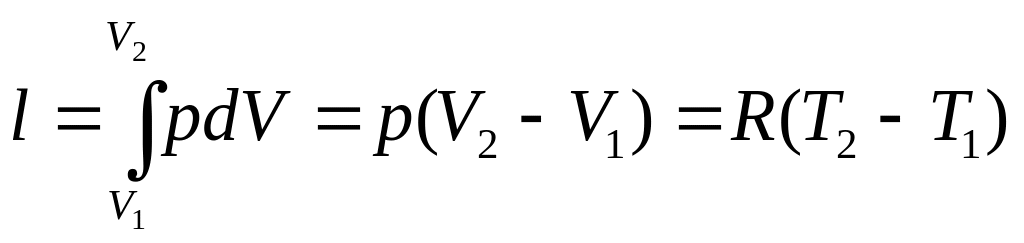 (1.54)
(1.54)
Для M кг газа:
L = M·p(V2-V1)= MR(T2 –T1 ) (1.55)
5.Определим удельное количество теплоты участвующее в процессе:
![]()
![]()
![]() (1.56)
(1.56)
Полная
теплота процесса:
![]() (1.57)
(1.57)
6.
Графически изобарный процесс в PV
координатах изображается горизонтальной
прямой (рис. 1.4): линия 1 – 2: изобарное
расширение рабочего тела (![]() ),
температура в процессе увеличивается,
теплота подводится dq
> 0, совершается положительная работа
),
температура в процессе увеличивается,
теплота подводится dq
> 0, совершается положительная работа
![]() .Линия 1-2
.Линия 1-2![]() :
изобарное сжатие (
:
изобарное сжатие (![]() ),
здесь температура уменьшается, тепло
отводится
),
здесь температура уменьшается, тепло
отводится
![]() ,
над системой совершается работа
,
над системой совершается работа
![]() .
.
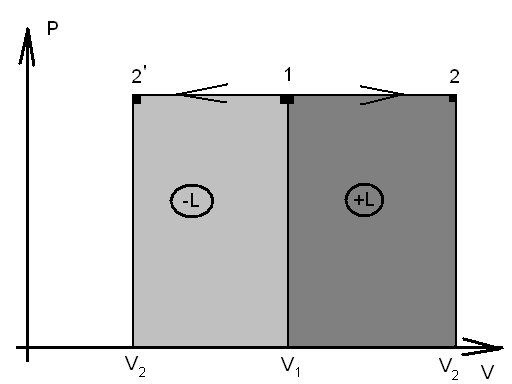
Рис. 1.4 - Процесс изменения состояния идеального газа при P = const на PV-диаграмме.
Обратимый изохорный процесс идеального газа.
1.
В данном процессе объем газа остается
постоянным:
![]() , а два других параметра изменяются:
, а два других параметра изменяются:
2.Выразим соотношение между параметрами из уравнения состояния идеального газа:
![]()
![]() (1.58)
(1.58)
Данное выражение называется Законом Шарля и определяет прямую пропорциональную зависимость между параметрами в изохорном процессе.
3.
![]() ,
,
![]()
![]()
![]() (1.59)
(1.59)
В изохорном процессе работа не совершается, так как dV=0
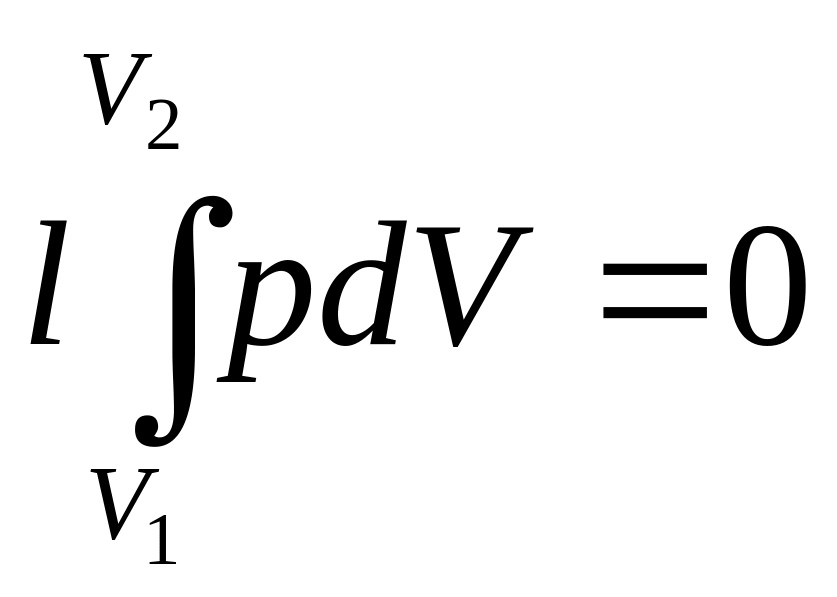 (1.60)
(1.60)
Согласно
пераого закона термодинамики (![]() ) поскольку
) поскольку
![]() , dq=
dU
(1.58)
, dq=
dU
(1.58)
т.е. подводимая или отводимая в процессе теплота идет только на изменение внутренней энергии рабочего тела.
5.
![]() (1.59)
(1.59)
![]() (1.60)
(1.60)
6.
График
процесса в координатах pV
изображается в виде вертикальной прямой
(рис. 1.5). Линия 1-2: при подводе теплоты
![]() увеличивается давление и температура:
увеличивается давление и температура:
![]()
![]() .
Линия 1-2
при отводе теплоты (
)
уменьшаются температура и давление
.
Линия 1-2
при отводе теплоты (
)
уменьшаются температура и давление![]()
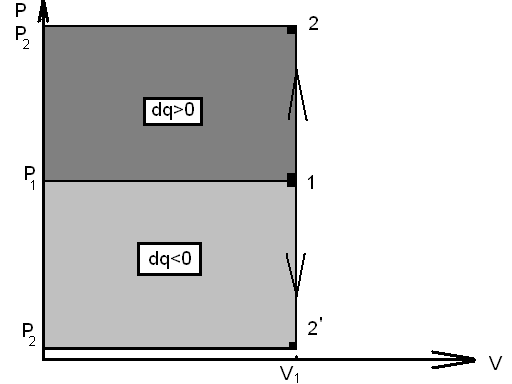
Рис. 1.5 - Процесс изменения состояния идеального газа при V=const на PV- диаграмме.
