
- •Определение числа клеток микроорганизмов высевом на питательные среды
- •3.1 Качественно-количественный учет микрофлоры почвы
- •Ход выполнения работы
- •Количественный учет бактерий в пробах воды. Определение титра и индекса кишечной палочки.
- •Ход выполнения работы
- •Определение бактериальной обсемененности воздуха
- •Ход выполнения работы

Методическое указание к лабораторной работе № 1
по дисциплине Пищевая микробиология
для студентов 2 курса
направления 260100, 260800
Лабораторная работа 3 МЕТОДЫ АНАЛИЗА МИКРОФЛОРЫ ОКРУЖАЮЩЕЙ СРЕДЫ
Определение числа клеток микроорганизмов высевом на питательные среды
В отличие от подсчета микроорганизмов под микроскопом этот метод дает возможность определить только число жизнеспособных клеток в популяции. Поскольку сред, пригодных для роста всех микроорганизмов, не существует, метод высева дает возможность определить число микроорганизмов, способных расти на среде данного состава, но не позволяет учесть те микроорганизмы, которые не растут или растут крайне медленно. Это важно помнить при анализе таких естественных субстратов, как почва, вода и т.п.
О пределение
количества клеток высевом на плотные
питательные среды (чашечный метод Коха).
Метод широко применяют
для определения численности жизнеспособных
клеток в различных
естественных
субстратах и в лабораторных культурах.
В
его основе лежит принцип Коха, согласно
которому каждая колония
является потомством одной клетки. Это
позволяет на основании
числа
колоний, выросших после посева на плотную
питательную
среду
определенного объема исследуемой
суспензии, судить
об исходном содержании в ней клеток
микроорганизмов.
Результаты
количественного учета микроорганизмов,
проведенного
методом Коха, часто выражают не в числе
клеток, а в условных
единицах - так называемых колониеобразующих
единицах (КОЕ).
Определение
числа микроорганизмов этим методом
включает три этапа:
приготовление разведений, посев на
плотную среду в чашки
Петри и подсчет выросших колоний.
пределение
количества клеток высевом на плотные
питательные среды (чашечный метод Коха).
Метод широко применяют
для определения численности жизнеспособных
клеток в различных
естественных
субстратах и в лабораторных культурах.
В
его основе лежит принцип Коха, согласно
которому каждая колония
является потомством одной клетки. Это
позволяет на основании
числа
колоний, выросших после посева на плотную
питательную
среду
определенного объема исследуемой
суспензии, судить
об исходном содержании в ней клеток
микроорганизмов.
Результаты
количественного учета микроорганизмов,
проведенного
методом Коха, часто выражают не в числе
клеток, а в условных
единицах - так называемых колониеобразующих
единицах (КОЕ).
Определение
числа микроорганизмов этим методом
включает три этапа:
приготовление разведений, посев на
плотную среду в чашки
Петри и подсчет выросших колоний.
Приготовление разведений. Численность популяции микроорганизмов обычно велика, поэтому для получения изолированных колоний необходимо приготовить ряд последовательных разведений. Разведения готовят в стерильной водопроводной воде или 0,85%-ном растворе NaCl (физрастворе). В ходе опыта целесообразно использовать один и тот же коэффициент разведения, например 10, что уменьшает вероятность ошибки.
Для приготовления разведений стерильную водопроводную воду разливают по 9 мл в стерильные сухие пробирки. Затем 1мл исследуемой суспензии стерильной пипеткой переносят в пробирку с 9 мл стерильной воды - это 1-е разведение, 10-1.
Полученное разведение тщательно перемешивают новой стерильной пипеткой, вбирая в пипетку и выпуская из нее полученную взвесь. Эту процедуру выполняют 3-5 раз, затем той же пипеткой отбирают 1 мл полученной суспензии и переносят во 2-ю пробирку, получают 2-е разведение (10-2). Таким же образом готовят и последующие разведения. Степень разведения зависит от плотности исследуемой популяции микроорганизмов; соответственно она тем больше, чем больше плотность популяции. Для приготовления каждого разведения следует обязательно использовать новую пипетку. Пренебрежение этим правилом приводит к получению ошибочного результата.
Посев. Высевать суспензию можно поверхностным или глубинным способом. Перед посевом поверхностным способом (рис. 4) разливают расплавленную, чаще всего агаризованную, питательную среду в ряд стерильных чашек Петри по 15-20 мл в каждую. Чашки оставляют на горизонтальной поверхности, пока среда не застынет. Поверхность агаризованных сред перед посевом рекомендуется подсушивать для удаления конденсационной воды. Среду можно подсушить, поместив чашки в термостат на 2-3 суток крышками вниз.
После того как среда готова, на ее поверхность стерильной пипеткой наносят точно измеренный объем (0,05 или 0,1 мл) соответствующего разведения и распределяют его стерильным стеклянным шпателем по поверхности среды. Высевы на плотную среду проводят, как правило, из трех последних разведений, причем из каждого делают 2-4 параллельных высева. Посевы можно делать одной пипеткой, но при этом начинать следует обязательно с большего разведения. Для каждого разведения используют новый стерильный шпатель. После посева чашки Петри помещают в термостат крышками вниз.
При глубинном посеве точно измеренный объем (как правило 0,1; 0,5 или 1,0 мл) исходной суспензии или разведения вносят в расплавленную и остуженную до (48-50)°С агаризованную среду, тщательно перемешивают и затем немедленно выливают в чашку Петри. Среде дают застыть. В случае глубинного посева пользуются средой, разлитой в пробирки. При больших масштабах работы среду по пробиркам не разливают, а поступают следующих образом.
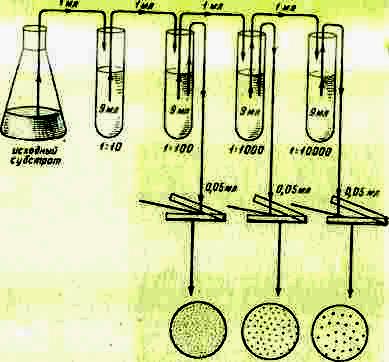
Рис 4. Схема приготовления разведений и рассева суспензии
микроорганизмов шпателем
По 1 мл из соответствующего разведения переносят стерильной пипеткой в 2-4 стерильные чашки Петри. Затем заливают чашки 15-20 мл расплавленной и остуженной до (48-50)°С плотной средой и тщательно смешивают питательную среду с посевным материалом легким вращательным движением чашки по поверхности стола, после чего чашки оставляют на горизонтальной поверхности до застывания. Когда среда застынет, чашки Петри в перевернутом виде помещают в термостат.
Для определения количества клеток анаэробных микроорганизмов чашки Петри с плотной средой после посева помещают в анаэростаты. Иногда для определения численности анаэробов плотную среду после засева оставляют в пробирках. Поверхность застывшей среды заливают парафином. Для лучшего рассмотрения колонии микроорганизмов диагностические среды рекомендуется осветлять.
Подсчет выросших колоний. Колонии микроорганизмов в зависимости от скорости роста подсчитывают через 2-15 суток инкубации. Подсчет, как правило, проводят, не открывая чашек Петри. Для удобства каждую посчитанную колонию отмечают точкой на наружной стороне дна чашки. При большом количестве колоний дно чашки Петри делят на секторы, просчитывают колонии в каждом секторе и суммируют результаты. Иногда для подсчета колоний используют специальные полуавтоматические счетчики.
Лучшим разведением следует считать, когда при высеве в чашке Петри вырастает от 30-50 до 100-150 колоний. Если число выросших колоний оказалось меньше 10, то эти результаты для расчета количества клеток в исходном материале не используют. Результаты параллельных высевов из одного и того же разведения суммируют и определяют среднее число колоний, выросшее при высеве из разведения на одной чашке. Количество клеток в 1 мл исследуемого субстрата вычисляют по формуле:
, (1)
где М - количество клеток в 1 мл; а - среднее число колоний при высеве разведения, из которого сделан высев; V — объем суспензии, взятый для посева, в мл; 10n — коэффициент разведений.
Определение количества клеток высевом в жидкие среды (метод предельных разведений). Метод используют для подсчета микроорганизмов, которые плохо или совсем не растут на плотных питательных средах. В пробирки с жидкой средой вносят строго измеренный объем из различных разведений исследуемого субстрата. После инкубации, исходя из числа пробирок, в которых наблюдался или отсутствовал рост, рассчитывают наиболее вероятное число клеток, содержащихся в 1 мл исследуемого субстрата.
Таким образом, определение количества микроорганизмов методом предельных разведений включает приготовление разведений, посев в жидкую среду, регистрацию наличия или отсутствия роста после инкубации и расчет наиболее вероятного числа клеток в единице объема исходного субстрата. Разведения исходной суспензии готовят, как и для чашечного метода.
Посев и регистрация результатов. Стерильную среду предварительно разливают в пробирки (колбы) и стерилизуют. В пробирки (колбы) следует наливать одинаковый объем среды. Посев проводят из каждого разведения или из 4-5 последних, причем каждое разведение высевают в 3-5 повторностях (параллельных пробирках). Количество посевного материала везде одинаково и, как правило, составляет 1 мл. Засеянные пробирки помещают в термостат. Время инкубации колеблется от 2 до 15 суток и зависит от скорости роста микроорганизмов, численность которых определяют.
