
- •Тема: «Химия металлов» Технологическая карта комплекса
- •План лекции
- •Особенности электронного строения металлов.
- •Положение металлов в псхэ.
- •Закономерности в изменении свойств элементов – металлов.
- •Металлическая химическая связь. Кристаллические решетки.
- •Физические свойства металлов
- •Х имические свойства металлов.
- •Способы получения металлов
- •Закрепление знаний Контрольные вопросы
- •Задания и задачи
- •1. Написать уравнения реакций взаимодействия между веществами:
- •2. Расставить коэффициенты, найти окислитель и восстановитель в уравнениях реакций:
- •Химический диктант
- •Тест по теме «Общая характеристика металлов. Электрохимический ряд напряжений»
- •Ключ к тесту
- •Это интересно!
- •1.В начале был век медный.
- •II. Далее идёт век бронзовый.
- •III. Далее идет железный век.
- •Карточки задания для индивидуальной работы
- •Химические свойства
- •Характеристика элементов главной подгруппы II группы.
- •Химические свойства
- •Взаимодействие с простыми веществами.
- •Взаимодействуют с водой.
- •Взаимодействие с кислотами.
- •Взаимодействие с щелочами.
- •Характеристика элементов главной подгруппы III группы. Алюминий.
- •Строение атомов металлов изученных групп
- •Общие химические свойства
- •Закрепление и проверка знаний Контрольные вопросы
- •Упражнения и задачи для закрепления и проверки знаний
- •Железо.
- •Марганец
- •Химические свойства
- •Взаимодействие с неметаллами
- •Взаимодействие с водой
- •Взаимодействие с кислотами
- •Восстановление металлов из оксидов
- •Понятие о сплавах.
- •Задания для закрепления и проверки знаний Контрольные вопросы:
- •Характеристика элемента-металла на примере
- •Тест по теме «Металлы» Вариант 1
- •Вариант 2
- •Тест по теме «Металлы» Вариант 3
- •Вариант 4
- •Тест Вариант 1
- •Вариант 2
- •I уровень
- •II уровень
- •Контрольные вопросы, задания и тест для отработки нб по теме: «Химия металлов»
- •Тест «Химия металлов» Часть а (задания с выбором ответа)
- •Часть в (задания с кратким ответом)
- •Игровые задания Загадки о металлах
- •«Химические перевертыши»
- •Викторина по теме «Металлы»
- •Ответы на вопросы викторины
- •Определите металл
Закрепление и проверка знаний Контрольные вопросы
Перечислите щелочные металлы. Почему они так называются?
Каковы особенности строения атомов щелочных металлов?
Какова степень окисления щелочного металла в соединении? Почему?
Каковы физические свойства щелочных металлов?
Какой из щелочных металлов наиболее активен и почему?
Какие реакции характерны для щелочных металлов?
Какие оксиды и пероксиды получаются при окислении щелочных металлов?
Как окрашивают пламя атомы и ионы щелочных металлов?
Какие химические связи образуют щелочные металлы с неметаллами?
Как можно получить щелочные металлы?
Где применяются щелочные металлы?
Какие элементы образуют щелочноземельных металлов?
Где в периодической системе расположены эти элементы?
Каковы особенности строения атомов этих металлов?
Какая степень окисления характерна щелочно-емельных элементов в соединениях?
Каковы физические свойства кальция, магния?
Как нужно хранить эти металлы?
Как можно получить эти металлы?
Перечислите реакции, характерные для этих металлов.
Каково строение атома алюминия?
Какова степень окисления алюминия в соединениях? Почему?
Назовите важнейшие природные соединения алюминия.
Каковы физические свойства алюминия?
Как ведет себя алюминий в химических реакциях? Почему?
С какими кислотами алюминий не взаимодействует?
Как алюминий взаимодействует с щелочами?
Какие металлы алюминий может восстановить из солей или оксидов?
Какие реакции доказывают амфотерность оксида и гидроксида алюминия?
Что происходит с гидроксидом алюминия при нагревании?
Упражнения и задачи для закрепления и проверки знаний
С какими из перечисленных веществ будет реагировать гидроксид натрия: с соляной кислотой, оксидом магния, оксидом углерода (IV), гидроксидом цинка, гидроксидом кальция? Приведите уравнения реакций.
С какими из перечисленных ниже растворов будет реагировать металлический кальций: HNO3, KOH, FeSO4, HBr ? Напишите уравнения происходящих реакций.
Задача: При обработке 8г смеси магния и оксида магния соляной кислотой выделилось 5,6 л водорода(н.у.). Какова массовая доля (в %) магния в исходной смеси?
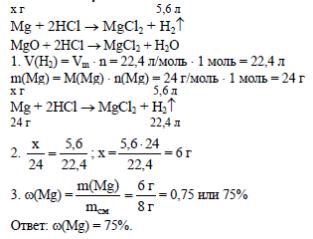
Задача: Калий массой 3,9 г растворили в воде массой 206,2 г. Определите массовую долю полученного раствора.
Задача: Металл массой 0,86 г при реакции с водой вытесняет газ объёмом 246,4 мл (н.у.). Какой это металл?
Задача: Порошок магния массой 40 г поместили в 596 г раствора сульфата цинка. Затем порошок отфильтровали и высушили. Его масса увеличилась на 16 г. Определить состав конечного раствора (массовую долю сульфата магния).
Дано:
m0(Mg) = 40 г,
m(р-ра ZnSO4) = 596 г,
![]() m
= 16
г.
m
= 16
г.
Найти:
![]() (MgSO4).
(MgSO4).
Решение: ZnSO4 + Mg = MgSO4 + Zn.
Изменение массы порошка в смеси: m = m(Zn) + m(Mg).
Пусть
![]() (Zn)
=
(Mg)
= х
моль, тогда
m
=
65х
– 24х
= 16 г.
(Zn)
=
(Mg)
= х
моль, тогда
m
=
65х
– 24х
= 16 г.
Отсюда х = 0,39 моль. Массовая доля сульфата магния в конечном растворе:
(MgSO4) = m(MgSO4)/m1(р-ра) = 0,39•120/(596 – 16) = 0,0807, или 8,07%.
Ответ. (MgSO4) = 8,07%.
Напишите уравнения реакций, соответствующие цепочкам превращения:


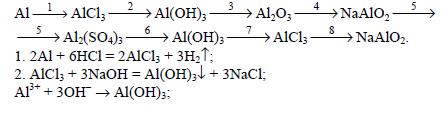

Тест "Металлы" |
1.Исключите лишний элемент: 1)Na; 2)Mg; 3)Al; 4)Si. |
2.Какая из перечисленных групп элементов содержит только металлы: 1)Li, Be, B; 2)K, Ca, Sr; 3)H, Li, Na; 4) Se, Te, Po . |
3) Металлами являются : 1)все s-элементы ; 2) все p-элементы ; 3) все d-элементы ; 4) все элементы главных подгрупп . |
4.Какое свойство не является общим для всех металлов: 1)электропроводность; 2)теплопроводность; 3)твёрдое агрегатное состояние при стандартных условиях ; 4)металлический блеск. |
|
|
5) Верны ли следующие суждения о щелочных металлах? А. Во всех соединениях они имют степень окисления +1. Б.С галогенами они образуют соедининия с ионной связью. 1)верно только А; 2)верно только Б; 3)верны оба суждения; 4)оба суждения неверны. |
6)Хлорид железа(II) не может быть получен взаимодействием: 1)раствора хлорида меди(II) с железом; 2)железа с хлором; 3)железа с соляной кислотой; 4)хлорида железа(III) с железом. |
7)Какой из оксидов является кислотным: 1)MnO; 2)Mn2O3; 3)MnO2; 4)Mn2O7. |
8)К реакциям горения не относится: 1)взаимодействие железа с кислородом; 2)взаимодействие ртути с серой; 3)взаимодействие железа с хлором; 4)взаимодействие железа с серой. |
9)Какое из природных веществ можно назвать рудой: 1)известняк; 2)песок; 3)мрамор; 4)магнитный железняк. |
10)Исключите лишний элемент в ряду: 1) Si ; 2) C ; 3) B; 4) Be . |
11) Какая из следующих групп в Периодической системе содержит только неметаллы : 1VIIA; 2)VIA; 3)VA; 4)IVA. |
12)Выберите верное утверждение: "Все простые вещества неметаллы: 1)газообразны; 2)диэлектрики; 3)не имеют металлического блеска; 4)не имеют общих физических свойств . |
Занятие №3
Металлы побочных подгрупп (переходные металлы). Свойства химических элементов. Характеристика важнейших соединений хрома, марганца, железа. Важнейшие сплавы железа: чугун, сталь.
Общий обзор металлических элементов побочных подгрупп.
Металлические элементы побочных подгрупп являются d – элементами. У их атомов на наружном энергетическом уровне сохраняются s – электроны, а очередные электроны помещаются не на наружных, а на предпоследних энергетических уровнях.
В образовании связей у металлов побочных подгрупп, кроме ns – электронов наружного слоя, принимают участие (n – 1) d – электроны. Причём s – электроны легче образуют связи и наличие d – электронов незначительно влияет на свойства.
Более устойчивыми являются состояния d0, d5, d10.
Например, у хрома и меди происходит «провал» электрона с наружного слоя на d – подуровень.
d – элементы проявляют широкий спектр валентных возможностей. Минимальная степень окисления у этих элементов в соединениях соответствует количеству s – электронов на внешнем слое, а максимальная соответствует числу номера группы.
Например, марганец образует оксиды, в которых степень окисления :
+2 МnO, +4 MnO2, +6 MnO3, +7 Mn2O7.
! При этом важно запомнить правило: с увеличением степени окисления атомов металлов побочных подгрупп основные свойства их оксидов и гидроксидов уменьшаются, а кислотные усиливаются.
