
Тема третья фотосинтез
Важно подчеркнуть космическую роль зеленых растений, глобальный характер фотосинтеза и громадную геохимическую работу, которую они осуществляют. Суть фотосинтеза состоит в трансформации энергии квантов в энергию химических связей образующихся при этом органических веществ. Фотосинтезу принадлежит центральная роль в общей энергетике живых существ. Именно растения являются первичными продуцентами, используя космическую энергию термоядерных процессов (поток квантов определенной величины), протекающих на Солнце. Для осуществления этого уникального процесса в растениях в процессе эволюции возник синтетический аппарат, содержащий: 1) набор фотоактивных пигментов, поглощающий электромагнитное излучение и запасающий эту энергию в виде электронного возбуждения, и 2) аппарат преобразования этой энергии в различные формы химической энергии. Прежде всего, это редокс-энергия, связанная с образованием высоко восстановленных соединений, энергия электрохимического потенциала (∆μН+), возникающая из протонного градиента на сопрягающей мембране тилакоида, энергия фосфатных связей АТФ и других макроэргов, которая далее преобразуется в свободную энергию молекул органических веществ, образующихся при фотосинтезе.
Поглощение света и преобразование его энергии в форме НАДФН2 и АТФ составляют световую реакцию фотосинтеза. Дальнейшие процессы связанные фиксацией СО2 и синтезом органических соединений при использовании продуктов световой стадии составляют стадию углеродных циклов фотосинтеза (метаболизм углерода при фотосинтезе). Ранее эта фаза ассимиляции углерода называлась темновой стадией фотосинтеза, однако в последнее время доказано, что для ее прохождения также необходим свет.
Фиксация СО2 и включение углерода в органические соединения у разных групп растений может происходить по-разному. В соответствии с механизмом первичной фиксации СО2 и природой первых стабильных продуктов, образующихся при этом, различают С3-путь, С4-путь фотосинтеза, а также фотосинтез по типу толстянковых (САМ-фотосинтез, от Crassulaceae acid metabolism). Но в конечном счете восстановление углерода СО2 до уровня углеводов практически у всех видов фотосинтезирующих организмов происходит по единому пути по так называемому восстановительному пентозофосфатному циклу (ВПФ цикл или цикл Кальвина).
Работа 13. Извлечение пигментов
ХОД РАБОТЫ
1. Навеску свежих листьев переносят в фарфоровую ступку и растирают с небольшим количеством этилового спирта либо ацетона (5-10 мл), прибавив предварительно на кончике ножа СаСО3 либо MgCO2 (для нейтрализации кислот клеточного сока) и чистый кварцевый песок (для лучшего растирания). Носик ступки с наружной стороны смазывают вазелином. После небольшого отстаивания зеленый раствор осторожно (чтобы не потерять ни капли) по палочке сливают в воронку со стеклянным пористым фильтром. С помощью масляного или водоструйного насоса фильтруют вытяжку в колбу Бунзена. Оставшуюся в ступке густую массу снова растирают со спиртом или ацетоном. После отстаивания жидкость переносят на фильтр. Эту операцию повторяют несколько раз, пока раствор, стекающий из воронки, не будет бесцветен.
2. Удобно извлекать хлорофилл из правильно высушенных листьев растений (в тени). Их необходимо хорошо измельчить, убрать крупные жилки и растереть в мелкий порошок в фарфоровой ступке, многократно заливая небольшими порциями спирта или ацетона, и отфильтровать до обесцвечивания осадка на фильтре. Полученный раствор содержит следующие пигменты.
Зеленые: хлорофилл "a"
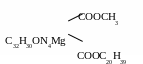
х
СООСН3
C32H28ON4Mg
COOC20H39 лорофилл
"b"
лорофилл
"b"

Желтые: каротины c эмпирической формулой C40H56 – непредельные углеводороды.
Оранжевые: ксантофиллы с эмпирической формулой C40H56O2 – непредельные спирты.
Хранят вытяжки пигментов непродолжительное время в холодильнике и полной темноте (либо закрытыми светонепроницаемой бумагой).
МАТЕРИАЛЫ И ОБОРУДОВАНИЕ
1) фарфоровые ступки; 2) этиловый спирт; 3) ацетон; 4) кварцевый песок; 5) СаСО3; 6) вазелин; 7) воронки; 8) колбы; 9) высушенные листья крапивы или других растений.
Работа 14. Получение вытяжки каротина
ХОД РАБОТЫ
Свеженарубленный корнеплод моркови поместить в банку, залить бензином или петролейным эфиром, и герметично закрыв, дать настояться в течение 24-18 часов, затем желто-оранжевую вытяжку слить. С полученными вытяжками производят ряд последующих опытов. Хранят вытяжки в светонепроницаемых сосудах.
МАТЕРИАЛЫ И ОБОРУДОВАНИЕ
1) корнеплод моркови; 2) бензин или петролейный эфир; 3) колба.
Работа 15. Флюоресценция хлорофилла
Способность хлорофилла флюоресцировать является важным признаком свидетельствующим о фотохимической активности пигмента. Флюоресценция - явление кратковременного послесвечения при поглощении хлорофиллом света. Вызвано оно переходом возбужденной молекулы (растрачиванием энергии или дезактивацией) из S1-состояния (синглетного) в основное (S0) состояние, это и сопровождается излучением поглощенной энергии в виде квантов флюоресценции. При этом излучаемый свет имеет большую длину волны, чем поглощаемый. Для хлорофилла характерна красная флюоресценция, поскольку луч, вызвавший флюоресценцию всегда больше по энергии (короче по длине волны).
ХОД РАБОТЫ
Вытяжку пигментов помещают на черном фоне у окна при ярком солнечном освещении или освещают сине-фиолетовым светом в области коротковолнового максимума хлорофилла. Вишнево-красный цвет вытяжки в отраженном свете свидетельствует о способности хлорофилла флюоресцировать, что является признаком фотохимической активности вещества. Явление флюоресценции можно наблюдать и на живых растениях.
Удобными объектами для этих целей являются водоросли, водяной мох, элодея и другие растения.
Растительный объект помещают на предметное стекло микроскопа и освещают его сине-фиолетовыми лучами. Для этого между осветителем и зеркалом микроскопа помещают синее стекло. Под влиянием этого облучения содержащие хлорофилл пластиды начинают светиться красным светом.
МАТЕРИАЛЫ И ОБОРУДОВАНИЕ
1) концентрированная спиртовая или ацетоновая вытяжка; 2) элодея; 3) все для микроскопирования; 4) осветитель; 5) синее стекло.
Работа 16. Изучение спектров поглощения вытяжки пигментов
ХОД РАБОТЫ
Для пигментов зеленых листьев характерно избирательное поглощение отдельных лучей спектра. Чтобы определить, какие лучи поглощает хлорофилл, используют спектроскоп. Помещая на пути света, дающего сплошной спектр, раствор, окрашенного вещества, обнаруживаем на фоне спектра темные полосы или отдельные линии, которые соответствуют участкам света, поглощенным раствором.
Для начала работы со спектроскопом устанавливают источник света и регулируют ширину щели на коллиматорной трубе. Щель должна быть не очень широкой, но и не очень узкой. В первом случае спектр получается яркий, но размытый; во втором - спектр мало освещен.
При работе со спектроскопом, где имеется шкала для измерения длин волн лучей, изменением положения зеркальца добиваются, чтобы шкала накладывалась на спектр, а деления и цифры были отчетливо видны через зрительную трубу. Вдвиганием и выдвиганием окуляра достигают ясного изображения спектра и проектируемого на нем изображения шкалы.
Установив спектроскоп, приступают к определению спектра поглощения пигментов. Для этого перед щелью спектроскопа помещают пробирку (лучше бюкс с плоскопараллельными стенками) с раствором пигментов. Пробирку укрепляют в лапке штатива. Зарисовывают спектр и отмечают положение темных полос в спектре. Эти полосы соответствуют участкам спектра, которые поглощаются данным раствором.
МАТЕРИАЛЫ И ОБОРУДОВАНИЕ
1) штатив с пробирками с вытяжками пигментов разной концентрации; 2) спектроскоп.
Работа 17. Разделение пигментов по Краусу
Метод основан на различной растворимости пигментов в спирте или бензине. Сродство пигментов к полярным (спирт, ацетон) и неполярным (бензин) растворителям определятся степенью их полярности. Ксантофиллы (непредельные спирты), содержащие две или более полярных ОН-групп, хорошо растворимы в спирте, в то время как каротин (непредельный углеводород), не имеющий полярных групп, отличается более высоким сродством к бензину. Фитольный остаток в молекуле хлорофилла представляет ее гидрофобную часть и обусловливает возможность взаимодействия молекулы пигмента с бензином. Удаление фитола при омылении хлорофилла (следующая лабораторная работа № 18) увеличивает сродство пигмента к полярным растворителям. Поэтому зеленый пигмент перемещается в нижний слой с полярным растворителем (спиртом).
ХОД РАБОТЫ
В пробирку наливают 2-3 мл спиртовой вытяжки, прибавляют примерно полуторный объем бензина и несколько капель воды, для того, чтобы спирт не смешивался с бензином. Пробирку закрывают и несколько раз сильно встряхивают, а затем дают 2-3 минуты постоять. При этом происходит разделение слоев: верхний слой (бензиновый) содержит оба зеленых пигмента и каротин, а нижний желтый слой (спиртовой) содержит ксантофилл. Определяют спектр поглощения ксантофилла. Показателем чистоты отделения ксантофилла от зеленых пигментов является отсутствие полосы поглощения в красной области спектра.
МАТЕРИАЛЫ И ОБОРУДОВАНИЕ
1) пробирки; 2) бензин; 3) спиртовая вытяжка пигментов; 4) спектроскоп.
Работа 18. Омыление хлорофилла и отделение каротина
ХОД РАБОТЫ
В пробирку с 2-3 мл вытяжки пигментов прибавляют несколько капель 20%-ного спиртового раствора щелочи. Наливают 2 капли дистиллированной воды и 1-1,5 мл бензина. Сильно встряхивают, а затем дают отстояться. Нижний спиртовой слой содержит соль хлорофиллиновой кислоты (продукт омыления хлорофилла) и ксантофилл, верхний бензиновый слой - каротин. Определяют спектр поглощения каротина.
Можно произвести омыление и сразу после разделения слоев по Краусу. Прибавляют в ту же пробирку кусочек едкого калия, либо раствора щелочи, встряхивают и наблюдают быстрое перемещение бесфитольного хлорофилла из верхней фазы (бензин) в нижнюю (спирт). Этот опыт наглядно подтверждает гидрофильные свойства порфириновой части молекулы хлорофилла.
Реакция хлорофилла со щелочью идет следующим образом:
 COOH3
COONa
COOH3
COONa
C 32H30ON4Mg
+ NaOH = CH3OH
+ C20H39OH+
C32H30ON4Mg
32H30ON4Mg
+ NaOH = CH3OH
+ C20H39OH+
C32H30ON4Mg
COOC20H39 COONa
МАТЕРИАЛЫ И ОБОРУДОВАНИЕ
1) пробирка; 2) бензин; 3) 20%-ный раствор щелочи; 4) спектроскоп
Работа 19. Получение феофитина и восстановление металлоорганической связи
ХОД РАБОТЫ
В пробирку наливают 2-3 мл спиртовой вытяжки и добавляют 1-2 капли 10%-ной соляной кислоты. При взбалтывании вытяжка становится бурой вследствие образования производного хлорофилла - феофитина (входящий в состав хлорофилла атом магния замещается водородом). Реакция протекает по следующему уравнению:
COOH3 COONa
C32H30ON4Mg + 2HCl = C32H30ON4H2 + MgCl2
COOC20H39 COONa
Попытка ввести снова в молекулу пигмента магний не удается, но если к побуревшей вытяжке прибавить несколько кристалликов уксусно-кислого цинка или меди и осторожно нагреть на водяной бане, то можно наблюдать появление зеленой окраски благодаря восстановлению металлорганической связи.
МАТЕРИАЛЫ И ОБОРУДОВАНИЕ
1) пробирка; 2) 10%-ный раствор HCl; 3) уксуснокислый цинк или медь; 4) водяная баня.
Работа 20. Быстрый способ качественного разделения пигментов
Предлагаемый простой метод позволяет частично разделить на бумаге пигменты пластид.
ХОД РАБОТЫ
1. Приготовляют концентрированную ацетоновую вытяжку из свежих листьев любых растений. Навеска растительного материала должна составлять 2-3 г, объем ацетонового экстракта - 25 мл (100%-ный ацетон).
2. Из хроматографической бумаги вырезают полоску шириной 1,5-2,0 см, длиной 20 см. Держа бумажную полоску вертикально, кончик ее опускают на несколько секунд в вытяжку пигментов, налитую в бюкс. Затем бумагу высушивают в токе воздуха и погружают в раствор пигментов. Эту операцию повторяют несколько раз до тех пор, пока не произойдет насыщение старта и не образуется яркая зеленая полоска. После этого нижний конец на несколько секунд опускают в чистый ацетон, чтобы все пигменты приподнялись. Таким образом, низ хроматографической бумаги становится чистым (до 0,5 см), а выше сконцентрирована смесь пигментов (старт), которая должна быть разделена.
3. Хорошо высушив полоску бумаги в токе воздуха (до исчезновения запаха ацетона), помещают ее в строго вертикальном положении в цилиндр, на дно которого налит петролейный эфир или бензин с точкой кипения 80-120°С так, чтобы растворитель не касался зоны пигментов. Цилиндр герметично закрывают хорошо подобранной пробкой. Через 5-15 минут растворитель поднимается на 10-12 см. Смесь пигментов при этом разделяется на отдельные компоненты в виде разноцветных полос, которые располагаются в следующем порядке: снизу хлорофилл b, над ним хлорофилл а, далее ксантофилл, затем серовато-серебристый феофитин. Каротин, будучи непредельным углеводородом, продвигается вместе с фронтом растворителя быстрее других компонентов, и его оранжевая зона на бумаге располагается выше всех других пигментов.
МАТЕРИАЛЫ И ОБОРУДОВАНИЕ
1) ацетон; 2) фильтровальная бумага; 3) бюксы; 4) цилиндры с пробками; 5) бензин или петролейный эфир.
Работа 21. Зависимость ассимиляции углекислого газа от интенсивности света
Из методов исследования процессов ассимиляции наиболее простым и приемлемым является метод счета пузырьков. За некоторое время до начала опыта по фотосинтезу с элодеей необходимо проверить ее работоспособность. Для этого следует хорошо отмыть элодею взятую из аквариума или, что лучше, из естественного водоема и в течение нескольких минут выдержать ее на ярком свету наблюдая за выделением кислорода. Затем поместить в темноту, подготавливая к предстоящим исследованиям.
Метод счета пузырьков состоит в следующем: побег водного растения (элодея) длиной 3-4 см с неповрежденной почкой помещают в узкий цилиндр с водой срезанным концом вверх. Воду берут из водопровода и обогащают углекислотой (перед погружением побега бросить в воду немного двууглекислой соды NaHCO3 и разболтать). Чтобы побег не всплывал, его привязывают тонкой ниткой к стеклянной палочке. Уровень воды в цилиндре должен быть выше побега на 2-3 см; перед началом опыта верхний срезанный конец еще раз подрезается под водой острые ланцетом.
Выставляя подготовленную таким образом веточку на свет, можно заметить через 2-3 минуты выделение пузырьков газа из срезанного конца. Быстрота выделения пузырьков будет меняться в зависимости от различных условий: от силы и качества света температуры и т.п. Выделение газа из надрезанных водных растений можно объяснить так: кислород, образующийся в процессе фотосинтеза в равном объеме с поглощенным углекислым газом диффундирует в окружающую растение воду значительно медленнее, чем поступает углекислота, и потому скапливается в межклетниках. При срезании стебля избыток газа начинает выделяться в виде непрерывного потока пузырьков, быстрота образования которых зависит от энергии процесса ассимиляции.
ХОД РАБОТЫ
Опыт проводится без постороннего освещения. При изучении влияния силы света на процесс ассимиляции помещают одну и ту же веточку на различном расстоянии от источника света (берется обычно электролампа мощностью 200-300 вт) и сравнивают количество выделенных пузырьков за один и тот же промежуток времени (за 1 минуту). Интенсивность светового потока изменяют ручкой регулятора напряжения (латером). Удобней проводить эксперимент с помощью электротрансформатора, тогда нет необходимости менять расстояние до элодеи, просто можно выбрать, например, четыре позиции напряжения и считать количество выделенных пузырьков. Составить и зарисовать графики скорости фотосинтеза.
МАТЕРИАЛЫ И ОБОРУДОВАНИЕ
1) элодея; 2) сода двууглекислая; 3) скальпель или ланцет; 4) часы; 5) цилиндр простой; 6) мягкая нитка; 7) стеклянная палочка; 8) электрическая лампа (200-300 Вт).
Работа 22. Влияние различных лучей спектра на процесс ассимиляции углерода
ХОД РАБОТЫ
Чтобы показать, в каких лучах спектра процесс ассимиляции идет энергичнее, цилиндр с веточкой помещают на расстояние 50 см от источника света и на пути ставят экраны различной окраски. Такими экранами могут послужить: 1%-ный раствор двухромовокислого калия, который поглощает сине-фиолетовую часть спектра и пропускает красную; 4%-ный раствор серноаммиачной соли (раствор медного купороса насыщается аммиаком до сине-фиолетовой окраски), поглощающий красную половину спектра и пропускающий сине-фиолетовую. Экраны чередуют. Сравнивая количество пузырьков, оделенных за 1 минуту, определяют, в каких лучах спектра процесс идет энергичнее. Прежде чем произвести отсчет количества пузырьков, выделенных за 1 минуту, при том или ином экране, выжидают, чтобы установился равномерный ток пузырьков. Затем производят отсчет.
МАТЕРИАЛЫ И ОБОРУДОВАНИЕ
1) то же, что и для работы 21; 2) 1%-ный раствор двухромовокислого калия; 3) 4%-ный раствор медного купороса, насыщенного аммиаком.
Работа 23. Влияние температуры на процесс ассимиляции
ХОД РАБОТЫ
При исследовании влияния температуры на процесс ассимиляции применяют ту же методику, что и в работе 22, при этом вместо цветных растворов используют воду различной температуры. Наблюдения производят на таком же расстоянии от источника света. Порядок наблюдения: комнатная температура (18°С), низкая (4°С), опять комнатная температура (18°С).
Сравнивая количество пузырьков, выделенных за 1 минуту, определяют, при какой температуре ассимиляция идет быстрее.
МАТЕРИАЛЫ И ОБОРУДОВАНИЕ
1) то же, что и для работы 22; 2) термометр.
Работа 24. Образование крахмала на свету
Принцип метода заключается в том, что крахмал, который накапливается в процессе фотосинтеза, обнаруживается раствором йода в йодистом калии. Крахмал состоит из двух компонентов – амилозы с 1-4 связями и линейными молекулами и амилопектина с 1-4 и 1-6 связями с разветвленным строением. Амилоза дает синее окрашивание с йодом, а амилопектин - черно-фиолетовое.
ХОД РАБОТЫ
Растения для опыта предварительно (2-3 дня) выдерживают в темноте, чтобы листья обескрахмалились. Если опыт ставится зимой, лучше взять примулу или пеларгонию - они отличаются обильным накоплением крахмала. Надо иметь в виду, что опыт удается лишь с полностью обескрахмаленными листьями. Если опыт ставят весной, то лучше взять комнатное растение, накапливающее не так много крахмала - фуксию или гортензию.
Берут четкий негатив или темную светонепрозрачную бумагу с любым вырезанным изображением и закрывают лист с двух сторон с помощью скрепок, стараясь не пережимать саму листовую пластинку. Растение на свету выдерживают вновь 2-3 дня. Затем лист срезают и подвергают следующим операциям:
Обрабатывают 3 минуты кипящей водой. Этим разрушают связь хлорофилла с белками и убивают клетки листа.
В колбе с обратным холодильником с помощью спирта обесцвечивают лист и извлекают хлорофилл.
Промывают лист водой.
Расправив лист на фарфоровой тарелочке, обрабатывают его раствором йода в йодистом калии. Участок листа с крахмалом синеет, а при избытке его чернеет, затемненные участки остаются соломенно-желтыми. Так проявляются позитивные контуры изображения негатива либо той фигуры, которую вырезали из бумаги. Делают рисунок и выводы.
МАТЕРИАЛЫ И ОБОРУДОВАНИЕ
1) комнатное растение; 2) черная бумага; 3) скрепки; 4) спирт; 5) колба с обратным холодильником; 6) фарфоровая тарелочка; 7) раствор йода в иодиде калия.
Работа 25. Необходимость СО2 для образования крахмала
ХОД РАБОТЫ
В зеленом растении на свету крахмал образуется за счет СО2 и воды. Продемонстрировать это можно следующим образом. Берут обескрахмаленные листья пеларгонии (или других растений), помещают их в стакан с водой, ставят на стекла и накрывают стеклянными колпаками. Для предотвращения газообмена, края колпака у основания промазывают вазелином. Под один колпак ставят стаканчик с 20%-ным гидроксидом К или Na, под другой помещают слабый раствор HCI и бросают кусочек мрамора. Оба колпака хорошо освещают.
Таким образом, у нас два варианта: листья в первом случае обеднены СО2 (его поглощает щелочь), в другом - концентрация СО2 повышена за счет химической реакции. Через 4-5 часов листья подвергаются операциям, описанным в работе 24. Зарисовывают опыт и делают выводы.
МАТЕРИАЛЫ И ОБОРУДОВАНИЕ
1) стаканы; 2) стекла; 3) стеклянные колпаки; 4) вазелин; 5) 20%-ный раствор KOH или NaOH; 6) HCl; 7) мрамор; 8) то же, что и для работы 24.
Работа 26. Значение хлорофилла для образования крахмала
Очень четкие результаты получаются с пестролистным растением, например, колеусом, пеларгонией зональной и др.
ХОД РАБОТЫ
Листья пестролистных растений подвергают операциям, описанным в работе 24. После обработки в черно-фиолетовый и синий цвет окрашиваются только участки, содержащие хлорофилл.
В другом варианте этого опыта, поместить лист элодеи под микроскоп, обработать его сначала хлоралгидратом или раствором едкого калия для просветления и промыть спиртом.
Затем, капнув раствором йода в йодистом калии, мы обнаруживаем темные зерна первичного ассимиляционного крахмала, которые находятся только там, где были хлоропласты.
Зарисовать и сделать выводы.
МАТЕРИАЛЫ И ОБОРУДОВАНИЕ
1) то же, что и для работы 24; 2) растения с пестрыми листьями; 3) элодея; 4) хлоралгидрат или раствор едкого калия; 5) все для микроскопирования.
Работа 27. Образование низкомолекулярных (редуцирующих) углеводов в зеленых листьях на свету
Из проделанных ранее работ видим, что первым продуктом фотосинтеза в зеленых растениях является полимерный углевод - крахмал; но, однако, имеется много растений, которые накапливают мало крахмала либо вообще крахмала не накапливают, а в тех же условиях накапливают растворимые низкомолекулярные сахара, имеющие свободные альдо- и кето-группы и благодаря этому обладающие восстанавливающими (редуцирующими) свойствами.
ХОД РАБОТЫ
Перья зеленого лука и листья других растений, особенно из семейства лилейных (гиацинта, пролески, ириса, тюльпана и др.) и орхидных, выдержанные на свету, также подвергают операциям, описанным в работе 24. Результат – обесцвеченные листья остаются желтыми, следовательно, крахмала в них нет. Но если мы мелко нарезанные листья поместим в пробирку с водой, доведем на спиртовке до кипения, прильем туда реактив Фелинга и продолжим кипячение еще 2-3 минуты, то в пробирке выпадает красно-оранжевый осадок оксида меди - свидетель того, что там содержатся редуцирующие сахара, т.е. углеводы со свободными альдо- и кето-группами.
МАТЕРИАЛЫ И ОБОРУДОВАНИЕ
1) перья зеленого лука или листья растений из семейства лилейных или орхидных; 2) то же, что и для работы 24; 3) спиртовки; 4) реактив Фелинга.
Пётр Арамаисович Иконников
Анна Алексеевна Белозёрова
