
- •Http://www.Chem-astu.Ru/chair/study/genchem/index.Html 1 химическая термодинамика и термохимия
- •1.1 Первое начало термодинамики. Закон гесса
- •1.2 Направленность химических процессов
- •Http://www.Chem-astu.Ru/chair/study/genchem/index.Html 2 химическая кинетика и химическое равновесие
- •2.1 Кинетика химических реакций
- •2.2 Скорость реакции в гетерогенных системах
- •2.3 Химическое равновесие
- •Http://www.Chem-astu.Ru/chair/study/genchem/index.Html 4 растворы
- •4.1 Концентрация растворов. Растворимость веществ
- •4.2 Процессы, сопровождающие растворение
- •4.3 Растворы электролитов
- •4.3.1 Электролитическая диссоциация
- •4.3.3 Смещение ионных равновесий
- •4.3.4 Гидролиз солей
- •Http://www.Chem-astu.Ru/chair/study/genchem/index.Html 5 комплексные соединения
- •5.1 Строение комплексных соединений
4.3.3 Смещение ионных равновесий
Ионное равновесие, как и любое другое, смещается при изменении концентрации одного из ионов. Например, если в раствор уксусной кислоты, диссоциирующей по уравнению
CH3COOH H+ + CH3COO–
ввести какую-либо соль этой кислоты и тем самым увеличить концентрацию ионов CH3COO–, то в соответствии с принципом Ле-Шателье * равновесие смещается влево. Отсюда следует, что введение в раствор слабого электролита * одноименных ионов (т.е. ионов, одинаковых с одним из ионов электролита) уменьшает степень диссоциации * этого электролита.
Аналогично нарушается равновесие в случае малорастворимого электролита (соли). Например, если к насыщенному раствору сульфата кальция CaSO4 добавить другой, хорошо растворимый сульфат (K2SO4), то вследствие увеличения концентрации ионов SO42– равновесие сместится в сторону образования кристаллов (образуется осадок CaSO4). Этот процесс прекратится, когда произведение концентраций [Ca2+] и [SO42–] станет равно произведению растворимости *, т.е. установится новое состояние равновесия.
На основании рассмотренных примеров можно сделать следующий вывод: реакции в растворах электролитов всегда идут в сторону образования наименее диссоциированных или наименее растворимых веществ. Из этого, в частности, следует, что сильные кислоты вытесняют слабые из растворов их солей:
CH3COONa + HCl = CH3COOH + NaCl
Суть этой реакции более точно отражается ионно-молекулярным уравнением, где формулы слабых электролитов записаны в виде молекул, а сильных – в виде ионов:
CH3COO– + Na+ + H+ + Cl– = CH3COOH + Na+ + Cl–
или в сокращенном видеСокращенное ионное уравнение отражает самую суть происходящего процесса. Вступают в реакцию или образуются в ней в действительности только те частицы (ионы или молекулы), которые записаны в сокращенном уравнении.:
CH3COO– + H+ = CH3COOH
Аналогично протекают реакции между сильными основаниями и солями слабых оснований. Например:
FeSO4 + 2 NaOH = Na2SO4 + Fe(OH)2
Fe2+ + SO42– + 2 Na+ + 2 OH– = SO42– + 2 Na+ + Fe(OH)2
Fe2+ + 2 OH– = Fe(OH)2
4.3.4 Гидролиз солей
Химическая реакция обменного характера растворяемого вещества с растворителем называется сольволизом. Если растворителем является вода, то процесс – гидролиз (частный случай сольволиза).
Суть гидролиза солей заключается в том, что происходит смещение равновесия диссоциации воды вследствие связывания одного из ее ионов с образованием малодиссоциированного или труднорастворимого продукта. Гидролиз идет по-разному в зависимости от силы кислоты и основания, образовавших соль. Рассмотрим различные случаи.
а) Соль образована слабой кислотой и сильным основанием (CH3COONa, KCN, Na2CO3).

или CH3COO– + Na+ + H2O CH3COOH + Na+ + OH–
CH3COO– + H2O CH3COOH + OH–
Так как уксусная кислота слабо диссоциирует, ацетат-ион связывает ион H+, и равновесие диссоциации воды смещается вправо согласно принципу Ле Шателье. В растворе накапливаются ионы OH– (pH>7)*.
Если соль образована многоосновной кислотой, то гидролиз идет ступенчато. Например, гидролиз карбоната:
I ступень: CO32– + H2O HCO3– + OH–
II ступень: HCO3– + H2O H2CO3 + OH–
Практическое значение обычно имеет только процесс, идущий по первой ступени, которым, как правило, и ограничиваются при оценке гидролиза солей. Равновесие гидролиза по второй ступени значительно смешено влево по сравнению с равновесием первой ступени, поскольку на первой ступени образуется более слабый электролит (HCO3–), чем на второй (H2CO3) (о смещении ионных равновесий см. раздел 4.3.3).
б) Соль образована сильной кислотой и слабым основанием (NH4NO3, AlCl3, Fe2(SO4)3).
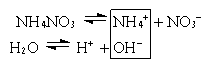
NH4+ + NO3– + H2O NH4OH + NO3– + H+
NH4+ + H2O NH4OH + H+
(pH<7)
В случае многозарядного катиона гидролиз протекает ступенчато, например:
I ступень: Cu2+ + HOH CuOH+ + H+
II ступень: CuOH+ + HOH Cu(OH)2 + H+
При этом концентрация ионов водорода и pH среды * в растворе также определяются главным образом первой ступенью гидролиза.
в) Соль образована слабой кислотой и слабым основанием (CH3COONH4, (NH4)2CO3).
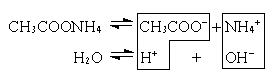
CH3COO– + NH4+ + H2O CH3COOH + NH4OH
В этом случае образуются два малодиссоциированных соединения, и pH раствора зависит от относительной силы кислоты и основания.
Если продукты гидролиза могут удаляться из раствора- например, в виде осадка или газообразного вещества., то гидролиз протекает до конца. Например:
Al2S3 + 3 H2O Al(OH)3 + H2S
г) Соли, образованные сильной кислотой и сильным основанием, гидролизу не подвергаются, т.к. единственным малодиссоциирующим соединением является H2O.
Взаимное усиление гидролиза. Допустим, что в разных сосудах установились равновесия:
CO32– + H2O HCO3– + OH–
Al3+ + H2O AlOH2+ + H+
Обе соли гидролизованы незначительно, но если растворы смешать, то происходит связывание ионов H+ и OH–. В соответствии с принципом Ле-Шателье * оба равновесия смещаются вправо, и гидролиз протекает полностью:
2 AlCl3 + 3 Na2CO3 + 3 H2O = 2 Al(OH)3 + 3 CO2 + 6 NaCl
Это называется взаимным усилением гидролиза.
