
Молекулярна фізика, термодинаміка, реальні гази і рідини (основні поняття і закони)
Рівняння стану ідеального газу
pV
=
![]() ;
М – молекулярна маса.
;
М – молекулярна маса.
Основне рівняння кінетичної теорії газів
pV
=
![]() ;
р =
;
р =![]() ;
р =nkT.
;
р =nkT.
Середня кінетична енергія руху молекул
![]() (і - число ступенів вільності молекул).
(і - число ступенів вільності молекул).
Середня квадратична швидкість молекул
![]() ;
;
![]() ,
,
![]() – число Авогадро.
– число Авогадро.
Енергія теплового руху молекул (внутрішня енергія газу)
![]()
![]() .
.
Молярна
теплоємність при постійному об'ємі
![]() та при
та при
постійному
тиску С![]() (C = Mс).
(C = Mс).
За
законом Дальтона тиск суміші газів –
P =![]() ,
,
де Рі – парціальний тиск.
Молярна
маса суміші газів – М =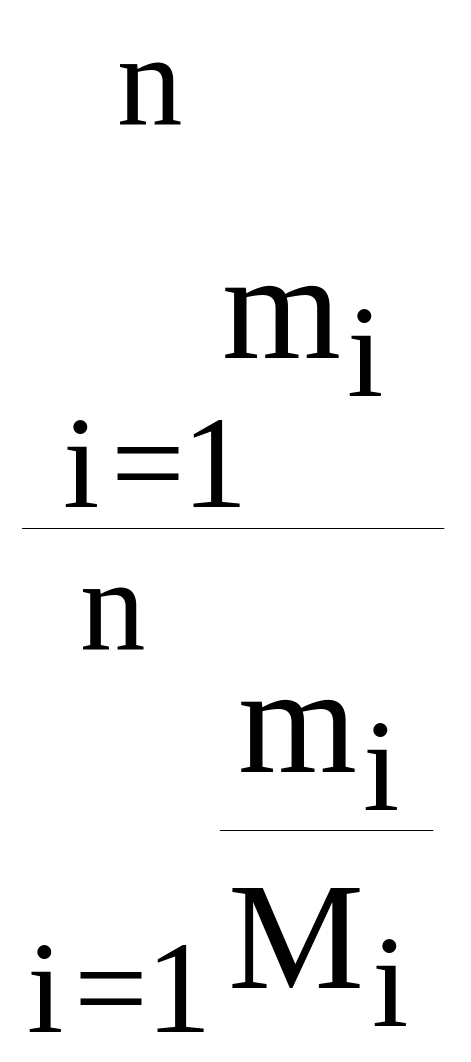 ,
,
де mі– маса окремих газів, а
Мі – їх молекулярна маса.
Найбільш
імовірна швидкість молекул
![]() ,
,
середня
арифметична швидкість молекул
![]() .
.
Середня довжина вільного пробігу молекул газу
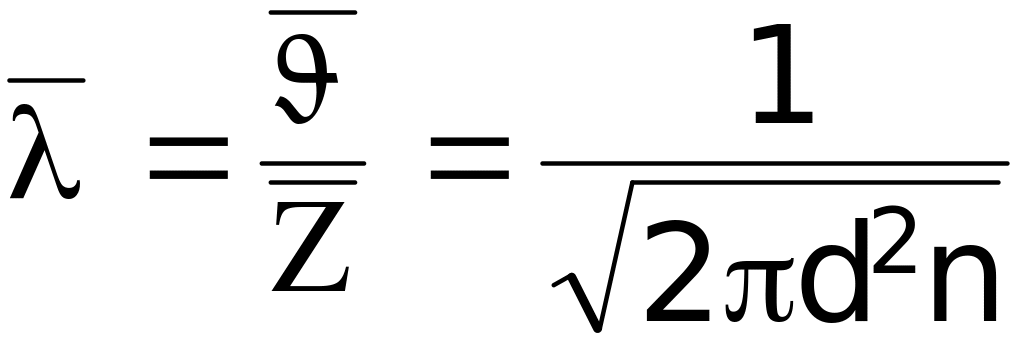 .
.
де
![]() – середня кількість зіткнень кожної
молекули з іншими в одиницю часу.
– середня кількість зіткнень кожної
молекули з іншими в одиницю часу.
Маса m, перенесена за час Dt при дифузії, визначається рівнянням
m
= - Д![]() (Д=
(Д=![]() ).
).
Імпульс, перенесений газом за час Dt, визначає силу внутрішнього тертя
F
у газі F= -
![]() ,
,
де
![]() називається коефіцієнтом внутрішнього
тертя.
називається коефіцієнтом внутрішнього
тертя.
Кількість
теплоти Q , яка переноситься за час Dt
унаслідок теплопровідності, дорівнює
Q= - К![]() ,
де К =
,
де К =
![]() – коефіцієнт теплопровідності.
– коефіцієнт теплопровідності.
Перший початок термодинаміки може бути записаний у вигляді
dQ = dW + dA,
де
dA= pdV, dW =![]()
![]() .
.
Робота, яка виконується при ізотермічній зміні об'єму газу
А
=![]() .
.
Тиск газу та його об'єм зв'язані при адіабатичному процесі рівнянням
Пуассона pV![]() = const (g
=
= const (g
=
![]() ).
).
Коефіцієнт корисної дії теплової машини
![]() .
.
Для ідеального циклу Карно
![]() ,
,
де
T
– температура нагрівника,
![]() –
температура холодильника.
–
температура холодильника.
Різниця
ентропії
![]() двох станів 1 та 2 визначається формулою
двох станів 1 та 2 визначається формулою
=![]() .
.
Рівняння стану реальних газів (рівняння Ван-дер-Ваальса), віднесене до
довільної маси m газу, має вигляд
(р
+
![]()
![]() )(V
-
)(V
-
![]() )
=
,
)
=
,
де а і в – сталі, різні для різних газів.
Сталі а і в даного газу зв'язані з його критичною температурою Тк
критичним
тиском Рк
та критичним об'ємом
![]() (
- об'єм одного
(
- об'єм одного
кіломоля газу) наступними співвідношеннями:
=
3в
, Р![]() =
=
![]() ,
Т
=
,
Т
=
![]() .
.
Коефіцієнт поверхневого натягу a чисельно дорівнює силі, яка прикладена
до одиниці довжини краю поверхневої плівки рідини
a
=
![]() .
.
При зміні площі плівки на D S здійснюється робота D А = aD S.
Додатковий тиск, який викликаний кривизною поверхні рідини,
визначається за формулою Лапласа
D
Р = a(![]() ),
),
де
![]() та
та
![]() – радіуси кривизни двох
взаємноперпендикулярних перети-
– радіуси кривизни двох
взаємноперпендикулярних перети-
нів поверхні рідини. Радіус R вважається позитивним, якщо меніск опуклий, і
негативним, якщо меніск угнутий.
Висота підняття рідини у капілярній трубці
h
=
![]() ,
,
де r – радіус трубки, r – густина рідини і q – краєвий кут.
При повному змочуванні q = 0, при повному незмочуванні q = p.
