
- •Ен.Ф. 03 физика
- •Ен.Ф. 03 физика и биофизика
- •Лабораторный практикум
- •Молекулярная физика и термодинамика
- •Введение
- •Лабораторная работа №1
- •1 Общие сведения
- •2 Описание установки и вывод расчетной формулы
- •3 Порядок выполнения работы и требования к оформлению результатов
- •4 Контрольные вопросы
- •Лабораторная работа №2 Определение коэффициента внутреннего трения газов и длины свободного пробега их молекул
- •1 Общие сведения
- •2 Описание установки и вывод расчетной формулы
- •3 Порядок выполнения работы и требования к оформлению результатов
- •4 Контрольные вопросы
- •Лабораторная работа № 3 Определение влажности воздуха
- •1 Общие сведения
- •2 Описание установки и вывод расчетной формулы
- •3 Порядок выполнения работы и требования к оформлению результата
- •4 Контрольные вопросы
- •Лабораторная работа №4 Газовые процессы и определение адиабатической постоянной
- •1 Общие сведения
- •2 Описание установки и вывод расчетной формулы
- •3 Порядок выполнения работы и требования к оформлению результатов
- •4 Контрольные вопросы
- •2 Описание установки и вывод расчетной формулы
- •3 Порядок выполнения работы и требования к оформлению результата
- •4 Контрольные вопросы
- •Лабораторная работа №6 Явление поверхностного натяжения жидкости. Определение коэффициента поверхностного натяжения жидкости
- •1 Общие сведения
- •2 Описание установки и вывод расчетной формулы
- •3 Порядок выполнения работы и требования к оформлению результатов
- •4 Контрольные вопросы
- •Библиографический список
4 Контрольные вопросы
4.1 Какие газовые процессы называются изотермическими, изохорическими и адиабатическими?
4.2
Представьте график адиабаты и изотермы
на
![]() -диаграмме.
Почему адиабата идет круче изотермы?
-диаграмме.
Почему адиабата идет круче изотермы?
4.3 Какой газ называется идеальным?
4.4 Сформулируйте первое начало термодинамики и примените его для изопроцессов.
4.5 Что называется молем газа?
4.6 Дайте определение удельной и мольной теплоемкостей вещества.
4.7 Как формулируется и записывается уравнение Майера?
4.8 Каков физический смысл универсальной газовой постоянной?
4.9 Сформулируйте теорему Больцмана о равномерном распределении энергии по степеням свободы молекулы.
4.10 Что происходит с внутренней энергией газа при адиабатическом процессе?
4.11 Что называется числом степеней свободы?
Лабораторная работа №5
Определение изменения энтропии при нагреве
и плавлении олова
Цель и задача работы: изучение I и II законов термодинамики, определение приращения энтропии при фазовом переходе первого рода на примере плавления олова.
1 Общие сведения
Все процессы в природе необратимы. Всякий процесс, при котором система переходит из одного состояния в другое, протекает таким образом, что нельзя провести его в обратном направлении без изменений в окружающих телах. Это связано с рассеянием части энергии в любом процессе за счет трения, излучения и других причин. В любом из них изменяется состояние в целом, часть энергии системы рассеивается. Для характеристики этого общего для всех систем свойства вводится физическая величина — энтропия, которая является мерой бесполезности внутренней энергии с точки зрения совершения работы (мера беспорядка).
Слово энтропия в переводе с греческого языка означает слово вовнутрь, возвращение. Имеется в виду преобразование энергии в обратимых процессах. Термин энтропия был предложен Клаузиусом для обозначения функции состояния термодинамической системы
![]() ,
(1)
,
(1)
где
![]() - энтропия, Дж/К;
Q
– теплота, полученная данной системой
или отданная ею, Дж;
Т
– абсолютная температура, К.
Энтропией (
)
называется функция состояния системы,
дифференциал которой в элементарном
обратимом процессе равен отношению
бесконечно малого количества тепла dQ,
сообщенного системе, к абсолютной
температуре Т.
- энтропия, Дж/К;
Q
– теплота, полученная данной системой
или отданная ею, Дж;
Т
– абсолютная температура, К.
Энтропией (
)
называется функция состояния системы,
дифференциал которой в элементарном
обратимом процессе равен отношению
бесконечно малого количества тепла dQ,
сообщенного системе, к абсолютной
температуре Т.
Общее изменение энтропии в любом процессе
 .
(2)
.
(2)
Во всех случаях в результате передачи теплоты Q от нагретого тела к холодному происходит выравнивание их температур. При этом снижается возможность совершения работы, уменьшается предельно высокий КПД. Вместе с тем повышается доля связанной энергии, увеличивается энтропия. При полном выравнивании температур КПД становится равным нулю. При этом энтропия достигает максимума, а энергия системы целиком не может быть использована для совершения работы. Полное значение энтропии в системе не поддается учету, но в изолированной системе можно найти изменение энтропии в любом процессе.
2 Описание установки и вывод расчетной формулы
Схема установки для определения изменения энтропии приведена на рисунке 1.
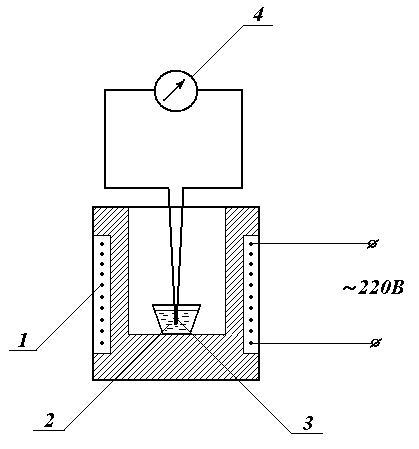
Рисунок 1 Схема установки: 1 – электропечь; 2 – тигель с оловом;
3 – термопара; 4 – прибор для измерения температуры
Установка состоит из электропечи 1, в которую помещают тигель с оловом 2, в олово введена термопара, соединенная с прибором для измерения температуры 4 (логометром или милливольтметром). Питание осуществляется от электросети с напряжением 220 В.
Для определения общего изменения энтропии олова в процессе нагрева и плавления необходимо вычислить количество тепла, сообщенное данной массе олова в каждом из этих процессов
 (3)
(3)
где
![]() - теплота, переданная данному телу при
нагреве, Дж;
с
– удельная теплоемкость олова, Дж/кгK;
m
– масса олова, кг;
- теплота, переданная данному телу при
нагреве, Дж;
с
– удельная теплоемкость олова, Дж/кгK;
m
– масса олова, кг;
![]() - комнатная температура,
К;
- комнатная температура,
К;
![]() - температура плавления олова,
К.
- температура плавления олова,
К.
![]() ,
(4)
,
(4)
где
![]() - теплота, переданная данной массе олова
при плавлении, Дж;
- удельная теплота плавления, Дж/кг;
m
– масса олова, кг.
- теплота, переданная данной массе олова
при плавлении, Дж;
- удельная теплота плавления, Дж/кг;
m
– масса олова, кг.
Подставляя значения и в формулу (1) получим
 ;
(5)
;
(5)
![]()
![]() .
(6)
.
(6)
Так как
Q= + ,
то общее изменение энтропии
![]() .
(7)
.
(7)
