
Приготовление растворов
Растворы – это однородные (гомогенные) системы, состоящие из двух или более компонентов (составных частей), количества которых могут изменяться в широких пределах. Раствор состоит из растворенного вещества и растворителя, то есть среды, в которой растворенное вещество равномерно распределено в виде молекул или ионов. Растворы однородны, их состав может изменяться в широких пределах.
Различают газовые, жидкие и твердые растворы. Наибольшее распространение имеют жидкие растворы.
Состав раствора (содержание в нем растворенного вещества) может быть выражен разными способами:
Массовая доля (ώ) в процентах – отношение массы растворенного вещества (г, кг) к массе всего раствора, то есть показывает, сколько растворенного вещества содержится в 100 г раствора.
Молярная концентрация (молярность, См)) раствора показывает количество молей растворенного вещества, содержащееся в 1 л раствора.
Нормальная концентрация (нормальность Сн) – количество эквивалентных масс растворенного вещества, содержащихся в 1 л раствора. Эквивалентом вещества называется такое его количество, которое соединяется, вытесняет или замещает 1 моль атомов водорода. Масса эквивалента, выраженная в граммах, называется эквивалентной массой. Эквивалентная масса (э.м.) кислоты, гидроксида или соли, участвующих в ионно-обменных процессах, равна частному от деления молярной массы этого вещества на произведение количества катионов в молекуле
Титр раствора (Т) – масса растворенного вещества (г), содержащаяся в 1 мл раствора.
Экспериментальная часть
Опыт 1. Определение массовой доли (%) лабораторного раствора по относительной плотности.
В зависимости от концентрации растворов меняется их относительная плотность, поэтому концентрации. Вещества в растворе можно определить по его относительной плотности, пользуясь справочными таблицами. Чаще всего относительную плотность раствора определяют с помощью ареометра.
Ареометр (рис. 3.1) представляет собой пустотелый стеклянный поплавок. В верхней его части находится шкала, а в нижней – груз, благодаря которому ареометр, погруженный в жидкость, поддерживается в вертикальном положении. Ареометр калибруется при определенной температуре, указанной на шкале. На шкалу нанесены деления, соответствующие величинам относительных плотностей. Для измерения относительной плотности раствора в цилиндр емкостью 250 мл наливают испытуемый раствор и погружают в него сухой, чистый ареометр так, чтобы он не касался стенок сосуда. По положению нижнего мениска жидкости отмечают деление шкалы ареометра, совпадающее с уровнем жидкости в цилиндре. Отсчет по шкале производится сверху вниз с точностью до ± 0, 001.
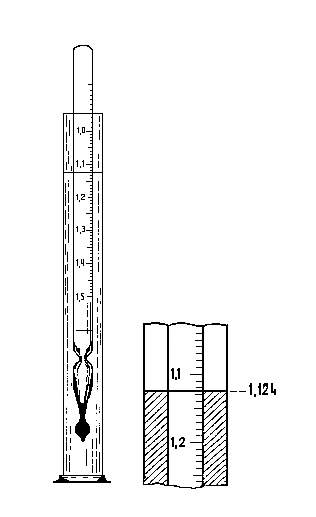
Рис. 3.1 Положение ареометра в цилиндре с раствором и отсчет по шкале ареометра.
На рис.3.1 показание ареометра соответствует относительной плотности 1,124. Если в таблице относительной плотности величина 1,124 отсутствует, а приведены близкие ей величины, как, например, для раствора хлорида калия
относительная концентрация
плотность (%)
1,180 18
1,133 20,
то массовую долю (%) находят методом интерполяции (определение промежуточной величины по двум известным крайним). Для этого проводят следующие расчеты:
Определяют разность величин относительных плотностей и массовых долей (%) по табличным данным: 1,133 . . . . . . . . . . . . .20 % 1,118 . . . . . . . . . . . . .18 % ________________________ 0,015 . . . . . . . . . . . . .2 %
Находят разность между величиной, определенной ареометром, и меньшей табличной величиной: 1,124 – 1,118 = 0,006. Составляют пропорцию: 0,015 . . . . . . . . . . . . .2 % 0,006 . . . . . . . . . . . . .х х = 2 · 0,006)/0,015 = 0,80 %.
Найденное число прибавляют к меньшей величине массовой доли (%), указанной в таблице: 18 + 0,80 = 18,80 %.
Применяя метод интерполяции, можно также определить относительную плотность раствора по заданной массовой доли (%) раствора.
Получить у преподавателя индивидуальное задание: приготовить 250 мл раствора NaCl (KCl) с массовой долей (в %), например, 3,5 %. 3,7 %, 4,2 % и т.д. из лабораторного раствора и воды.
Для приготовления заданного раствора надо измерить ареометром относительную плотность лабораторного раствора с точностью ± 0,001. По найденной относительной плотности найти в таблице массовую долю (в %) лабораторного раствора. Если в таблице нет измеренной ареометром величины относительной плотности, то определить массовую долю (в %) лабораторного раствора надо методом интерполяции. Далее надо, применяя метод интерполяции, определить относительную плотность заданного раствора.
Все величины, необходимые для расчета задания, теперь известны, и нужно определить, какие количества по объему лабораторного раствора и воды следует смешать, чтобы получить 250 мл заданного раствора. Для этого сначала надо определить массу соли, необходимую для получения заданного раствора, затем найти массу лабораторного раствора, в котором содержится нужное количество соли, и, зная относительную плотность лабораторного раствора, перейти к определению его объема. По разности между заданным объемом и рассчитанным для лабораторного раствора определить объем воды.
Опыт 2. Приготовление раствора с заданной массовой долей (%) из лабораторного раствора и воды.
Представить преподавателю расчет задания по приготовлению раствора с заданной концентрацией. После проверки расчета нужно отмерить вычисленные объемы лабораторного раствора и воды, слить их в мерный цилиндр объемом 250 мл, тщательно перемешать мешалкой (трубкой с шариком) и определить с помощью ареометра относительную плотность приготовленного раствора. Ареометр вымыть чистой водой, вытереть досуха и убрать в футляр.
Определить по относительной плотности приготовленного раствора его массовую долю (%).Определить расхождение в заданном и приготовленном растворе по массовой доле в процентах (расчет ошибки опыта в процентах). Рассчитать молярность, нормальность и титр заданного раствора.
Таблица
d204 |
% |
d204 |
% |
d204 |
% |
NaCl |
KCl |
||||
1,005 |
1 |
1,101 |
14 |
1,011 |
2 |
1,013 |
2 |
1,109 |
15 |
1,024 |
4 |
1,020 |
3 |
1,116 |
16 |
1,037 |
6 |
1,027 |
4 |
1,124 |
17 |
1,050 |
8 |
1,034 |
5 |
1,132 |
18 |
1,063 |
10 |
1,041 |
6 |
140 |
19 |
1,077 |
12 |
1,049 |
7 |
148 |
20 |
1,090 |
14 |
1,056 |
8 |
1,156 |
21 |
1,104 |
16 |
1,063 |
9 |
164 |
22 |
1,118 |
18 |
1,071 |
10 |
1,172 |
23 |
1,133 |
20 |
1,078 |
11 |
1,180 |
24 |
1,147 |
22 |
1,086 |
12 |
1,189 |
25 |
1,162 |
24 |
1,093 |
13 |
1,197 |
26 |
|
|
ЛАБОРАТОРНАЯ РАБОТА №4
