
- •Методические указания
- •Подписано в печать 06.10.2009. Формат 60х90 1/16.
- •Введение
- •Определение эквивалента и эквивалентной массы металла по водороду
- •Теоретическая часть
- •Практическая часть Реактивы и посуда
- •Указания по технике безопасности
- •Определение тепловых эффектов химических реакций
- •Теоретическая часть
- •Практическая часть Методика проведения опытов
- •1 ─ Внешний стакан калориметра; 2 ─ внутренний стакан калориметра;
- •3 ─ Теплоизолирующая прокладка; 4 ─ термометр; 5 ─ мешалка
- •Для некоторых солей и кристаллогидратов
- •Скорость химических реакций. Химическое равновесие
- •Теоретическая часть
- •Практическая часть
- •Памятка для построения графиков
- •Растворы. Определение концентрации раствора
- •Теоретическая часть
- •Способы выражения концентраций
- •Практическая часть
- •Описание прибора
- •Ход работы
- •Формулы для расчета
- •Электролитическая диссоциация. Реакции ионного обмена
- •Теоретическая часть
- •Практическая часть
- •Задания для опытов
- •Водородный показатель. Гидролиз солей
- •Теоретическая часть
- •1. Водородный показатель рН
- •2. Гидролиз солей
- •Практическая часть
- •Окислительно-восстановительные реакции
- •Теоретическая часть
- •Практическая часть
- •Гальванические элементы
- •Теоретическая часть
- •Описание прибора
- •1 ─ Стаканы с растворами: сульфата цинка (а); сульфата меди (б); 2 ─ цинковый и медный электроды; 3 ─ электролитический ключ; 4 ─ токопроводящая проволока; 5 ─ гальванометр
- •Практическая часть
- •Формулы для расчетов
- •Электролиз
- •Теоретическая часть
- •Схемы электролиза некоторых солей
- •1. Электролиз расплава хлорида магния с инертным анодом
- •2. Электролиз раствора нитрата калия с инертным анодом
- •3. Электролиз раствора сульфата никеля с никелевым анодом
- •Практическая часть
- •Указания по технике безопасности
- •Химические свойства металлов
- •Теоретическая часть
- •Практическая часть
- •Оформление работы и выводы
- •Коррозия металлов и борьба с ней
- •Теоретическая часть
- •Основные методы защиты от коррозии
- •Практическая часть
- •Определение временной и общей жесткости воды
- •Теоретическая часть
- •Методы устранения жесткости воды
- •Практическая часть Реактивы, посуда, оборудование
- •Ход исследования
- •Ход исследования
- •Заключение
- •Библиографический список
2. Электролиз раствора нитрата калия с инертным анодом
Раствор содержит ионы калия К+, нитрат-ионы NO3-, молекулы воды. В соответствии с последовательностью разрядки на аноде и катоде будут протекать следующие процессы:
K+ (+) Катод: 2Н2О + 2ē = H2↑+ 2ОН- ;
NO3- (–) Анод: 2Н2О – 4ē = О2↑ + 4Н+.
В прикатодном пространстве будет образовываться щелочь KOH, а в прианодном – кислота HNO3.
Суммарная реакция в молекулярно-ионном виде:
6Н2О = 2Н2↑ + О2↑+ 4ОН - + 4Н+.
В молекулярном виде:
4KNO3 + 6Н2О = 2Н2↑ + О2↑ + 4КOН + 4HNO3.
3. Электролиз раствора сульфата никеля с никелевым анодом
В соответствии с последовательностью разрядки на аноде и катоде будут протекать следующие процессы:
(–) Анод: Ni0 – 2ē = Ni2+;
(+) Катод: Ni2+ + 2ē = Ni0.
Весь процесс сводится к выделению никеля на катоде и постепенному растворению никелевого анода. Количество сульфата никеля в растворе остается неизменным.
Практическая часть
Электролиз водных растворов проводится в приборе, представленном на рис. 9.1. В качестве инертных электродов используются графитовые стержни карандашей.
2
3
4
1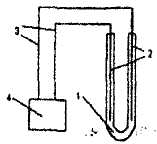
Рис. 9.1. Прибор для проведения электролиза:
1 – U-образный сосуд с раствором электролита; 2 – электроды; 3 – токопроводящие проволоки; 4 – источник постоянного тока
Опыт №1. Электролиз с нерастворимыми электродами
Электролизер (U-образную трубку) наполните, не доходя до краев ~ 1см, раствором соли, указанном в задании. Опустите в оба колена трубки электроды, включите прибор, отметьте все видимые изменения. Напишите уравнения катодного и анодного процессов, суммарное уравнение в ионно-молекулярном и молекулярном виде.
Идентификация продуктов, образующихся при электролизе солей,
на аноде:
1. Хлор (газ) определяется по резкому запаху, при появлении первых признаков которого прибор следует выключить.
2. Йод определяется по появлению коричневой окраски, характерному запаху, с помощью йодкрахмальной индикаторной бумаги.
3. Кислород – газ без запаха;
на катоде:
Водород – газ без запаха.
Если на катоде не выделяется водород, то осаждается металл в виде красноватого налета (медь), блестящих игольчатых кристаллов (цинк, свинец) и т. д.
Опыт №2. Электролиз с активным анодом
Опыт выполняется аналогично опыту №1. Один графитовый электрод заменяется металлическим (железо, алюминий, цинк, медь), который подключается к положительному полюсу внешнего источника. Раствор соли для электролиза взять из опыта №1 по указанию преподавателя.
Указания по технике безопасности
1. Настоящая работа имеет повышенную опасность, так как в ней применяется электрический ток.
2. Присоединять прибор к источнику тока только после того, когда электроды вставлены в раствор.
3. Не прикасайтесь к открытым токоведущим частям.
Лабораторная работа № 10
Химические свойства металлов
Цель работы: практически ознакомиться с характерными химическими свойствами металлов различной активности и их соединений; изучить особенности металлов с амфотерными свойствами; окислительно-восстановительные реакции уравнять методом электронно-ионного баланса.
