
- •Методические указания
- •Подписано в печать 06.10.2009. Формат 60х90 1/16.
- •Введение
- •Определение эквивалента и эквивалентной массы металла по водороду
- •Теоретическая часть
- •Практическая часть Реактивы и посуда
- •Указания по технике безопасности
- •Определение тепловых эффектов химических реакций
- •Теоретическая часть
- •Практическая часть Методика проведения опытов
- •1 ─ Внешний стакан калориметра; 2 ─ внутренний стакан калориметра;
- •3 ─ Теплоизолирующая прокладка; 4 ─ термометр; 5 ─ мешалка
- •Для некоторых солей и кристаллогидратов
- •Скорость химических реакций. Химическое равновесие
- •Теоретическая часть
- •Практическая часть
- •Памятка для построения графиков
- •Растворы. Определение концентрации раствора
- •Теоретическая часть
- •Способы выражения концентраций
- •Практическая часть
- •Описание прибора
- •Ход работы
- •Формулы для расчета
- •Электролитическая диссоциация. Реакции ионного обмена
- •Теоретическая часть
- •Практическая часть
- •Задания для опытов
- •Водородный показатель. Гидролиз солей
- •Теоретическая часть
- •1. Водородный показатель рН
- •2. Гидролиз солей
- •Практическая часть
- •Окислительно-восстановительные реакции
- •Теоретическая часть
- •Практическая часть
- •Гальванические элементы
- •Теоретическая часть
- •Описание прибора
- •1 ─ Стаканы с растворами: сульфата цинка (а); сульфата меди (б); 2 ─ цинковый и медный электроды; 3 ─ электролитический ключ; 4 ─ токопроводящая проволока; 5 ─ гальванометр
- •Практическая часть
- •Формулы для расчетов
- •Электролиз
- •Теоретическая часть
- •Схемы электролиза некоторых солей
- •1. Электролиз расплава хлорида магния с инертным анодом
- •2. Электролиз раствора нитрата калия с инертным анодом
- •3. Электролиз раствора сульфата никеля с никелевым анодом
- •Практическая часть
- •Указания по технике безопасности
- •Химические свойства металлов
- •Теоретическая часть
- •Практическая часть
- •Оформление работы и выводы
- •Коррозия металлов и борьба с ней
- •Теоретическая часть
- •Основные методы защиты от коррозии
- •Практическая часть
- •Определение временной и общей жесткости воды
- •Теоретическая часть
- •Методы устранения жесткости воды
- •Практическая часть Реактивы, посуда, оборудование
- •Ход исследования
- •Ход исследования
- •Заключение
- •Библиографический список
М
2408
Федеральное агентство железнодорожного транспорта
ГОСУДАРСТВЕННОЕ ОБРАЗОВАТЕЛЬНОЕ УЧРЕЖДЕНИЕ ВЫСШЕГО ПРОФЕССИОНАЛЬНОГО ОБРАЗОВАНИЯ
Самарский государственный университет путей сообщения
Кафедра "Общая и инженерная химия"
Методические указания
к выполнению лабораторных работ по химии
для студентов всех специальностей очной формы обучения
Составители: Л. М. Васильченко
Г. Б. Сеницкая
А. В. Халикова
В. М. Яковлев
Н. В. Сотова
Самара
2
УДК 546
Методические указания к выполнению лабораторных работ по химии для студентов всех специальностей очной формы обучения. – Самара : СамГУПС, 2009. – 46 с.
Утверждены на заседании кафедры ОИХ, протокол № 9 от 09.04.2009 г.
Печатаются по решению редакционно-издательского совета университета.
Методические указания содержат описания лабораторных работ по курсу общей химии для студентов очной формы обучения всех специальностей. Лабораторные работы содержат необходимые теоретические сведения и формулы для выполнения расчетных заданий, а также правила техники безопасности для каждой конкретной работы.
Составители: Васильченко Лидия Михайловна
Сеницкая Галина Борисовна
Халикова Алла Викторовна
Яковлев Виктор Михайлович
Сотова Наталья Васильевна
Рецензенты: к.х.н., доцент СамГУ Е. А. Колосова;
к. ф.-м.н., доцент СамГУПС Х. Д. Ламажапов
Редактор И.М.Егорова
Компьютерная верстка Е. А. Ковалева
Подписано в печать 06.10.2009. Формат 60х90 1/16.
Усл. печ. л. 2,9 Тираж 250 экз. Заказ № 183.
Введение
Настоящие указания, написанные коллективом кафедры общей и инженерной химии, представляют собой сборник лабораторных работ по общей химии, составленный в соответствии с Государственным образовательным стандартом высшего профессионального образования от 14 апреля 2000 года. Методические указания содержат описания лабораторных работ. Каждая работа включает теоретическую и практическую часть. Теоретическая часть содержит в сжатой форме основные сведения и расчетные формулы по теме лабораторной работы и предназначена для того, чтобы студенты сделали нужные выводы об изучаемых химических явлениях и процессах.
Практическая часть содержит описание опытов, проводимых полумикрометодом.
Студенты приступают к работе после предварительного обсуждения с преподавателем практического хода работы и содержания выводов, которые надлежит сделать после выполнения данной работы.
Лабораторная работа №1
Определение эквивалента и эквивалентной массы металла по водороду
Цель работы: практически, опытным путем научиться определять эквивалент и эквивалентную массу металла по объему газа, выделенного в ходе реакции. Научиться проводить различные рациональные расчеты с использованием закона эквивалентов.
Теоретическая часть
Из закона постоянства состава, кратных и объемных отношений следует, что элементы соединяются друг с другом в строго определенных количественных соотношениях, которые называют эквивалентами или эквивалентными массами. Для определения эквивалентов и эквивалентных масс нужно знать, что такое моль и мольная масса.
Моль ─ это количество вещества, в котором содержится число частиц любого определяемого сорта, равное постоянной Авогадро (6,02·1023). Например: 3·1024 молекул воды составят 5 моль.
Мольная (молярная) масса вещества в граммах численно равна его относительной молекулярной (атомной) массе, выраженной в атомных единицах массы (а.е.м.). Масса 1 моля вещества выражается в г/моль. Например: молярная масса Н2О и атомная масса кислорода соответственно равны 18 и 16 а.е.м., их мольные массы равны 18 г/моль и 16 г/моль.
Эквивалентом элемента называется такое его количество, которое соединяется с 1 молем атомов водорода или замещает то же количество атомов водорода в химических реакциях. Например, в соединениях НВr, Н2О, РН3 эквиваленты брома, кислорода, фосфора соответственно равны 1 моль, 1/2 моль, 1/3 моль.
Масса одного эквивалента называется его эквивалентной массой. Так, в приведенных выше примерах эквивалентные массы брома, кислорода, фосфора соответственно равны 79,9 г/моль, 16:2 = 8 г/моль, 31:3= 10,3 г/моль.
Эквивалентом сложного вещества называется такое его количество, которое взаимодействует без остатка с одним эквивалентом водорода или с одним эквивалентом любого другого вещества. Расчеты, связанные с определением эквивалентных масс, проводятся по закону эквивалентов: массы (объемы) реагирующих друг с другом веществ пропорциональны их эквивалентным массам (объемам). Математически закон выражается зависимостью:
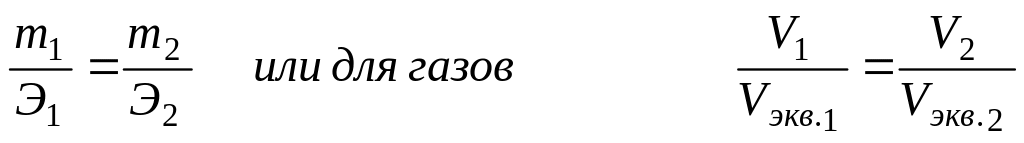 ,
(1)
,
(1)
где m (V) ─ массы (объемы) реагирующих веществ;
Э (Vэкв.) ─ эквивалентные массы (объемы).
Эквивалентную массу простого вещества можно вычислить по формуле:
![]() ,
,
где
![]() ─
мольная масса атома элемента,
─
мольная масса атома элемента,
В ─ валентность элемента.
Так например, эквивалентные массы водорода и кислорода соответственно равны:
![]()
Эквивалентный объем газа можно вычислить по формуле:
![]() .
.
Так например, эквивалентные объемы водорода и кислорода соответственно равны:
![]() .
.
Эквивалентные массы сложных веществ можно вычислить по формулам:
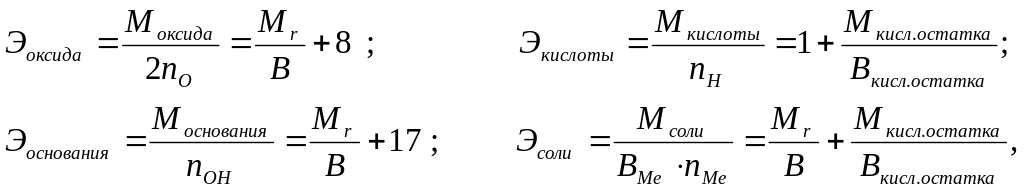 (2)
(2)
где nO, nOH, nH, nMe – число атомов кислорода, гидроксильных групп, атомов водорода, металла соответственно в оксиде, основании, кислоте, соли;
В – валентность;
8 – эквивалентная масса кислорода;
1 – эквивалентная масса водорода;
17 – эквивалентная масса гидроксильной группы.
В данной работе определение эквивалентной массы металла основано на измерении объема водорода, вытесненного активным металлом из разбавленной кислоты. Измеренный объем водорода при условиях опыта приводится к нормальным условиям:
![]() (3)
(3)
затем по формуле (1) определяют эквивалентную массу.
Прибор для определения эквивалента металла состоит из бюретки 1, соединенной резиновыми трубками, снабженными зажимом 4, с воронкой 2 и двухколенной пробиркой 3. Прибор смонтирован на штативе Бунзена.
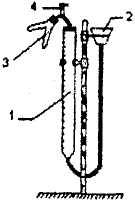
Рис.1.1. Прибор для определения эквивалента металла
