
- •Введение
- •Производственный и технологический процессы
- •Производственный и технологический процессы
- •Стадии жизненного цикла изделия
- •Стандартизация технических решений
- •Основы стандартизации
- •Взаимозаменяемость, точность, допуски и посадки
- •А б в Рис. 1.13. Знаки обозначения шероховатости на чертежах Размерный анализ конструкции
- •При организации производства изделия
- •2.1.1.Элементы теории размерных цепей
- •2.1.2.Примеры расчета размерных цепей
- •2.1.3. Рис. 1.21. Схема поля допуска звена x2 Регулирование точности размерных цепей
- •Конструкционные материалы и технология их производства
- •Конструкционные материалы: классификация, свойства
- •Свойства металлов и сплавов.
- •2.1.4.Свойства черных металлов
- •2.1.5.Свойства цветных металлов и сплавов.
- •Изменение структуры и свойств материала
- •Технология производства металлов
- •Выплавка чугуна
- •Производство стали
- •Получение алюминия
- •Технологические процессы получения заготовок и деталей машин
- •Технологические процессы литья
- •Разработка чертежа отливки, изготовление оснастки
- •Изготовление литейной формы, получение отливки
- •Специальные способы литья
- •Технологические процессы обработки металлов давлением
- •Прокатное производство
- •Ковка, горячая штамповка
- •Холодная штамповка
- •Производство машиностроительных профилей
- •Технологические процессы сварки и резки металлов
- •Способы сварки плавлением
- •Способы сварки давлением
- •Резка металлов
- •Порошковая металлургия
- •Изготовление деталей из пластмасс
- •Обработка заготовок деталей машин
- •Обработка материалов резанием
- •Виды обработки резанием, оборудование, оснастка
- •Элементы механики процесса резания
- •2.1.6. Деформации и напряжения при резании
- •2.1.7. Рис. 4.55. Напряжения и силы на передней грани резца Силы резания
- •Точность и качество поверхности при обработке резанием
- •Влияние факторов процесса резания на точность обработки
- •Формирование микронеровностей на обработанной поверхности
- •Наклеп и остаточные напряжения при обработке резанием
- •Технологические процессы электрофизических, электрохимических и других методов обработки
- •Электроэрозионные методы обработки
- •Электрохимические методы обработки
- •Ультразвуковая обработка
- •Светолучевая обработка
- •Основы проектирования технологических процессов изготовления деталей
- •Этапы разработки технологического процесса обработки детали
- •Базирование заготовок, деталей
- •Методы обработки типовых поверхностей деталей машин
- •2.1.8.Обработка плоских поверхностей
- •2.1.9.Обработка цилиндрических поверхностей
- •2.1.10.Обработка резьб
- •2.1.11.Обработка отверстий
- •Определение припусков на механическую обработку
- •2.1.12.Технология изготовления валов
- •Р ис. 4.75. Чертеж вала
- •2.1.13.Обработка корпусных деталей
- •2.1.14.Технологический процесс обработки фланца
- •Автоматизация производства
- •Экономические связи в производственном процессе
- •Вопросы для самопроверки
- •Литература Основная
- •Дополнительная
- •Оглавление
- •Производственные процессы
Получение алюминия
Получение алюминия это электролиз раствора глинозема Al2O3, получаемого из алюминиевых руд, в расплаве криолита Na3AlF6 c получением алюминия – сырца; очистка (рафинирование) сырца от примесей.
Основное сырье для получения алюминия (Al) - алюминиевые руды, в первую очередь бокситы. В бокситах алюминий содержится в виде гидроокисей Al(OH)3, AlOOH, Al2O3 и каолинита Al2O32SiO22H2O.
Рис. 2.8.
Схема электролитического способа
производства алюминия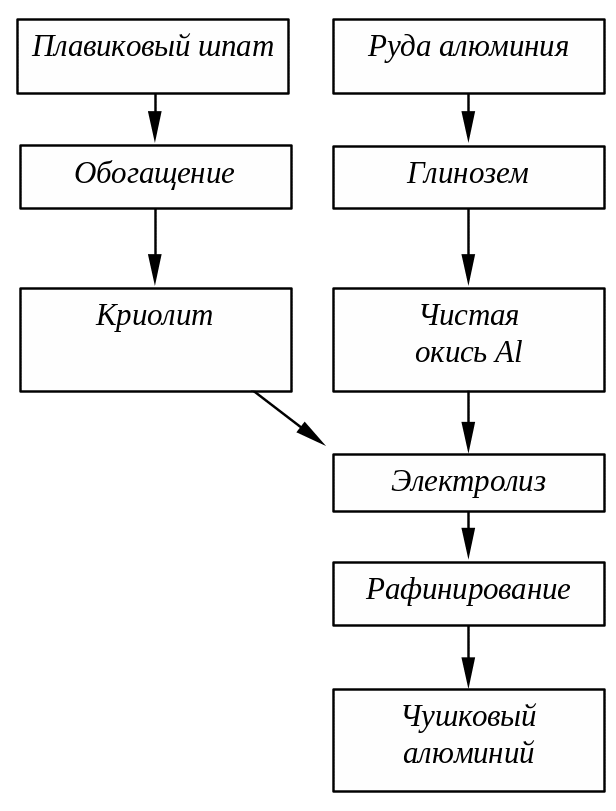
Способ состоит из следующих операций [2]:
Дробление боксита в мельницах.
Выщелачивание боксита, которое заключается в химическом его разложении от взаимодействия с водным раствором щелочи:
AlOOH+NaOH=NaAlO2+H2O или Al(OH)3+NaOH=NaAlO2+2H2O.
Содержащийся в боксите кремнезем также взаимодействует со щелочью и переходит в раствор в виде силиката натрия:
SiO2+2NaOH=Na2SiO3+H2O.
В растворе алюминат натрия NaAlO2 и силикат натрия Na2SiO3 образуют нерастворимый натриевый алюмосиликат; в нерастворимый остаток переходят окислы Ti и Fe, придающие остатку красный цвет; этот остаток называют красным шламом.
Отделение алюминиевого раствора от красного шлама.
Разложение алюминиевого раствора происходит самопроизвольно с выделением кристаллической гидроокиси Al:
Na2OAl2O3+4H2O=Al(OH)3+2NaOH.
Выделение осадка 50...60% частиц гидроокиси алюминия Al(OH)3. Это происходит в гидроциклонах и вакуум-фильтрах.
Обезвоживание Al(OH)3 осуществляют в трубчатых вращающихся печах при температуре (1150...1200)С.
При нагреве происходят следующие структурные превращения:
Al(OH)3 |
|
AlОOH |
|
Al2O3 |
|
Al2O3. |
|
200С |
|
950С |
|
1200С |
|
Сырьем для производства криолита Na3AlF6 являются обогащенный плавиковый шпат (95% CaF2), серная кислота, гидрат окиси алюминия и кальцинированная сода.
Процесс протекает в две стадии:
Получение из плавикового шпата фтористого водорода, а затем плавиковой кислоты HF.
Получение солей плавиковой кислоты (криолита). В раствор плавиковой кислоты вводят гидроокись алюминия:
6HF+Al(OH)3=H3AlF6+3H2O.
В результате реакции образуется фтороалюминиевая кислота, которую нейтрализуют содой, получают криолит, выпадающий в осадок:
2H3AlF6+3Na2CO3=2Na3AlF6+3CO2+3H2O.
Рис. 2.9.
Схема электролиза при получении алюминия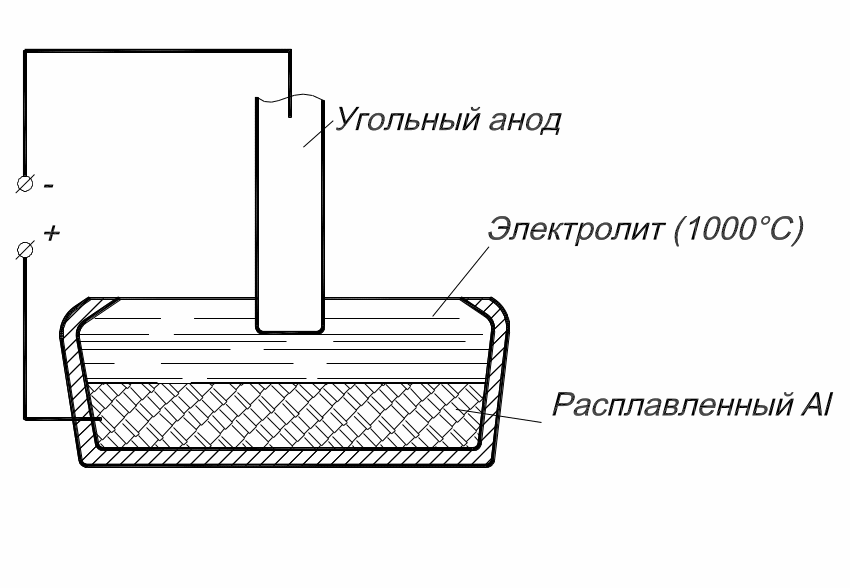
Алюминий-сырец, образующийся в результате электролиза, собирается на дне ванны под слоем электролита. Извлекают Al из ванны через 2...4 суток, используя вакуум-ковш. В алюминии-сырце содержатся металлические (Fe, Cu, Zn) и неметаллические примеси, а также газы, которые удаляют рафинированием.
