
- •Змістовий модуль 4. Реальні гази та рідини.
- •Реальні гази. Рівняння Ван-дер-Ваальса.
- •Внутрішня енергія
- •Робота і теплота, як форми обміну енергії між системами
- •1.Теплоємність
- •Слід запам’ятати:
- •2. Адіабатичний процес
- •3. Рівняння Пуассона
- •1. Критичний стан. Закон відповідних станів.
- •2. Внутрішня енергія реального газу.
- •3. Ефект Джоуля –Томсона
- •4. Зрідження газів. Одержання низьких температур.
Змістовий модуль 4. Реальні гази та рідини.
Реальні гази. Дослідні ізотерми реального газа. Рівняння стану реальних газів. Рівняння Ван-дер-Ваальса. Критичний стан. Порівняння рівняння Ван-дер-Ваальса з дослідними даними. Внутрішня енергія реального газа. Ефект Джоуля-Томсона. Зрідження газів та отримання низьких температур. Рідини. Властивості рідкого стану. Поверхневий шар. Поверхневий натяг. Формула Лапласа.Змочування. Капілярні явища. Тиск насичених парів над меніском.
Реальні гази. Рівняння Ван-дер-Ваальса.
На відміну від ідеального газу, в природі існують гази у яких не можна нехтувати масою молекули і вважати її матеріальною точкою та не враховувати взаємодію між молекулами на відстані. Для врахування цих властивостей реальних газів необхідно вносити свої корективи в рівняння стану газу тоум, що експериментально отримані ізотерми реальних газів відрізняються від тих, які отримуються за допомогою рівняння Мендєлєєва-Клапейрона (див. мал. 1). Стан реального газу описується за допомогою рівняння Ван-дер-Ваальса.
Найбільш повні якісні результати з рівняння Ван-дер-Ваальса можна дістати шляхом аналізу його ізотерм, побудованих за формулою
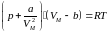 (1).
(1).
Помноживши
рівняння (1) на
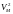 і
після розкриття дужок для довільних
температур
і
після розкриття дужок для довільних
температур
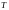 дістанемо
дістанемо
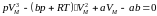 (1.1)
(1.1)
Р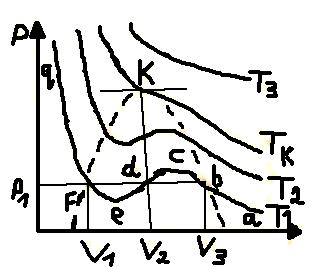 івняння
(1.1) кубічне відносно молярного об’єму
івняння
(1.1) кубічне відносно молярного об’єму
 .
Це означає, що при заданих
.
Це означає, що при заданих
 і
і
 об’єм
може набувати трьох різних значень.
Коефіцієнти при
у рівнянні (1.1) дійсні, і, отже, це рівняння
у розв’язку може мати або всі три корені
дійсні і різні, або один дійсний, а два
уявні. В окремому випадку може статися,
що всі дійсні корені виявляються рівними
між собою. Це особливий стан речовини.
Зобразимо ізотерми газу Ван-дер-Ваальсу
на діаграмі стану речовини в координатах
,
об’єм
може набувати трьох різних значень.
Коефіцієнти при
у рівнянні (1.1) дійсні, і, отже, це рівняння
у розв’язку може мати або всі три корені
дійсні і різні, або один дійсний, а два
уявні. В окремому випадку може статися,
що всі дійсні корені виявляються рівними
між собою. Це особливий стан речовини.
Зобразимо ізотерми газу Ван-дер-Ваальсу
на діаграмі стану речовини в координатах
,
 (мал.1).
(мал.1).
Мал. 1. Експериментальні ізотерми реальних газів
Характерним
на малюнку є те, що при досить високих
температурах (для всіх ізотерм вище
точки К) довільна ізобара
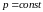 перетинає ізотерму в одній точці, і цій
точці відповідає одне значення об’єму,
що є дійсним коренем розв’язку рівняння
(1.1). Усі ізотерми в цій частині діаграми
мають вигляд монотонно спадаючих з
ростом об’єму
перетинає ізотерму в одній точці, і цій
точці відповідає одне значення об’єму,
що є дійсним коренем розв’язку рівняння
(1.1). Усі ізотерми в цій частині діаграми
мають вигляд монотонно спадаючих з
ростом об’єму
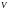 гіпербол (наприклад,
гіпербол (наприклад,
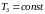 ).
Для ізотерм нижчих, ніж у точці К,
температурах довільній ізобарі
відповідає три значення об’єму
).
Для ізотерм нижчих, ніж у точці К,
температурах довільній ізобарі
відповідає три значення об’єму
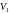 ,
,
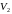 ,
,
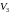 (наприклад, для ізотерми
(наприклад, для ізотерми
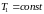 ).
Ізобара
).
Ізобара
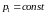 перетинає ізотерму в трьох точках b, d,
f, і на цій ділянці ізотерма має хвилясту
форму. Для одного моля речовини її стан
у точці b такий, що відповідає найбільшому
об’єму з трьох зазначених, тобто
перетинає ізотерму в трьох точках b, d,
f, і на цій ділянці ізотерма має хвилясту
форму. Для одного моля речовини її стан
у точці b такий, що відповідає найбільшому
об’єму з трьох зазначених, тобто
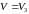 .
Відповідно при цьому об’ємі речовина
має найменшу густину. Тому природно
прийняти, що це газоподібний стан
речовини. Стан речовини у точці f
відповідає найменшому її об’єму
.
Відповідно при цьому об’ємі речовина
має найменшу густину. Тому природно
прийняти, що це газоподібний стан
речовини. Стан речовини у точці f
відповідає найменшому її об’єму
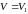 ,
і фактично при дальшому стисненні об’єм
зовсім мало змінюється, а тиск різко
зростає. Це властиво рідкому стану
речовини. Тому можна стверджувати, що
об’єм
відповідає речовині у рідкому стані.
,
і фактично при дальшому стисненні об’єм
зовсім мало змінюється, а тиск різко
зростає. Це властиво рідкому стану
речовини. Тому можна стверджувати, що
об’єм
відповідає речовині у рідкому стані.
Загальний аналіз ізотерм на мал.1 приводить, що рівняння Ван-дер-Ваальсу описує не тільки газоподібний стан реального газу, а й перехід його від газоподібного до рідкого.
З
підвищенням температури (наприклад,
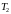 )
горизонтальна ділянка хвилеподібної
частини ізотерми звужується, мінімум
і максимум хвилі зменшується. При деякій
температурі
)
горизонтальна ділянка хвилеподібної
частини ізотерми звужується, мінімум
і максимум хвилі зменшується. При деякій
температурі
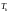 ізотерма набуває точки перегину К,
в якій всі три значення об’єму збігаються,
що відповідає трьом дійсним і рівним
між собою кореням рівняння (1.1). Температура
ізотерма набуває точки перегину К,
в якій всі три значення об’єму збігаються,
що відповідає трьом дійсним і рівним
між собою кореням рівняння (1.1). Температура
 ,
відповідна їй ізотерма, точка К називаються
критичними.
При значеннях
,
відповідна їй ізотерма, точка К називаються
критичними.
При значеннях
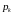 ,
,
,
,
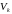 кажуть, що речовина знаходиться у
критичному стані.
кажуть, що речовина знаходиться у
критичному стані.
Для визначення критичних параметрів , , виходить, що для критичної точки рівняння (1.1) можна записати так:
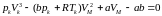 (1.2).
(1.2).
Оскільки
для критичної точки всі три корені для
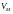 збігаються і дорівнюють
,
то рівняння (1.2) є точним кубом і, отже,
має зводитись до вигляду
збігаються і дорівнюють
,
то рівняння (1.2) є точним кубом і, отже,
має зводитись до вигляду
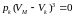 .
Піднісши до кубу, дістанемо:
.
Піднісши до кубу, дістанемо:
 (1.3)
(1.3)
Прирівнявши коефіцієнти при однакових степенях об’єму в рівняннях (1.2) і (1.3), матимемо:
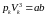 ,
,
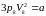 ,
,
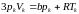 (1.4)
(1.4)
Розв’язок
(1.4) дає можливість визначити
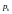 ,
,
,
,
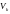 через константи a і b:
через константи a і b:
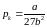 ,
,
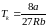 ,
,
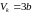 (1.5).
(1.5).
Рівняння Ван-дер-Ваальса можна представити у такому вигляді, коли його ізотерми не залежатимуть від індивідуальних властивостей речовини. Для цього за одиниці тиску, об’єму і температури беруть критичні значення цих величин. Тоді тиск, об’єм і температуру, виміряні в цих одиницях, називають зведеними. Їх можна записати так:
 ,
,
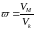 ,
,
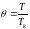 (1.6)
(1.6)
Підставивши
в рівняння
(1) замість
,
,
відповідно
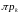 ,
,
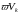 ,
,
 з (1.6) і
,
,
з (1.5) матимемо зведене рівняння стану
газу Ван-дер-Ваальса
з (1.6) і
,
,
з (1.5) матимемо зведене рівняння стану
газу Ван-дер-Ваальса
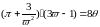
Це
рівняння є однаковим для всіх речовин,
оскільки воно не містить сталих величин,
які б характеризували індивідуальні
властивості речовини. Це положення
називається законом відповідних станів.
З цього закону випливає, що коли для
різних речовин із трьох параметрів
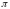 ,
,
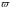 ,
,
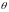 збігаються значення яких-небудь двох,
то обов’язково збігатиметься і значення
третього параметра. Речовини, які
підпорядковуються закону відповідних
станів, називають термодинамічно
подібними.
збігаються значення яких-небудь двох,
то обов’язково збігатиметься і значення
третього параметра. Речовини, які
підпорядковуються закону відповідних
станів, називають термодинамічно
подібними.
1
