
- •I. Физколлоидная химия
- •1. Физическая химия
- •1.1. Вода
- •1.1.1. Вода как уникальная молекула жизни
- •1.1.3. Буферные растворы
- •1.2. Биоэнергетика клетки
- •1.3. Термохимия
- •1.4. Химическая кинетика и катализ
- •2. Коллоидная химия
- •2.1. Классификация дисперсных систем
- •2.2. Классификация дисперсных систем по агрегатному состоянию дисперсной фазы
- •2.2. Поверхностные явления
- •2.3. Адсорбция
- •2.4. Коллоидные растворы (золи)
- •2.4.1. Характеристика коллоидных растворов
- •2.4.2. Растворы высокомолекулярных соединений
- •II. Биологическая химия
- •3. Белки
- •3.1. Общая характеристика белков
- •3.3. Методы выделения, фракционирования и очистки белков
- •3.3.1. Методы выделения белков
- •3.4. Физико-химические свойства белков
- •3.5. Аминокислоты
- •3.6. Структура белковой молекулы
- •I'm 1.8. Денатурация и ренатурация рибонукле- азы (по Анфинсену):
- •3.7. Классификация белков
- •3.7.1. Простые белки
- •3.7.2. Сложные белки
- •4. Нуклеиновые кислоты
- •4.1. Общая характеристика нуклеиновых кислот
- •4.2. Нуклеотиды и нуклеозиды
- •4.3. Дезоксирибонуклеиновая кислота
- •4.4. Рибонуклеиновые кислоты
- •5. Углеводы 5.1. Общая характеристика углеводов
- •5.2. Моносахариды
- •5.3. Олигосахариды
- •5.4. Полисахариды (глюканы)
- •6. Липиды
- •6.1. Общая характеристика липидов
- •6.2. Простые липиды
- •6.3. Сложные липиды
- •6.4. Двойной липидный слой клеточных мембран
- •Контрольные вопросы и задания
- •7. Витамины
- •7.1. Общая характеристика витаминов
- •7.2. Классификация и номенклатура витаминов
- •7.2.1. Жирорастворимые витамины
- •7.2.2. Водорастворимые витамины
- •8. Ферменты 8.1. Общая характеристика ферментов
- •8.3. Общие свойства ферментов
- •8.4. Активирование и ингибирование ферментов
- •8.2. Участие ионов металлов в активировании ферментов
- •8.5. Классификация и номенклатура ферментов
- •III класс. Гидролазы. Они разрывают внутримолекулярные связи путем присоединения
- •8.6. Применение ферментов
- •9. Гормоны
- •9.1. Уровни регуляции гормонов
- •9.2. Гормоны, выделяемые железами внутренней секреции
- •9.3. Гормоны местного действия
- •11. Обмен углеводов
- •11.1. Переваривание углеводов в пищеварительном тракте
- •11.2. Катаболизм глюкозы
- •11.3. Цикл трикарбоновых кислот
- •11.4. Пентозофосфатный путь окисления глюкозо-6-фосфата
- •11.5. Биосинтез углеводов
- •11.6. Регуляция обмена углеводов
- •12. Обмен липидов
- •12.1. Переваривание липидов в пищеварительном тракте
- •12.2. Промежуточный обмен липидов
- •2. Если синтезируется много сн3—со—КоА, а энергии для синтеза жира недостаточно, то образуется активированная ацетоуксусная кислота:
- •12.3. Биосинтез липидов
- •12.4. Метаболизм стеринов и стеридов
- •13. Обмен белков
- •13.2. Биологическая ценность белков
- •13.3. Особенности переваривания белков у моногастричных животных
- •13.4. Особенности переваривания белков у жвачных
- •13.5. Метаболизм белков в тканях
- •13.6. Особенности обмена отдельных аминокислот
- •13.7. Биосинтез белка
- •14. Обмен нуклеиновых кислот
- •14.1. Переваривание нуклеиновых кислот в пищеварительном тракте
- •14.2. Промежуточный обмен нуклеиновых кислот (распад нуклеиновых кислот в тканях)
- •14.3. Биосинтез нуклеиновых кислот
- •14.4. Рекомбинантные молекулы и проблемы генной
- •15. Обмен воды и солей
- •15.1. Содержание и роль воды в организме
- •15.2. Электролиты тканей
- •15.3. Потребность организма в минеральных веществах, их поступление и выделение
- •16. Взаимосвязь обмена белков, жиров и углеводов
- •17. Биохимия крови
- •18. Биохимия нервной ткани
- •18.1. Химический состав нервной ткани
- •18.2. Обмен веществ в нервной ткани
- •18.3. Химизм передачи нервного импульса
- •19. Биохимия мышечной ткани
- •19.1. Морфология и биохимический состав мышечной ткани
- •19.2. Механизм сокращения мышцы
- •19.3. Окоченение мышц
- •20. Биохимия молока и молокообразования
- •21. Биохимия почек и мочи
- •22. Биохимия кожи и шерсти
- •23. Биохимия яйца
- •Приложение
2.4.2. Растворы высокомолекулярных соединений
Вещества, молекулярная масса которых выше 10 ООО Да, называются высокомолекулярными соединениями (ВМС) или полимерами. К числу важнейших природных ВМС относятся белки и полисахариды растительного и животного происхождения (желатин, альбумин, крахмал, агар-агар), натуральный каучук и др. Растворению полимеров предшествует их набухание — проникновение молекул растворителя в среду полимера и связанное с этим увеличение его массы и объема. По мере дальнейшего набухания расстояния между макромолекулами увеличиваются настолько, что они начинают отрываться друг от друга и переходить в растворитель, и в конце концов все молекулы полимера в силу диффузии равномерно распределяются по всему объему растворителя, образуя истинный раствор.
Различают неограниченное и ограниченное набухание. В первом случае оно заканчивается растворением полимера. Во втором случае набухание не доходит до растворения, и образуется студень (набухание желатина в воде при комнатной температуре). Причина ограниченного набухания кроется в наличии химических связей между макромолекулами, которые не дают им возможности переходить в растворитель.
Свободная и связанная вода в коллоидных растворах. Молекулы йоды электронейтральны. Однако помещенные во внешнее электрическое поле, они проявляют дипольный характер, ориентируясь при этом соответственно электрическим силовым линиям.
Аналогично этому гидратация гидрофильных коллоидов обусловливается электрическими зарядами высокомолекулярных веществ. Таким образом на поверхности этих молекул образуются оболочки из диполей молекул воды, ориентированных в зависимости от знака заряда ВМС. Те слои диполей воды, которые расположены в непосредственной близости к поверхности макромолекулы, наиболее прочно связаны с ней и наиболее упорядочение ориентированы. Этот слой образует так называемую связанную, или структурированную, воду. Остальная часть воды свободная. Исследования показали, что свойства связанной воды резко отличаются от таковых свободной воды. По степени упорядоченности структуры связанная вода приближается к свойствам твердого тела и имеет большую плотность, чем вода свободная. Гидратная оболочка не обладает растворяющими свойствами, поэтому ВМС растворяются в свободной воде.
Свойства растворов ВМС. Различают две группы коллоидных систем: лиофобные, частицы которых не имеют сольватной оболочки, и лиофильные, частицы которых сильно сольватизированы. К лиофильным коллоидам до недавнего времени относили и растворы ВМС. Однако исследования показали, что растворы ВМС — это растворы истинные, хотя и обладающие многими свойствами коллоидных растворов. Растворы ВМС обладают малой диффузионной способностью, не проникают через полунепроницаемые мембраны, рассеивают лучи света.
Однако растворение биополимеров ведет к образованию истинных растворов, так как между дисперсной фазой (молекулы ВМС) и дисперсионной средой нет поверхности раздела, т. е. системы эти гомогенные и, следовательно, обладают агрегативной устойчивостью. Молекулы белков, как известно, имеют либо спиралевидную (фибриллярные белки), либо глобулярную (глобулярные белки) структуру. И та, и другая структура несет на своей поверхности заряженные группы (—NH3+ и —СОО-). Общий заряд ВМС зависит от соотношения этих групп в молекуле. Состояние, при котором число групп —NH3+ равно числу групп —СОО- в молекуле белков, называется изоэлектрическим состоянием. Заряд молекулы при этом равен нулю. рН, при котором белок находится в изоэлектрическом состоянии (ИЭС), называется изоэлектрической точкой (ИЭТ) (табл. 2.3).

Перезарядка групп —NH2 и —СООН при изменении рН среды существенно изменяет вид спирали и глобулы, т. е. меняет конфигурациюцию белковой молекулы, а это существенно сказывается на функциональной способности молекулы. Введение в раствор сильных электролитов (например, солей) приводит к конкуренции их за молекулы воды у ВМС, а это снижает растворимость их и облегчает процесс нейтрализации заряда полимера. В итоге ВМС выпадает в осадок. Осаждение полимеров солями называется высаливанием.
По степени высаливающей способности в водных растворах ионы располагают в так называемые лиотропные ряды:
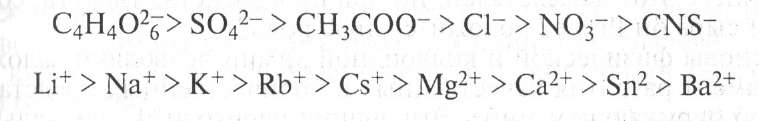
Расположение ионов в лиотропных рядах связано не столько с заядом иона, сколько со степенью его гидратации. После отмывки полимера от электролита (например, диали- зом) он снова может быть переведен в растворимое состояние, т.е. процесс высаливания обратим.
Денатурация. Потеря ВМС своих первоначальных (нативных) свойств за счет изменения пространственной структуры полимера называется денатурацией. Это можно наблюдать при нагревании (но не выше 70 °С) и охлаждении, высаливании, при действии кислот (органических), алкалоидов и т.д. Денатурация может быть обратимой и необратимой (при нагревании выше 70оС, при пействии сильных минеральных кислот, солей тяжелых металлов, алкалоидов). Этот факт следует прежде всего учитывать при работе с растворами белков.
Студни. Растворы высокомолекулярных соединений (и некоторые коллоидные системы) способны при определенных условиях терять текучесть, образуя при этом студни.
в студнях частицы дисперсной фазы связаны между собой в сетчатый каркас, а дисперсионная среда заключена в промежутки между ними. Таким образом, студни — это структурированные системы со свойствами эластичных твердых тел. Студнями являются: хлеб, джем, желе, мармелад, кисель, сыр, простокваша и т. д. Студни подразделяют на две группы: частичные (или обратимые), получаемые из ВМС; хрупкие (необратимые), получаемые из неорганических гидрофобных золей.
Для студней характерен ряд свойств твердых тел: они сохраняют форму, обладают упругими свойствами и эластичностью. Однако их механические свойства определяются концентрацией и температурой. При нагревании студни переходят в вязкотекучее состояние. Этот процесс называется плавлением. Он обратим, т. е. при охлаждении раствор снова застудневает.
Объем студней, полученных из растворов ВМС, при высушивании может уменьшаться.
Свежеприготовленные студни со временем подвергаются изменениям, так как процесс структурирования в них продолжается. При этом на поверхности студня появляются капельки жидкости, которые, сливаясь, образуют жидкую среду. Такой самопроизвольный процесс разделения студня на две фазы, сопровождающийся изменением его объема, называется синерезисом. Чаще всего процесс этот нежелателен, но при производстве творога, созревания сыра он играет положительную роль.
Основы физической и коллоидной химии позволяют заложить фундамент развития качественных и количественных представлений об окружающем мире. Эти знания необходимы для дальнейшего изучения таких специальных дисциплин, как физиология и биохимия растений и животных, фармакология и др. Выявление закономерностей протекания химических реакций, в свою очередь, подводит к возможности управления этими реакциями при решении как научных, так и технологических задач.
Контрольные вопросы и задания
1. Что такое дисперсные системы, их определение, классификация? 2. Назовите способы получения коллоидных растворов. 3. В чем сущность процесса диализа и где его используют? 4. Назовите оптические свойства коллоидных растворов. Объясните явление опалесценции и эффекта Фарадея—Тиндаля. 5. Чем отличаются молекулярно-кинетические свойства коллоидных растворов от таковых истинных растворов? 6. Как образуется структура коллоидной частицы в зависимости от условий получения коллоидного раствора? 7. Чем обусловлена устойчивость гидрофобных золей? 8. Опишите процессы набухания и растворения высокомолекулярных соединений (ВМС). 9. Каковы отличия свободной и связанной (структурированной) воды в коллоидах? 10. Объясните механизм процесса денатурации белков. Обратимая и необратимая денатурация. 11. Что такое адсорбция и ее роль в биологических процессах? 12. Каково главное свойство адсорбции и использование его в методах фракционирования и очистки ВМС? 13. В каких условиях происходит коагуляция гидрофобных золей? 14. Что такое изоэлектрическое состояние (ИЭС) коллоидных систем и изоэлектрическая точка? 15. В каких условиях происходит образование гелей, их строение и свойства? 16. Сформулируйте первый и второй законы термодинамики. 17. Мерой какого процесса служит величина, называемая энтропией? 18. Каким уравнением связаны свободная энергия, теплота и энтропия в химических реакциях? 19. Что такое гомогенный, гетерогенный и микрогетерогенный катализ? 20. Расскажите о теории механизма катализа.
