
- •I. Физколлоидная химия
- •1. Физическая химия
- •1.1. Вода
- •1.1.1. Вода как уникальная молекула жизни
- •1.1.3. Буферные растворы
- •1.2. Биоэнергетика клетки
- •1.3. Термохимия
- •1.4. Химическая кинетика и катализ
- •2. Коллоидная химия
- •2.1. Классификация дисперсных систем
- •2.2. Классификация дисперсных систем по агрегатному состоянию дисперсной фазы
- •2.2. Поверхностные явления
- •2.3. Адсорбция
- •2.4. Коллоидные растворы (золи)
- •2.4.1. Характеристика коллоидных растворов
- •2.4.2. Растворы высокомолекулярных соединений
- •II. Биологическая химия
- •3. Белки
- •3.1. Общая характеристика белков
- •3.3. Методы выделения, фракционирования и очистки белков
- •3.3.1. Методы выделения белков
- •3.4. Физико-химические свойства белков
- •3.5. Аминокислоты
- •3.6. Структура белковой молекулы
- •I'm 1.8. Денатурация и ренатурация рибонукле- азы (по Анфинсену):
- •3.7. Классификация белков
- •3.7.1. Простые белки
- •3.7.2. Сложные белки
- •4. Нуклеиновые кислоты
- •4.1. Общая характеристика нуклеиновых кислот
- •4.2. Нуклеотиды и нуклеозиды
- •4.3. Дезоксирибонуклеиновая кислота
- •4.4. Рибонуклеиновые кислоты
- •5. Углеводы 5.1. Общая характеристика углеводов
- •5.2. Моносахариды
- •5.3. Олигосахариды
- •5.4. Полисахариды (глюканы)
- •6. Липиды
- •6.1. Общая характеристика липидов
- •6.2. Простые липиды
- •6.3. Сложные липиды
- •6.4. Двойной липидный слой клеточных мембран
- •Контрольные вопросы и задания
- •7. Витамины
- •7.1. Общая характеристика витаминов
- •7.2. Классификация и номенклатура витаминов
- •7.2.1. Жирорастворимые витамины
- •7.2.2. Водорастворимые витамины
- •8. Ферменты 8.1. Общая характеристика ферментов
- •8.3. Общие свойства ферментов
- •8.4. Активирование и ингибирование ферментов
- •8.2. Участие ионов металлов в активировании ферментов
- •8.5. Классификация и номенклатура ферментов
- •III класс. Гидролазы. Они разрывают внутримолекулярные связи путем присоединения
- •8.6. Применение ферментов
- •9. Гормоны
- •9.1. Уровни регуляции гормонов
- •9.2. Гормоны, выделяемые железами внутренней секреции
- •9.3. Гормоны местного действия
- •11. Обмен углеводов
- •11.1. Переваривание углеводов в пищеварительном тракте
- •11.2. Катаболизм глюкозы
- •11.3. Цикл трикарбоновых кислот
- •11.4. Пентозофосфатный путь окисления глюкозо-6-фосфата
- •11.5. Биосинтез углеводов
- •11.6. Регуляция обмена углеводов
- •12. Обмен липидов
- •12.1. Переваривание липидов в пищеварительном тракте
- •12.2. Промежуточный обмен липидов
- •2. Если синтезируется много сн3—со—КоА, а энергии для синтеза жира недостаточно, то образуется активированная ацетоуксусная кислота:
- •12.3. Биосинтез липидов
- •12.4. Метаболизм стеринов и стеридов
- •13. Обмен белков
- •13.2. Биологическая ценность белков
- •13.3. Особенности переваривания белков у моногастричных животных
- •13.4. Особенности переваривания белков у жвачных
- •13.5. Метаболизм белков в тканях
- •13.6. Особенности обмена отдельных аминокислот
- •13.7. Биосинтез белка
- •14. Обмен нуклеиновых кислот
- •14.1. Переваривание нуклеиновых кислот в пищеварительном тракте
- •14.2. Промежуточный обмен нуклеиновых кислот (распад нуклеиновых кислот в тканях)
- •14.3. Биосинтез нуклеиновых кислот
- •14.4. Рекомбинантные молекулы и проблемы генной
- •15. Обмен воды и солей
- •15.1. Содержание и роль воды в организме
- •15.2. Электролиты тканей
- •15.3. Потребность организма в минеральных веществах, их поступление и выделение
- •16. Взаимосвязь обмена белков, жиров и углеводов
- •17. Биохимия крови
- •18. Биохимия нервной ткани
- •18.1. Химический состав нервной ткани
- •18.2. Обмен веществ в нервной ткани
- •18.3. Химизм передачи нервного импульса
- •19. Биохимия мышечной ткани
- •19.1. Морфология и биохимический состав мышечной ткани
- •19.2. Механизм сокращения мышцы
- •19.3. Окоченение мышц
- •20. Биохимия молока и молокообразования
- •21. Биохимия почек и мочи
- •22. Биохимия кожи и шерсти
- •23. Биохимия яйца
- •Приложение
3.7.2. Сложные белки
Молекула сложного белка состоит из простого белка и небелкового вещества — простетической группы (гр. prostheto — присоединяю).
Хромопротеиды (от гр. chroma — краска). Состоят из белка и связанного с ним окрашенного небелкового компонента.
Различают гемопротеиды, магний-порфирины, флавопротеиды. Они участвуют в фотосинтезе, дыхании клеток и целостного организма, транспорте кислорода и диоксида углерода, окислительно-восстановительных реакциях и т. д. Таким образом, они играют исключительно важную роль в процессах жизнедеятельности.
Гемопротеиды — к ним относятся гемоглобин и его производные, миоглобин, хлорофилсодержащие белки и ферменты. Все они содержат в качестве небелкового компонента структурно сходные железо- или магнийпорфирины.
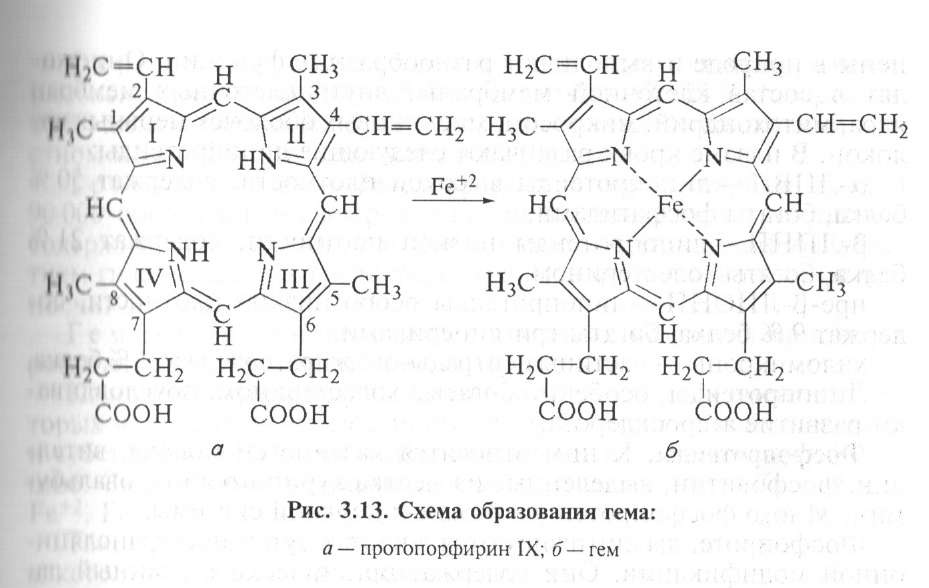
Гемоглобин содержится в эритроцитах. Его белковая часть — глобин, а небелковая часть — гем. Видовые различия гемоглобина обусловлены глобином, а гем одинаков у животных всех видов. Доля гема составляет 4 %, глобина — 96 %.
Гем состоит из четырех пиррольных колец: 1,3,5,8-тетраметил, 2,4-дивинил, 6,7-дипропионовокислый порфин (рис. 3.13).
Атом железа связывается с порфирином, а также с белковым компонентом (имидазольной группой гистидина). Белковая часть представлена двумя а-цепями, состоящими из 141 аминокислотного остатка; β-цепью, состоящей из 146 аминокислотных остатков. Серповидно-клеточная анемия обусловлена тем, что в глобине в 6-м положении глутаминовая кислота заменена валином.
К производным гемоглобина относятся:
оксигемоглобин НЬ02, в котором молекула кислорода соединена координационной связью с атомом железа, что обеспечивает оксигенацию — насыщение кислородом. Это не химическая связь;
карбоксигемоглобин НЬСО — гемоглобин связан с оксидом углерода (угарным газом). При этом гемоглобин теряет способность связывать кислород;
метгемоглобин НЬОН — окисленный гемоглобин. Образуется при отравлении оксидом азота, парами нитробензола и другими соединениями. Железо трехвалентное. Не способен к оксигенации;
карбгемоглобин НЬС02 — гемоглобин, насыщенный диоксином углерода (углекислым газом) С02;
миоглобин имеет молекулярную массу 17 000, содержит гем и одну полипептидную цепь, присутствует в мышечной ткани.
Катала за — гемсодержащий фермент, имеет молекулярную массу 225 ООО, катализирует разрушение пероксида водорода:
![]()
Ф л а в о п р о т е и д ы входят в состав ферментов оксидоредуктаз катализирующих окислительно-восстановительные реакции в клетке. Некоторые из них содержат ионы металлов.
Нуклеопротеиды. Состоят из белков и нуклеиновых кислот. Различают ДНП (дезоксирибонуклеопротеид) и РНП (рибонуклеопротеид). ДНП преимущественно локализован в ядре, а РНП — в цитоплазме. ДНК хранит наследственную информацию, является важнейшим компонентом биохимической структуры клетки животного организма, а потому нуклеопротеиды будут рассмотрены более подробно в разделе «Нуклеиновые кислоты».
Липопротеиды. Состоят из белка и липида. В составе липопротеидов открыты нейтральные жиры, свободные жирные кислоты, фосфолипиды, холестериды. Липопротеиды широко распространены в природе и выполняют разнообразные функции. Они входят в состав клеточной мембраны, внутриклеточных мембран ядра, митохондрий, микросом, миелиновых оболочек нервных волокон. В плазме крови различают следующие липопротеиды:
α-ЛПВП — липопротеиды высокой плотности, содержат 50% белка, богаты фосфатидами;
β-ЛПНП — липопротеиды низкой плотности, содержат 21% белка, богаты холестерином;
npe-β-ЛПОНП —липопротеиды особо низкой плотности, содержат 9 % белка, богаты триглицеридами;
хиломикроны — частицы нейтрального жира, содержат 1 % белка. Липопротеиды, особенно богатые холестерином, обусловливают развитие атеросклероза.
Фосфопротеиды. К ним относятся казеиноген молока, вителлин, фосфовитин, выделенные из желтка куриного яйца, овальбумин. Много фосфопротеидов в тканях нервной системы.
Фосфопротеиды синтезируются в клетке путем посттрансляционной модификации. Они содержат органически связанный лабильный фосфат, абсолютно необходимый для выполнения ряда биологических функций.
Гликопротеиды. Простетическая группа представлена углеводами и их производными. В гидролизате обнаруживают гексозамины (глюкозамин, галактозамин), глюкозу, маннозу, галактозу, ксилозу, арабинозу, глюкуроновую, уксусную и серную кислоты, нейраминовую и сиаловую кислоты и т. д.
Гиалуроновая кислота входит в состав внеклеточного вещества соединительной ткани, содержится в клеточной оболочке, в стекловидном теле, синовиальной жидкости. Состоит из D-глюкуроновой кислоты и N-ацетил-D-глюкозамина, соединенных β(1→3)-гликозидной связью (формула гиалуроновой кислоты приведена на с. 146). Между собой структурные единицы дисахаридов соединены обычными β(1→4)-связями, которые разрываются под действием фермента гиалуронидазы.
Хондроитинсерная кислота — тоже полимерная молекула внеклеточного основного вещества, имеет структуру, подобную гиалуроновой кислоте; отличие состоит в том, что вместо N-ацетил-D-глюкозамина в состав входит N-ацетил-D-галактозамин.
К гликопротеидам относятся также белки плазмы (за исключением альбуминов), трансферрин, церулоплазмин, гонадотропный и фолликулостимулирующий гормоны, муцин, овомукоид.
Металлопротеиды. К ним относятся биополимеры, содержащие кроме белка ионы какого-либо металла. Типичные представители — железосодержащие соединения ферритин, трансферрин, гемосидерин.
Ферритин — высокомолекулярный водорастворимый белок с молекулярной массой 400 000, содержит 17...23 % (в среднем 20%) железа, главным образом находится в селезенке, печени, костном мозге. Служит депо железа в организме.
Трансферрин — железопротеид с молекулярной массой 90 000 обнаружен в сыворотке крови в составе бета-глобулинов, содержит 0,13 % железа, которое связано координационно с участием гидроксильных групп тирозина. Это физиологический переносчик железа.
Гемосидерин содержится в клетках мононуклеарно-макрофагальной системы, печени, селезенки.
Ко
второй группе металлопротеидов относятся
ферменты, у ко- трых металл является
мостиком между белковыми компонентами
и
субстратом, при этом металл выполняет
каталитическую функцию. Сюда относятся
ферменты, зависимые от ионов Zn+2,
Mg+2,
![]() ,
Fe+3,
Mn+2,
Cu+2,
K+,Na,Ca+2.
,
Fe+3,
Mn+2,
Cu+2,
K+,Na,Ca+2.
Так, Zn+2 обеспечивает каталитическую активность ферментов: алкогольдегидрагеназы, карбоангидразы, карбоксипептидазы; Мg+2— фосфогидролазы и фосфотрансферазы; Мg+2 — аргиназы и фосфотрансферазы; Сu+2 — цитохромоксидазы и тирозиназы; Fe+2, Fe+3 — цитохромов, пероксидазы, каталазы, ферредоксин-АДФ-оксидоредуктазы; Mg+2, Са+2, Na+, К+— фосфопируваткиназы, АТФазы.
Ионы металлов могут быть прочно (ковалентно) присоединены или же могут легко отделяться, но без ионов металла фермент неактивен.
Контрольные вопросы и задания
I Дайте определение класса белков. 2. Сформулируйте принцип образования связи между аминокислотами (пептидной связи) при образовании белковой молекулы 3. Дайте классификацию аминокислот. 4. Охарактеризуйте физические и химические свойства аминокислот. 5. Чем определяются уровни структуры белковой молекулы? 6. Какова биологическая роль сложных белков? 7. Каковы функции белков в клетках и организме?
