- •I. Физколлоидная химия
- •1. Физическая химия
- •1.1. Вода
- •1.1.1. Вода как уникальная молекула жизни
- •1.1.3. Буферные растворы
- •1.2. Биоэнергетика клетки
- •1.3. Термохимия
- •1.4. Химическая кинетика и катализ
- •2. Коллоидная химия
- •2.1. Классификация дисперсных систем
- •2.2. Классификация дисперсных систем по агрегатному состоянию дисперсной фазы
- •2.2. Поверхностные явления
- •2.3. Адсорбция
- •2.4. Коллоидные растворы (золи)
- •2.4.1. Характеристика коллоидных растворов
- •2.4.2. Растворы высокомолекулярных соединений
- •II. Биологическая химия
- •3. Белки
- •3.1. Общая характеристика белков
- •3.3. Методы выделения, фракционирования и очистки белков
- •3.3.1. Методы выделения белков
- •3.4. Физико-химические свойства белков
- •3.5. Аминокислоты
- •3.6. Структура белковой молекулы
- •I'm 1.8. Денатурация и ренатурация рибонукле- азы (по Анфинсену):
- •3.7. Классификация белков
- •3.7.1. Простые белки
- •3.7.2. Сложные белки
- •4. Нуклеиновые кислоты
- •4.1. Общая характеристика нуклеиновых кислот
- •4.2. Нуклеотиды и нуклеозиды
- •4.3. Дезоксирибонуклеиновая кислота
- •4.4. Рибонуклеиновые кислоты
- •5. Углеводы 5.1. Общая характеристика углеводов
- •5.2. Моносахариды
- •5.3. Олигосахариды
- •5.4. Полисахариды (глюканы)
- •6. Липиды
- •6.1. Общая характеристика липидов
- •6.2. Простые липиды
- •6.3. Сложные липиды
- •6.4. Двойной липидный слой клеточных мембран
- •Контрольные вопросы и задания
- •7. Витамины
- •7.1. Общая характеристика витаминов
- •7.2. Классификация и номенклатура витаминов
- •7.2.1. Жирорастворимые витамины
- •7.2.2. Водорастворимые витамины
- •8. Ферменты 8.1. Общая характеристика ферментов
- •8.3. Общие свойства ферментов
- •8.4. Активирование и ингибирование ферментов
- •8.2. Участие ионов металлов в активировании ферментов
- •8.5. Классификация и номенклатура ферментов
- •III класс. Гидролазы. Они разрывают внутримолекулярные связи путем присоединения
- •8.6. Применение ферментов
- •9. Гормоны
- •9.1. Уровни регуляции гормонов
- •9.2. Гормоны, выделяемые железами внутренней секреции
- •9.3. Гормоны местного действия
- •11. Обмен углеводов
- •11.1. Переваривание углеводов в пищеварительном тракте
- •11.2. Катаболизм глюкозы
- •11.3. Цикл трикарбоновых кислот
- •11.4. Пентозофосфатный путь окисления глюкозо-6-фосфата
- •11.5. Биосинтез углеводов
- •11.6. Регуляция обмена углеводов
- •12. Обмен липидов
- •12.1. Переваривание липидов в пищеварительном тракте
- •12.2. Промежуточный обмен липидов
- •2. Если синтезируется много сн3—со—КоА, а энергии для синтеза жира недостаточно, то образуется активированная ацетоуксусная кислота:
- •12.3. Биосинтез липидов
- •12.4. Метаболизм стеринов и стеридов
- •13. Обмен белков
- •13.2. Биологическая ценность белков
- •13.3. Особенности переваривания белков у моногастричных животных
- •13.4. Особенности переваривания белков у жвачных
- •13.5. Метаболизм белков в тканях
- •13.6. Особенности обмена отдельных аминокислот
- •13.7. Биосинтез белка
- •14. Обмен нуклеиновых кислот
- •14.1. Переваривание нуклеиновых кислот в пищеварительном тракте
- •14.2. Промежуточный обмен нуклеиновых кислот (распад нуклеиновых кислот в тканях)
- •14.3. Биосинтез нуклеиновых кислот
- •14.4. Рекомбинантные молекулы и проблемы генной
- •15. Обмен воды и солей
- •15.1. Содержание и роль воды в организме
- •15.2. Электролиты тканей
- •15.3. Потребность организма в минеральных веществах, их поступление и выделение
- •16. Взаимосвязь обмена белков, жиров и углеводов
- •17. Биохимия крови
- •18. Биохимия нервной ткани
- •18.1. Химический состав нервной ткани
- •18.2. Обмен веществ в нервной ткани
- •18.3. Химизм передачи нервного импульса
- •19. Биохимия мышечной ткани
- •19.1. Морфология и биохимический состав мышечной ткани
- •19.2. Механизм сокращения мышцы
- •19.3. Окоченение мышц
- •20. Биохимия молока и молокообразования
- •21. Биохимия почек и мочи
- •22. Биохимия кожи и шерсти
- •23. Биохимия яйца
- •Приложение
2.4. Коллоидные растворы (золи)
2.4.1. Характеристика коллоидных растворов
Получение коллоидных растворов. Коллоидные системы по степени дисперсности занимают промежуточное положение между грубодисперсными системами и истинными растворами. Поэтому их можно получать тремя путями:
методами диспергирования — дроблением более крупных частиц до коллоидной степени дисперсности — механическим, электрическимим, ультразвуком, пептизацией (превращение осадков в коллоидный раствор под влиянием химических веществ — пептизаторов);
методами конденсации — укрупнением частиц в агрегаты коллоидной степени дисперсности (получение нерастворимых веществ в результате реакций различных типов);
ультрафильтрацией через полупроницаемые мембраны.
Строение коллоидных частиц. Для получения коллоидных растворов методом конденсации необходимо соблюдать два условия. Одно из них — образование нерастворимого вещества в результате химической реакции. Другое не менее важное условие — неравенство эквивалентов исходных веществ, взятых в реакцию. Следствием этого неравенства является ограничение роста величины частиц в коллоидных растворах, которое привело бы к образованию грубодисперсной системы.
Механизм образования коллоидной частицы рассмотрим на примере образования золя иодида серебра, который получается при взаимодействии разбавленных растворов нитрата серебра и йодида калия:
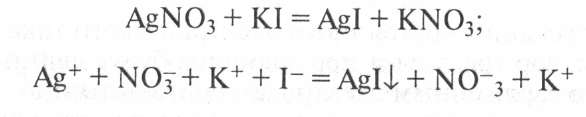
Нерастворимые нейтральные молекулы иодида серебра образуют ядро коллоидной частицы. Сначала эти молекулы соединяются в беспорядке, образуя аморфную, рыхлую структуру, которая постепенно превращается в высокоупорядоченную кристаллическую структуру ядра. В рассматриваемом нами примере ядро — это кристаллик иодида серебра, состоящий из большого числа (т) молекул Agl:
![]()
На поверхности ядра происходит адсорбционный процесс. Согласно правилу Пескова—Фаянса на поверхности ядер коллоидных частиц адсорбируются ионы, входящие в состав ядра частицы, т. е. ионы серебра (Ag+) или ионы йода (I-). Из ионов этих двух видов адсорбируются те, которые находятся в избытке.
Так, если получать коллоидный раствор в избытке иодида калия, то адсорбироваться на частицах (ядрах) будут ионы иода, ко- торые достраивают кристаллическую решетку ядра, естественно и прочно входя в его структуру. При этом образуется адсорбционный слой, который придает ядру отрицательный заряд:
![]()
Ионы, адсорбирующиеся на поверхности ядра, придавая ему соответствующий заряд, называются потенциалобразующими ионами. При этом в растворе находятся и противоположно заряженные ионы, их называют противоионами. В нашем случае это ионы калия (К+), которые электростатически притягиваются к заряженному ядру (величина заряда может достигать 1 В). Часть противо- ионов К+ прочно связывается электрическими и адсорбционными силами и входит в адсорбционный слой. Ядро с образовавшимся на нем двойным адсорбционным слоем ионов называется гранулой. Структуру гранулы можно представить в следующем виде:
![]()
Оставшаяся часть противоионов (обозначим их числом «хК+») образует диффузный слой ионов.
Ядро с адсорбционным и диффузным слоями называется мицеллой. Структуру мицеллы можно представить следующим образом:
![]()
При пропускании постоянного электрического тока через коллоидный раствор гранулы и противоионы будут двигаться к противоположно заряженным электродам соответственно.
Наличие одноименного заряда на поверхности частиц золей представляет собой важный фактор его устойчивости. Заряд препятствует слипанию и укрупнению частиц. В устойчивой дисперсной системе частицы удерживаются во взвешенном состоянии, т. е. коллоидное вещество не выпадает в осадок. Это свойство золей называют кинетической устойчивостью.
Строение мицелл золя иодида серебра представлено на рисунке 2.3.
Методы очистки коллоидных растворов. Коллоидные растворы, полученные различными методами, как правило, содержат низкомолекулярные примеси. Они возникают вследствие загрязненности реагирующих веществ примесями других соединений или образуются в ходе химических реакций.
Т. Грэм предложил метод очистки золей с использованием мембраны, пропускающей ионы и небольшие молекулы, но задерживающей крупные коллоидные растворы, в том числе и высокомолекулярные соединения. Он назвал этот метод диализом, а прибор — диализатором.
В настоящее время диализ ведут через мембрану из коллодия (раствор нитроклетчатки в спиртоэфирной смеси). Подлежащий очистке золь наливают в мешочек из коллодия и помещают его в сосуд с дистиллированной водой. Частицы низкомолекулярных

веществ диффундируют через мембрану в воду, которую периодически меняют. В мешочке остается чистый раствор золя.
Коагуляция. Седиментация. Коллоидные растворы благодаря большой удельной поверхности обладают большой поверхностной •иергией и поэтому, согласно второму закону термодинамики, характеризуются относительно малой устойчивостью. Такие системы стремятся самопроизвольно перейти в устойчивое состояние путем уменьшения запаса свободной поверхностной энергии, что достигается за счет слипания частиц золей с образованием крупных агрегатов. Золи обладают различной устойчивостью. Некоторые из них живут секунды, но есть и такие, которые существуют годы. Так, золи золота, приготовленные М. Фарадеем более 140 лет назад, сохранили свою устойчивость до настоящего времени.
Устойчивость золей обусловлена тем, что при сближении одноименно заряженных частиц они отталкиваются друг от друга. Таким образом, одним из факторов устойчивости золей является заряд гранул.
Другой фактор — образование гидратной оболочки у ионов диффузного слоя. Гидратная оболочка препятствует проникновению ионов диффузного слоя в адсорбционный слой, т. е. мешает нейтрализации заряда гранулы. Если каким-либо способом разрушить эту оболочку (т. е. вызвать дегидратацию ионов), то произойдет полная нейтрализация зарядов потенциалобразующих ионов, т. е. коллоидная частица потеряет заряд. Такое состояние золя называется изоэлектрическим состоянием (ИЭС), а значение рН в этом состоянии — изоэлектрической точкой (ИЭТ). В этом состоянии коллоидные частицы легко слипаются в большие агрегаты (коагуляция) и выпадают в осадок (седиментация).
Дегидратацию, так же, как и коагуляцию, можно вызвать повышением температуры, добавлением электролитов, механическим воздействием, ультразвуком и др.
Наименьшее количество электролита, которое вызывает начало явной коагуляции, определяет порог коагуляции золя. Коагуляцию вызывают ионы, противоположные по знаку потенциалобразующим ионам.
Согласно правилу Шульце—Гарди, чем выше заряд коагулирующего иона, тем сильнее выражена его коагулирующая способность. Коагуляцию можно наблюдать и в том случае, если к одному золю добавить другой золь с противоположным зарядом (взаимная коагуляция). При этом в осадок выпадают оба золя.
Устойчивость коллоидного раствора можно увеличить, добавляя к нему небольшое количество раствора высокомолекулярного вещества. Это явление называется коллоидной защитой.
Молекулярно-кинетические свойства коллоидных растворов. Мо- лекулярно-кинетические свойства золей связаны с движением частиц дисперсной фазы. Особенности молекулярно-кинетических свойств золей зависят в основном от степени дисперсности частиц (от их величины) и проявляются в сотни и тысячи раз слабее, чем у истинных растворов.
Броуновское движение выражается в том, что частицы дисперсной фазы под влиянием ударов молекул растворителя находятся в состоянии непрерывного хаотического движения. Впервые его обнаружил английский ботаник Р. Броун, наблюдая за пыльцой растений в воде. Чем меньше размер частиц, тем интенсивнее их движение. Следовательно, броуновское движение золей замедленно по сравнению с таковым истинных растворов. С повышением температуры интенсивность броуновского движения возрастает.
Диффузия — это самопроизвольный процесс выравнивания концентрации дисперсной фазы по всему объему дисперсионной среды за счет броуновского движения. Скорость диффузии прямо пропорциональна степени невыравненности концентрации и зависит также от величины и формы частиц, температуры и обратно пропорциональна размеру частиц и вязкости дисперсионной среды. Таким образом, при одинаковой температуре скорость диффузии в коллоидных растворах будет в сотни и тысячи раз меньше чем в истинных.
Процессы диффузии играют важную роль в организме, прежде всего участвуя в перемещении питательных веществ, продуктов обмена и т. д. Так, продукты переваривания пищи попадают в капилляры кровеносных сосудов путем диффузии их из латеральных клеток стенки кишечника в указанные капилляры. Скорость многих процессов в организме зависит от скорости диффузии реагирующих веществ, а не от химических реакций, которые при участии ферментов (биологических катализаторов) происходят с огромной скоростью.
Осмотическое давление. В природе растворы часто разделены мембраной, проницаемой только для молекул растворителя. В таких случаях между ними возникает явление, называемое осмосом. Осмос — это самопроизвольное проникновение молекул растворителя через мембрану из растворителя в раствор или из раствора с низкой концентрацией в раствор с более высокой концентрацией вещества.
Для возникновения осмоса необходимо растворы разных концентраций привести в соприкосновение через полупроницаемые мембраны, роль которых для водных растворов могут выполнять как животные и растительные мембраны (оболочка бычьего пузыря, стенки кишки, оболочки клеток), так и искусственные мембраны (пленки из коллодия, целлофана, железосинеродистой меди).
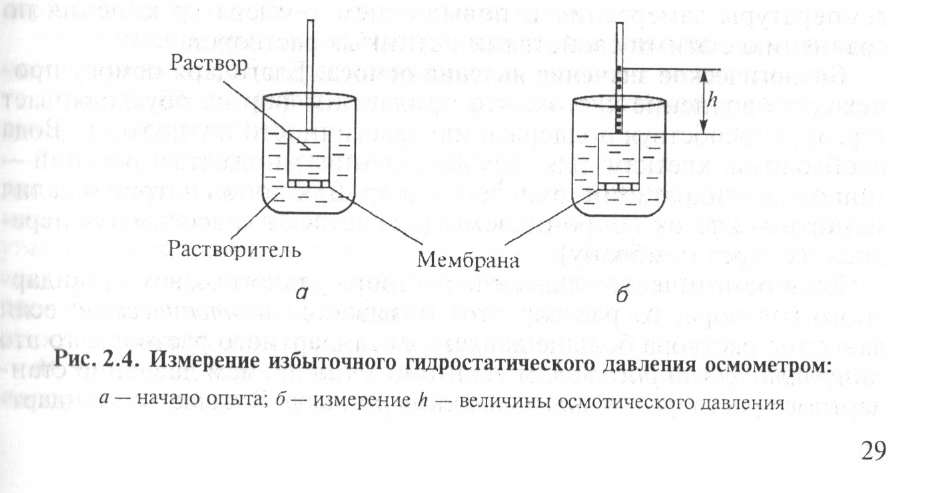
Простейший способ измерения избыточного гидростатического давления представлен на рисунке 2.4.
Высота столба жидкости в цилиндрической трубке прибора (площадь сечения берется равной 1 см2), при которой устанавливается динамическое равновесие, определяет осмотическое давление раствора.
Осмотическое давление прямо пропорционально числу молекул или коллоидных частиц, содержащихся в единице объема ра- створа, т. е. оно прямо пропорционально концентрации раствора. Кроме того, осмотическое давление прямо пропорционально темпиратере. Я. X. Вант-Гофф объединил две эти закономерности, :ведя их в одну формулу (уравнение Вант-Гоффа):
![]()
Если концентрация раствора равна 1 моль/л, то, согласно закону Вант-Гоффа, осмотическое давление этого раствора при О °С составит:
![]()
Если учесть, что коллоидные частицы во много раз крупнее частиц истинных растворов, то при одной и той же массовой концентрации этих растворов в единице объема золя частиц содержится намного меньше, чем в таком же объеме истинного раствора. Следовательно, осмотическое давление в золях очень мало по сравнению с таковым истинных растворов. Так, осмотическое давление 1%-ного раствора глюкозы равно 67 849,7 Па (509 мм рт. ст.), тогда как давление 1%-ного золя оксида мышьяка (As203) - 3,46 Па (0,026 мм рт. ст.).
Пример: вычислить осмотическое давление 0,5 М раствора сахарозы при 37 °С.
Осмотическое давление вычисляем по формуле

Кроме того, золи характеризуются очень малым понижением температуры замерзания и повышением температур кипения по сравнению с этими свойствами истинных растворов.
Биологическое значение явления осмоса. Благодаря осмосу происходит оводнение клеток, что придает им форму, обусловливает тургор, способствуя поддержанию эластичности и упругости. Вода необходима клеткам для осуществления множества реакций — гидролиза, гидратации, окисления и др. Для ионов натрия и калия мембраны клеток непроницаемы (существуют «насосы» для переноса их через мембрану).
Если осмотическое давление раствора равно таковому стандартного раствора, то раствор этот называется изотоническим; если давление раствора больше давления стандартного раствора, то это гипертонический раствор, и если оно меньше, чем давление стандартного раствора, — гипотонический раствор. В качестве стандартного раствора принято считать жидкие системы организма. Кровь, лимфа, тканевые жидкости — это водные растворы многих различных молекул и ионов. Их суммарное осмотическое давление при 37 °С равно 7,7 атм., что способствует достаточному оводне- иию клеток и межклеточных структур и нормальному течению многообразных физических и химических процессов. Такое же давление имеет 0,9%-ный (или 0,15 М) раствор хлорида натрия, называемый физиологическим. В настоящее время в качестве заменителей крови используют физиологический раствор, обогащенный другими солями, белками и т. д.
Если живую клетку поместить в гипотонический раствор, например в воду, то она набухнет от поступающих в нее молекул поды и лопнет. Это явление называют лизисом. Лизис эритроцитов получил название гемолиз, так как при этом из клетки выходит гемоглобин и вода окрашивается в красный цвет.
В гипертонических растворах вода, наоборот, уходит из клетки, и она сморщивается. Это явление называют плазмолизом.
У высокоорганизованных животных и человека осмотическое давление весьма постоянно. Это явление называют изоосмией, оно входит в понятие гомеостаза. Понижение осмотического давления путем введения больших количеств воды или в результате интенсивной потери солей с потом, мочой может вызвать рвоту, судороги и даже гибель.
Повышение осмотического давления введением больших количеств солей приводит к перераспределению солей. Вода скапливается в тех тканях, в которых откладываются избыточные количества солей, вызывая их отеки, в то же время обезвоживание слизистых оболочек вызывает чувство жажды, нарушает нормальную деятельность нервной системы и других органов. В сохранении изоосмии участвуют два механизма: свойства некоторых тканей (печень, подкожная клетчатка) задерживать в себе избыточные количества солей;
способность организма быстро выводить соли с мочой и потом; особую роль в этом играют почки.
Эти процессы регулируются нервной системой и железами внутренней секреции.
В ограниченных участках тканей изменения осмотического давления могут быть большими. Так, при локальном воспалении происходит распад белка на мелкие фрагменты и, следовательно, увеличивается концентрация веществ в этой зоне. Вода устремляется в этот очаг, повышая осмотическое давление, которое вызывает ощущение боли. Если разрезать воспаленный участок, боль утихнет, так как жидкость при этом вытекает.
В хирургии применяют гипертонические повязки — марлевые полоски, смоченные в гипертонических растворах NaCl и введенные в гнойные раны. Жидкость из раны оттекает по марле наружу, выводя с собой гной, микроорганизмы и т. д.
Применение при консервировании больших количеств сахара или соли приводит к плазмолизу микроорганизмов.
При экспериментальных исследованиях на выделенных из организма органах и тканях необходимо создавать изотоническую среду.
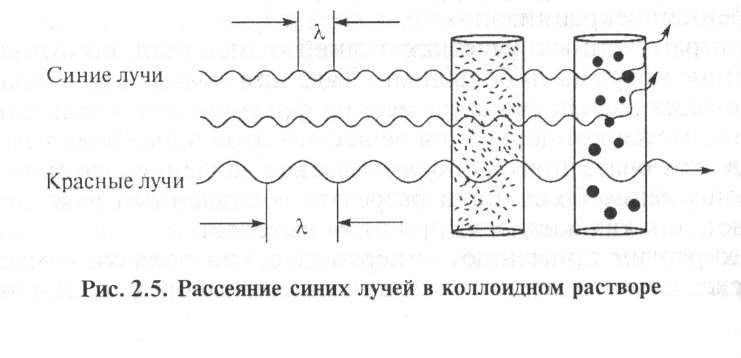
Оптические свойства коллоидных систем. Наиболее характерное оптическое свойство коллоидных растворов — опалесценция. Выражается это в том, что золь несколько мутноват и его окраска изменяется в проходящем и отраженном свете. В основе данных процессов лежит рассеяние света коллоидными частицами. В истинных растворах молекулы и ионы не препятствуют прохождению лучей света (растворы оптически пусты).
В коллоидных растворах размер частиц соизмерим с длиной волн видимого света. Поэтому лучи, проходя через золи, не могут обойти такие частицы. Они беспорядочно отражаются и преломляются на границе раздела частиц со средой, обусловливая мутность коллоидных растворов и грубодисперсных систем. При этом отраженный свет голубоватый. Объясняется это тем, что лучи с меньшей длиной волн (голубые и синие) рассеиваются больше, чем длинноволновые красные лучи (рис. 2.5). Так, голубоватый оттенок имеют разбавленное молоко, морская волна, табачный дым.
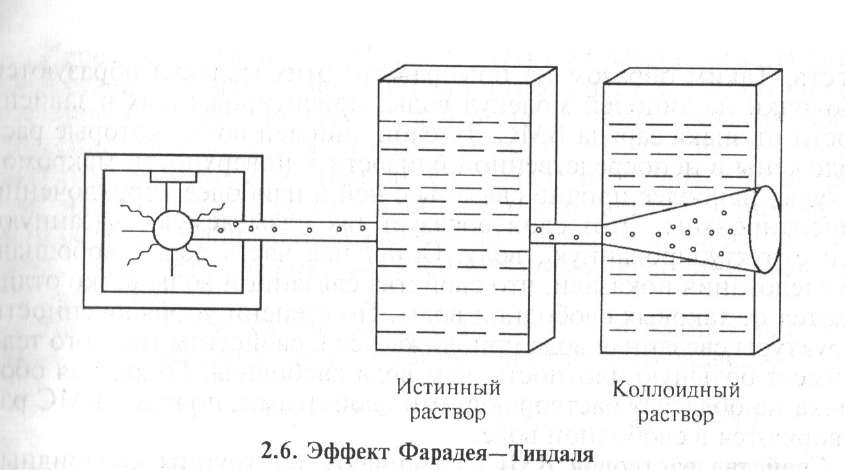
Если луч света пропустить через коллоидный раствор в темноте, то возникнет светящийся след светового потока в виде конуса. Такой же след возникает при прохождении луча прожектора в ночном небе, при свете фар в туманную погоду и т. д. Впервые явление рассеяния света коллоидными растворами наблюдал М. Фа- радей. Позднее Д. Тиндаль исследовал это явление более подробно. Поэтому этот эффект носит название эффект Фарадея—Тиндаля (рис. 2.6).
В истинных растворах это явление не наблюдается. Данным эффектом пользуются для того, чтобы решить вопрос о том, относится ли система к коллоидным растворам.
Сосуд,
ближаиший к источнику света, содержит
концентрированный раствор сахара, во
втором сосуде — коллоидный раствор.
Световой поток в виде конуса виден во
втором сосуде, через первый сосуд
свет проходит нерассеянным