
- •I. Физколлоидная химия
- •1. Физическая химия
- •1.1. Вода
- •1.1.1. Вода как уникальная молекула жизни
- •1.1.3. Буферные растворы
- •1.2. Биоэнергетика клетки
- •1.3. Термохимия
- •1.4. Химическая кинетика и катализ
- •2. Коллоидная химия
- •2.1. Классификация дисперсных систем
- •2.2. Классификация дисперсных систем по агрегатному состоянию дисперсной фазы
- •2.2. Поверхностные явления
- •2.3. Адсорбция
- •2.4. Коллоидные растворы (золи)
- •2.4.1. Характеристика коллоидных растворов
- •2.4.2. Растворы высокомолекулярных соединений
- •II. Биологическая химия
- •3. Белки
- •3.1. Общая характеристика белков
- •3.3. Методы выделения, фракционирования и очистки белков
- •3.3.1. Методы выделения белков
- •3.4. Физико-химические свойства белков
- •3.5. Аминокислоты
- •3.6. Структура белковой молекулы
- •I'm 1.8. Денатурация и ренатурация рибонукле- азы (по Анфинсену):
- •3.7. Классификация белков
- •3.7.1. Простые белки
- •3.7.2. Сложные белки
- •4. Нуклеиновые кислоты
- •4.1. Общая характеристика нуклеиновых кислот
- •4.2. Нуклеотиды и нуклеозиды
- •4.3. Дезоксирибонуклеиновая кислота
- •4.4. Рибонуклеиновые кислоты
- •5. Углеводы 5.1. Общая характеристика углеводов
- •5.2. Моносахариды
- •5.3. Олигосахариды
- •5.4. Полисахариды (глюканы)
- •6. Липиды
- •6.1. Общая характеристика липидов
- •6.2. Простые липиды
- •6.3. Сложные липиды
- •6.4. Двойной липидный слой клеточных мембран
- •Контрольные вопросы и задания
- •7. Витамины
- •7.1. Общая характеристика витаминов
- •7.2. Классификация и номенклатура витаминов
- •7.2.1. Жирорастворимые витамины
- •7.2.2. Водорастворимые витамины
- •8. Ферменты 8.1. Общая характеристика ферментов
- •8.3. Общие свойства ферментов
- •8.4. Активирование и ингибирование ферментов
- •8.2. Участие ионов металлов в активировании ферментов
- •8.5. Классификация и номенклатура ферментов
- •III класс. Гидролазы. Они разрывают внутримолекулярные связи путем присоединения
- •8.6. Применение ферментов
- •9. Гормоны
- •9.1. Уровни регуляции гормонов
- •9.2. Гормоны, выделяемые железами внутренней секреции
- •9.3. Гормоны местного действия
- •11. Обмен углеводов
- •11.1. Переваривание углеводов в пищеварительном тракте
- •11.2. Катаболизм глюкозы
- •11.3. Цикл трикарбоновых кислот
- •11.4. Пентозофосфатный путь окисления глюкозо-6-фосфата
- •11.5. Биосинтез углеводов
- •11.6. Регуляция обмена углеводов
- •12. Обмен липидов
- •12.1. Переваривание липидов в пищеварительном тракте
- •12.2. Промежуточный обмен липидов
- •2. Если синтезируется много сн3—со—КоА, а энергии для синтеза жира недостаточно, то образуется активированная ацетоуксусная кислота:
- •12.3. Биосинтез липидов
- •12.4. Метаболизм стеринов и стеридов
- •13. Обмен белков
- •13.2. Биологическая ценность белков
- •13.3. Особенности переваривания белков у моногастричных животных
- •13.4. Особенности переваривания белков у жвачных
- •13.5. Метаболизм белков в тканях
- •13.6. Особенности обмена отдельных аминокислот
- •13.7. Биосинтез белка
- •14. Обмен нуклеиновых кислот
- •14.1. Переваривание нуклеиновых кислот в пищеварительном тракте
- •14.2. Промежуточный обмен нуклеиновых кислот (распад нуклеиновых кислот в тканях)
- •14.3. Биосинтез нуклеиновых кислот
- •14.4. Рекомбинантные молекулы и проблемы генной
- •15. Обмен воды и солей
- •15.1. Содержание и роль воды в организме
- •15.2. Электролиты тканей
- •15.3. Потребность организма в минеральных веществах, их поступление и выделение
- •16. Взаимосвязь обмена белков, жиров и углеводов
- •17. Биохимия крови
- •18. Биохимия нервной ткани
- •18.1. Химический состав нервной ткани
- •18.2. Обмен веществ в нервной ткани
- •18.3. Химизм передачи нервного импульса
- •19. Биохимия мышечной ткани
- •19.1. Морфология и биохимический состав мышечной ткани
- •19.2. Механизм сокращения мышцы
- •19.3. Окоченение мышц
- •20. Биохимия молока и молокообразования
- •21. Биохимия почек и мочи
- •22. Биохимия кожи и шерсти
- •23. Биохимия яйца
- •Приложение
13.7. Биосинтез белка
Основные участники биосинтеза белка. Биосинтез белка представляет собой сложный процесс, происходящий во всех клетках, органах и тканях организма. Наибольшее количество белка синтезируется в печени. Белоксинтезирующая система включает около 300 соединений, в том числе:
набор всех 20 аминокислот, из которых синтезируется белок; минимум 20 различных тРНК;
минимум 20 различных ферментов — аминоацил-тРНК-синтетаз, обладающих специфичностью к определенной аминокислоте;
рибосомы, АТФ и АТФ-генерирующую систему ферментов; ГТФ, ионы Mg+2, иРНК, несущую информацию о синтезируемом белке;
белковые факторы, принимающие участие на различных этапах синтеза белка.
Рибосомы — рибонуклеопротеиды, состоящие из рибосомаль- ной РНК (50...65 %) и белка (35...50 %). Известно, что рибосомы животных клеток (эукариот) в 2 раза крупнее (80S) рибосом бактерий (прокариот) (70S). Рибосомы состоят из двух частиц: 60S и 40S (рибосомы животных клеток — 80S) и 50S и 30S (рибосомы бактерий — 70S). Число рибосом в одной клетке составляет приблизительно 100 000. В присутствии ионов Mg+2 рибосомы распадаются на две части (60S и 40S). Рибосома животных клеток содержит три вида РНК 28S, 18S и 5S и свыше 70 различных белков.
Общую схему строения рибосом животных клеток можно представить в следующем виде:

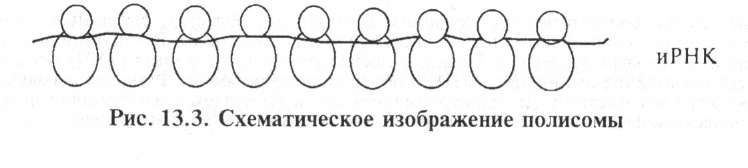
РНК рибосом синтезируется на матрице ДНК в ядре. Рибосом- ные белки имеют цитоплазматическое происхождение, затем они транспортируются в ядрышки, где формируются рибосомные субъединицы. После этого субъединицы переходят в цитоплазму и несколько рибосом (до 50...80 рибосом), вместе с информационной РНК образуют полисомы, или полирибосомы — место синтеза белка (рис. 13.3).
Аминоацил-тРНК-синтетазы — это ферменты с молекулярной массой -100 000, обеспечивающие активирование аминокислот и связывание их с тРНК. Эти ферменты абсолютно специфичны, т. е. узнают только одну какую-либо аминокислоту и тРНК. Полагают, что этот фермент имеет три активных центра связывания: для аминокислоты, тРНК и АТФ. Число этих ферментов должно быть не менее 20 — для каждой аминокислоты отдельно.
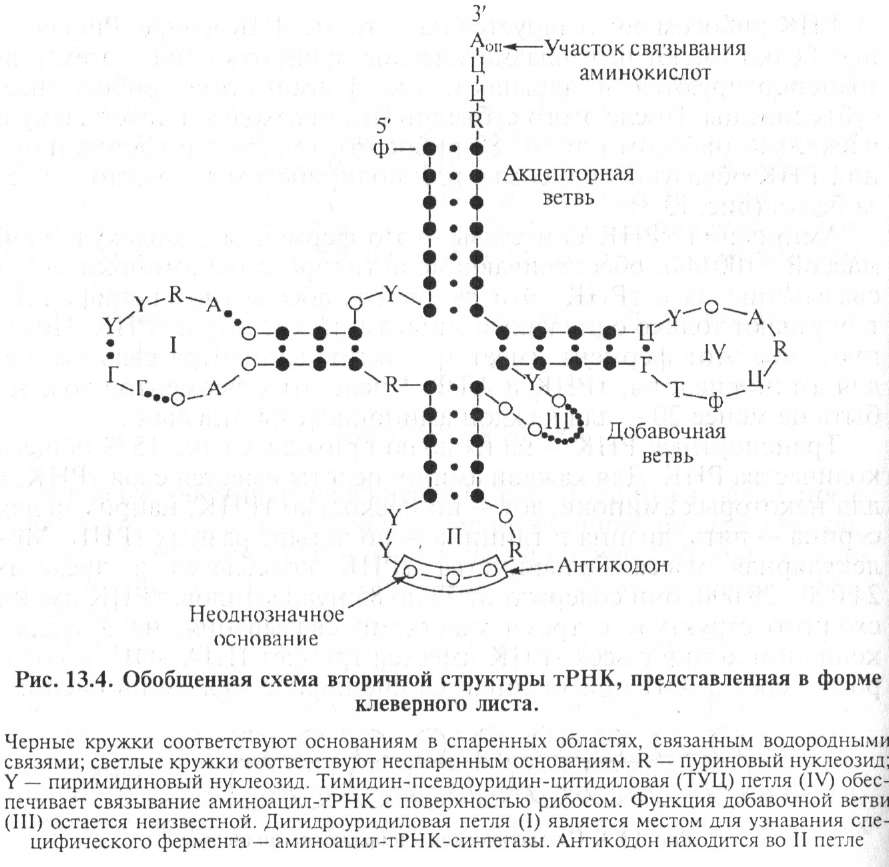
Транспортные РНК — на их долю приходится 10... 15 % общего количества РНК. Для каждой аминокислоты имеется своя тРНК, а для некоторых аминокислот — по несколько тРНК, например для серина — пять, лизина и глицина — по четыре разных тРНК. Молекулярная масса большинства тРНК колеблется в пределах 24 000...29 000, они содержат от 75 до 85 нуклеотидов. тРНК имеют сходную структуру с тремя участками связывания: на З'-гидро- ксильном конце у всех тРНК имеется триплет ЦЦА—ОН, к которому через З'-ОН присоединяется специфическая аминокислота.
Следующий связывающий участок — антикодон из трех нуклеотидов. Антикодон комплементарен кодону иРНК. Например,

5 -Концевой нуклеотид во всех тРНК — это 1 МФ со свободной 5'-фосфатной группой (рис. 13.4).
Функция тРНК — специфическое связывание каждой тРНК со своей аминокислотой.
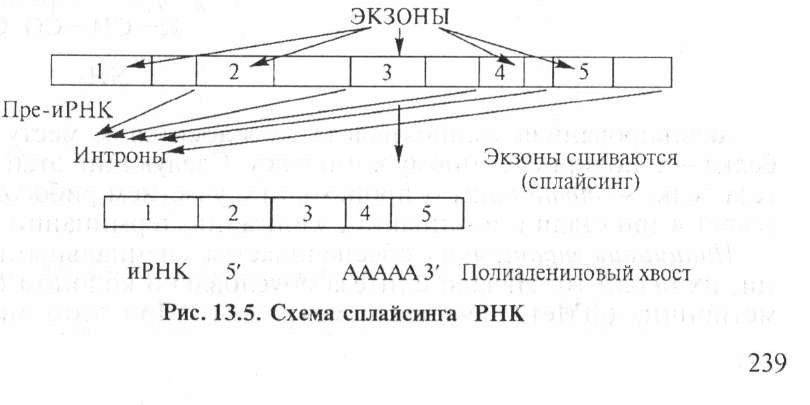
гена, цистрона). Размер молекулы зависит от размера белка. Молекула иРНК образуется в виде предшественника, затем происходит созревание, т. е. удаляются участки, не входящие в состав зрелой молекулы (интронов) (рис. 13.5).
Участки экзонов сшиваются в процессе созревания иРНК. Полиадениловый хвост на З'-конце обеспечивает стабильность иРНК. иРНК комплементарна определенному участку молекулы ДНК, например:
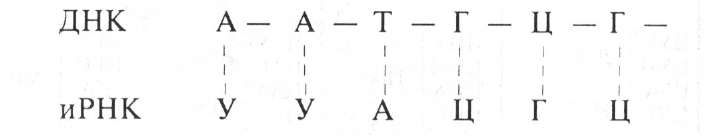
Генетическии код. Генетическая информация закодирована в ДНК в виде последовательности нуклеотидов и эта последовательность переводится в нуклеотидную последовательность и РНК. Код является триплетным, т. е. информация для каждой аминокислоты состоит из трех нуклеотидов. Например, для включения в белковую молекулу фенилаланина код содержит УУУ-триплет из молекул уридиловой кислоты (рис. 13.6). Генетический код является вырожденным, т. е. для кодирования одной аминокислоты имеется несколько кодонов; непрерывным, т. е. отсутствуют знаки, сигналы, обозначающие начало и конец кода (например, АЦЦЦТ- ГААЦ и т. д.); универсальным для всех живых систем от Escherichia coli до человека. Из возможных 64 кодонов 61 имеет смысл, т. е. кодируют определенную аминокислоту, а кодоны УАГ, УАА, УГА кодируют терминацию.
Этапы биосинтеза белка. В процесс биосинтеза белка (рис. 13.7) включается около 300 типов макромолекул — белков и нуклеиновых кислот; из них около 100 участвуют в активировании аминокислот и переносе их на рибосомы, свыше 60 находятся в составе рибосом, свыше 10 белковых факторов участвуют в процессах трансляции. Синтез идет в направлении от свободного аминного конца к свободному карбоксильному концу: NH2 СООН.

Активированная аминокислота переносится к месту синтеза белка — к полирибосомному комплексу. Следующий этап биосинтеза белка — трансляция — происходит с участием рибосом и протекает в три стадии: инициации, элонгации, терминации.
Инициация трансляции обеспечивается специальными белками, их около 10. Начало синтеза обусловлено кодоном формил- метионина (фМет, начальный метионин). При этом антикодон
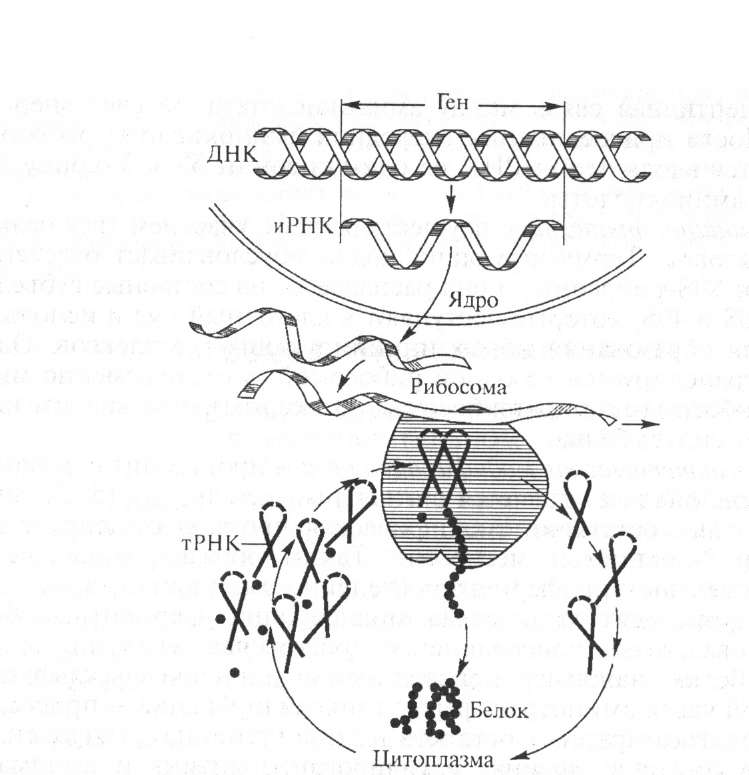
Рис. 13.7. Принципиальная схема биосинтеза белка (по А. С. Спирину)
Мет-тРНК УАЦ соединяется с кодоном АУГ иРНК, образуется инициирующий комплекс: к 405-субъединице рибосомы присоединяется Мет-тРНК, затем 608-субъединица рибосомы (рис. 13.8).
После образования инициирующего комплекса начинается элонгация, т. е. удлинение полипептидной цепи. В рибосоме обра-
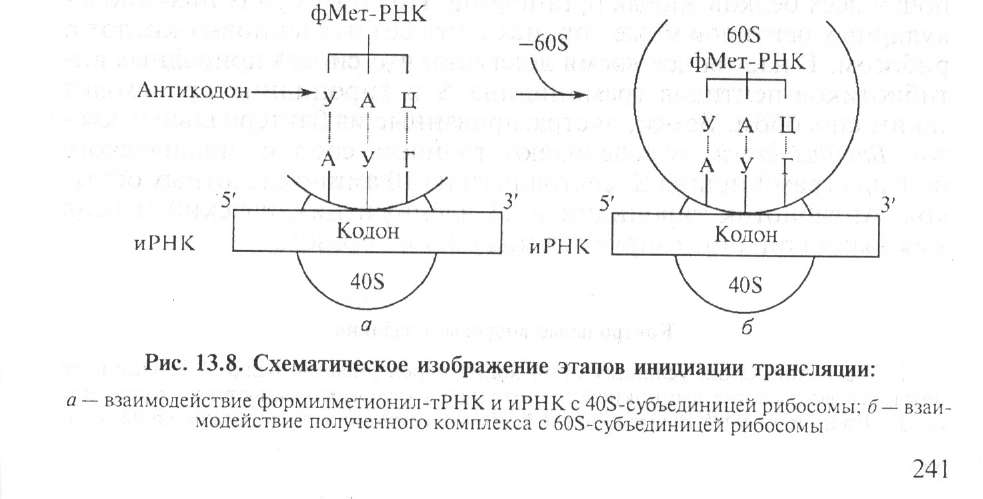
зуется пептидная связь между аминокислотами за счет энергии ГТФ. После присоединения очередной аминокислоты рибосома сдвигается вдоль цепи иРНК на один кодон от 5'- к З'-концу для каждой аминокислоты.
Терминация трансляции осуществляется с участием трех белковых факторов. Терминирующий кодон обусловливает отделение иРНК от SOS-рибосомы, и она распадается на составные субъединицы 60S и 40S, которые поступают в клеточный пул и используются для образования новых инициирующих комплексов. Одна иРНК транслируется не одной рибосомой, а одновременно многими рибосомами (полирибосомы, полисомы), что значительно ускоряет синтез белка.
Постсинтетическая модификация белков происходит в несколько этапов: вначале удаляется сигнальный пептид (из 15...30 аминокислотных остатков), специфическая протеаза отщепляет начальный N-концевой метионин. Таким образом отщепляется часть молекулы у проферментов (пепсиноген, проинсулин и т.д.). Затем происходит химическая модификация ферментных белков — ковалентное присоединение простетической группы к молекуле белка, например присоединение пиридоксальсульфата к белковой части аминотрансфераз; гликозилирование — присоединение олигосахаридных остатков в гликопротеинах; гидроксили- рование пролина, лизина; метилирование лизина и глутамата; ацетилирование N-концевых аминокислот; фосфорилирование серина, треонина, тирозина и т.д. Укладка белковой молекулы (образование вторичной, третичной и четвертичной структур) также происходит после синтеза — образования первичной структуры белковой молекулы.
Мультиферментный механизм синтеза белка. Описанный выше матричный механизм биосинтеза белков лежит в основе синтеза почти всех белков живых организмов. Но синтез ряда низкомолекулярных пептидов может происходить без нуклеиновых кислот и рибосом. В настоящее время доказано, что синтез природных ан- тибиотиков-пептидов грамицидина S и тироцидина происходит таким способом. Белки, экстрагированные из бактериальных клеток Bacillus brevis, обеспечивают точность сборки циклического пептида грамицидина S, состоящего из 10 аминокислотных остатков. Антибиотик тироцидин и 13-членный циклический пептид микобациллин синтезируются подобным образом.
Контрольные вопросы и задания
1. Где и при каких условиях происходит переваривание белков? 2. Опишите механизм всасывания аминокислот эпителиальными клетками стенки кишечника. 3. Охарактеризуйте промежуточный обмен аминокислот, назовите виды дезаминирования и покажите химизм этих процессов; напишите схему реакций декарбоксилирования аминокислот. 4. Укажите способы обезвреживания аммиака в организме животных. 5. Опишите химизм биосинтеза мочевины в клетках печени животного. 6. В чем заключается процесс гниения белков, где он происходит? 7. Как обезвреживаются ядовитые продукты гниения белков? 8. Назовите этапы биосинтеза белков в клетке и его главных участников. 9. Что такое процессинг белковой молекулы? 10. В чем заключается особенность обмена белков у жвачных животных?
