
- •I. Физколлоидная химия
- •1. Физическая химия
- •1.1. Вода
- •1.1.1. Вода как уникальная молекула жизни
- •1.1.3. Буферные растворы
- •1.2. Биоэнергетика клетки
- •1.3. Термохимия
- •1.4. Химическая кинетика и катализ
- •2. Коллоидная химия
- •2.1. Классификация дисперсных систем
- •2.2. Классификация дисперсных систем по агрегатному состоянию дисперсной фазы
- •2.2. Поверхностные явления
- •2.3. Адсорбция
- •2.4. Коллоидные растворы (золи)
- •2.4.1. Характеристика коллоидных растворов
- •2.4.2. Растворы высокомолекулярных соединений
- •II. Биологическая химия
- •3. Белки
- •3.1. Общая характеристика белков
- •3.3. Методы выделения, фракционирования и очистки белков
- •3.3.1. Методы выделения белков
- •3.4. Физико-химические свойства белков
- •3.5. Аминокислоты
- •3.6. Структура белковой молекулы
- •I'm 1.8. Денатурация и ренатурация рибонукле- азы (по Анфинсену):
- •3.7. Классификация белков
- •3.7.1. Простые белки
- •3.7.2. Сложные белки
- •4. Нуклеиновые кислоты
- •4.1. Общая характеристика нуклеиновых кислот
- •4.2. Нуклеотиды и нуклеозиды
- •4.3. Дезоксирибонуклеиновая кислота
- •4.4. Рибонуклеиновые кислоты
- •5. Углеводы 5.1. Общая характеристика углеводов
- •5.2. Моносахариды
- •5.3. Олигосахариды
- •5.4. Полисахариды (глюканы)
- •6. Липиды
- •6.1. Общая характеристика липидов
- •6.2. Простые липиды
- •6.3. Сложные липиды
- •6.4. Двойной липидный слой клеточных мембран
- •Контрольные вопросы и задания
- •7. Витамины
- •7.1. Общая характеристика витаминов
- •7.2. Классификация и номенклатура витаминов
- •7.2.1. Жирорастворимые витамины
- •7.2.2. Водорастворимые витамины
- •8. Ферменты 8.1. Общая характеристика ферментов
- •8.3. Общие свойства ферментов
- •8.4. Активирование и ингибирование ферментов
- •8.2. Участие ионов металлов в активировании ферментов
- •8.5. Классификация и номенклатура ферментов
- •III класс. Гидролазы. Они разрывают внутримолекулярные связи путем присоединения
- •8.6. Применение ферментов
- •9. Гормоны
- •9.1. Уровни регуляции гормонов
- •9.2. Гормоны, выделяемые железами внутренней секреции
- •9.3. Гормоны местного действия
- •11. Обмен углеводов
- •11.1. Переваривание углеводов в пищеварительном тракте
- •11.2. Катаболизм глюкозы
- •11.3. Цикл трикарбоновых кислот
- •11.4. Пентозофосфатный путь окисления глюкозо-6-фосфата
- •11.5. Биосинтез углеводов
- •11.6. Регуляция обмена углеводов
- •12. Обмен липидов
- •12.1. Переваривание липидов в пищеварительном тракте
- •12.2. Промежуточный обмен липидов
- •2. Если синтезируется много сн3—со—КоА, а энергии для синтеза жира недостаточно, то образуется активированная ацетоуксусная кислота:
- •12.3. Биосинтез липидов
- •12.4. Метаболизм стеринов и стеридов
- •13. Обмен белков
- •13.2. Биологическая ценность белков
- •13.3. Особенности переваривания белков у моногастричных животных
- •13.4. Особенности переваривания белков у жвачных
- •13.5. Метаболизм белков в тканях
- •13.6. Особенности обмена отдельных аминокислот
- •13.7. Биосинтез белка
- •14. Обмен нуклеиновых кислот
- •14.1. Переваривание нуклеиновых кислот в пищеварительном тракте
- •14.2. Промежуточный обмен нуклеиновых кислот (распад нуклеиновых кислот в тканях)
- •14.3. Биосинтез нуклеиновых кислот
- •14.4. Рекомбинантные молекулы и проблемы генной
- •15. Обмен воды и солей
- •15.1. Содержание и роль воды в организме
- •15.2. Электролиты тканей
- •15.3. Потребность организма в минеральных веществах, их поступление и выделение
- •16. Взаимосвязь обмена белков, жиров и углеводов
- •17. Биохимия крови
- •18. Биохимия нервной ткани
- •18.1. Химический состав нервной ткани
- •18.2. Обмен веществ в нервной ткани
- •18.3. Химизм передачи нервного импульса
- •19. Биохимия мышечной ткани
- •19.1. Морфология и биохимический состав мышечной ткани
- •19.2. Механизм сокращения мышцы
- •19.3. Окоченение мышц
- •20. Биохимия молока и молокообразования
- •21. Биохимия почек и мочи
- •22. Биохимия кожи и шерсти
- •23. Биохимия яйца
- •Приложение
9.3. Гормоны местного действия
Если гормоны, вырабатываемые железами внутренней секреции, попадают в кровь и через нее — в органы мишени, то влияние гормонов местного действия обычно ограничено и распространяется только на близлежащие клетки. Данные гормоны синтезируют либо специализированные клетки, рассеянные в ткани, либо сами паренхиматозные клетки органа. Между истинными гормонами и гормонами местного действия нет принципиальной разницы, так как они выполняют роль химических сигналов, координирующих функцию клеток и тканей. Либерины и статины гипоталамуса можно отнести к гормонам местного действия, так как они регулируют функцию близко расположенного гипофиза. К гормонам местного действия относятся гистамин и серотонин, производные гистидина и триптофана, простагландины, кинины и гормоны пищеварительного тракта.
Простагландины, тромбоксаны, простациклины — внутриклеточные регуляторы обмена веществ; синтезируются почти во всех органах и тканях из арахидоновой кислоты — полиненасыщенной жирной кислоты. Их функция тесно взаимосвязана с системой аденилатциклаза—цАМФ. Спектр их действия достаточно широкий: они влияют на гемодинамику почек, сократительную функцию гладких мышц и др. Сейчас известно 14 простагландинов. Они нашли широкое применение в медицинской практике и в животноводстве.
Кинины — эта группа небольших пептидов, построенных из остатков 9 аминокислот. Основные из них — брадикинин и лизилбрадикинин (каллидин). Кинины образуются в тканях из предшественников пептидной природы — киногенов. Срок жизни кини- нов невелик — 20...30 с. Действие их заключается в расслаблении гладких мышц кровеносных сосудов, т. е. они обладают сосудорасширяющим эффектом. Брадикинин — самое сильное сосудорасширяющее вещество в организме, снижает кровяное давление. Кинины повышают проницаемость капилляров, вызывают боль при воспалении. Полагают, что кинины наряду с гистамином и простагландинами участвуют в развитии воспалительной реакции.
Опиоидные (эндогенные) пептиды — эндорфины и энкефали- ны — являются индукторами ощущений удовольствия, приятного настроения, состояния эйфории, что объясняется их прямым мор- финоподобным действием на опиоидные рецепторы центральной нервной системы. Они же оказывают болеутоляющее действие, влияют на кровяное давление, двигательную функцию, температуру тела и т.д. Это пептиды, состоящие из 5...31 аминокислотного остатка, образуются из предшественника проопиокортина (молекулярная масса 29 000, 265 аминокислотных остатков) путем селективного гидролиза. Они могут образовываться и при гидролизе белков корма.
Гормоны пищеварительного тракта — их известно более 20, наиболее изучены гастрин I и гастрин II (состоящие соответственно из 17 и 14 аминокислотных остатков); регулируют секрецию желудочного сока.
Прогастрин (34 аминокислотных остатка), секретин (27 аминокислотных остатков), сомастатин образуются в пищеварительном тракте и участвуют в регулировании функции пищеварения.
Лептин; адреномедуллин; белки, родственные паратиреоидному гормону; факторы роста эндотелия сосудов и фибробластов по своему действию относятся к гормонам. Гены этих гормонов активно экспрессируются в различных тканях, которые могут синтезировать и выделять соответствующие гормоны в межклеточное пространство и кровь. Лептин — гормон ожирения, синтезируется в адипоцитах. Органом-мишенью является центральная нервная система, через которую лептин снижает аппетит, уменьшает запасы жира в жировых депо. Адреномедуллин — гормон, состоящий из 52 аминокислотных остатков, обладает сильным сосудорасширяющим эффектом. Белки, родственные па- ратиреоидному гормону, кроме регуляции обмена кальция, оказывают сосудорасширяющее действие в непосредственной близости от места своего синтеза.
Контрольные вопросы и задания
1. Что такое гормоны, какие способы их классификации вы знаете? 2. Перечислите гормоны гипофиза и гипоталамуса. Какова их химическая природа? 3. Перечислите гормоны поджелудочной железы. Каковы их функции? 4. Перечислите гормоны надпочечников. Каковы их функции? 5. Перечислите гормоны щитовидной железы. Какова их роль в регуляции метаболизма? 6. Перечислите гормоны паращитовидной железы. Какова их роль в жизнедеятельности организма? 7. Перечислите половые гормоны. Каковы их функции? 8. Каков механизм действия гормонов — мембраноопосредованный и внутриклеточный?
10. ОБМЕН ВЕЩЕСТВ И ЭНЕРГИИ
Обмен веществ и энергии лежит в основе жизнедеятельности любого организма. Образующаяся в процессе обмена веществ энергия используется для поддержания температуры тела, совершения работы, роста и развития организма, обеспечения структур и функций всех клеточных элементов. Обмен веществ и обмен энергии неразрывно связаны между собой и включают два процесса — ассимиляцию (анаболизм) и диссимиляцию (катаболизм).
Катаболизм и анаболизм. К ат а б о л и з м — это процесс расщепления сложных органических молекул до более простых конечных продуктов. Углеводы, жиры и белки, поступившие извне с кормами и присутствующие в самой клетке в качестве запасных веществ, распадаются в последовательных реакциях до таких соединений, как молочная кислота, С02 и аммиак. Катаболические процессы сопровождаются высвобождением энергии, заключенной в сложной структуре больших органических молекул. Эта энергия запасается в молекулах АТФ (аденозинтрифосфата) и частично в богатых энергией водородных атомах кофермента НАДФН2 — ни- котинамидадениндинуклеотидфосфата, находящегося в восстановленной форме. Ферментативное расщепление белков, углеводов, липидов происходит последовательно через ряд этапов. На первой стадии полисахариды распадаются до моносахаридов, жиры — до жирных кислот, глицерина и других компонентов, а белки — до аминокислот. Все эти компоненты на второй стадии катаболизма превращаются в еще более простые соединения: гексозы, пентозы и глицерин расщепляются до пировиноградной кислоты (пируват), затем до активированной уксусной кислоты — ацетил-коэнзима А. Расщепление жирных кислот и большинства аминокислот также завершается образованием ацетил-КоА. На третьей стадии катаболизма ацетил-КоА вступает в цикл лимонной кислоты, где происходит его окисление до СО2 и Н2О. Схематическое изображение стадий катаболизма представлено на рисунке 10.1.
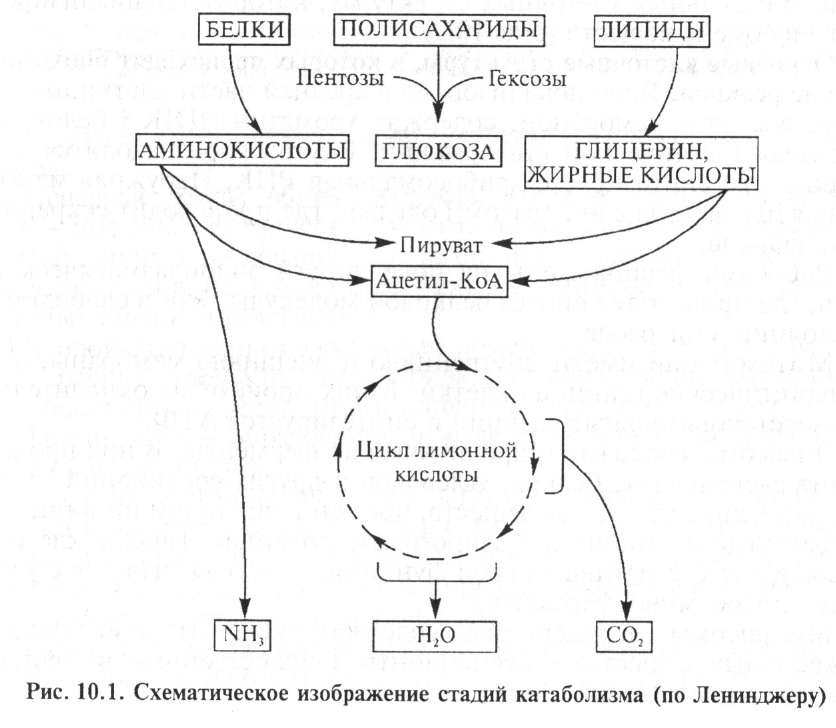
Анаболизм (ассимиляция), или биосинтез, происходит одновременно с катаболизмом, при котором из малых молекул- предшественников синтезируются белки, нуклеиновые кислоты и другие макромолекулярные компоненты клетки, причем этот процесс требует затраты энергии. Источником энергии служат макро- эргические молекулы АТФ, которые распадаются до АДФ и неорганического фосфата, а также НАДФН2. Биосинтез протекает также последовательно.
Синтез белков начинается с образования а-кетокислот и других предшественников. На второй стадии происходит аминирова- ние а-кетокислот — образуются а-аминокислоты. Затем из аминокислот строятся полипептидные цепи и образуются различные белки. Таким же образом синтезируются липиды.
Клетка представляет собой основную единицу всех живых организмов, где происходит обмен веществ.
В процессе эволюции возникли клеточные органеллы, которые обеспечивают последовательность основных химических реакций: ядро, митохондрии, эндоплазматический ретикулум (эндоплазма- тическая сеть), рибосомы, лизосомы, микросомы.
Биохимические процессы происходят в клетке в определенной последовательности с участием ферментов. Ферменты локализованы в отдельных клеточных структурах, которые специализированы в обмене веществ (рис. 10.2).
Основные клеточные структуры, в которых происходят биохимические реакции. Ядро локализовано в средней части клетки, окружено двойной мембраной, содержит хроматин (ДНК + белок) — носитель генетической информации. Внутри ядра находится ядрышко, где синтезируется рибосомальная РНК. Наружная мембрана ядра связана с аппаратом Гольджи, где происходит секреция метаболитов.
Рибосомы расположены на поверхности эндоплазматической сети, где происходит синтез белковой молекулы, или в свободном состоянии в цитозоле.
Митохондрии имеют внутреннюю и внешнюю мембраны, это «энергетические станции» клетки. В них происходят окислитель- но-восстановительные реакции и синтезируется АТФ.
Лизосомы содержат гидролитические ферменты. В них происходит расщепление белков, углеводов и других соединений, подлежащих лизису, а также веществ, поступивших путем пиноцитоза и фагоцитоза. Апоптоз — запрограммированная гибель клеток, лизис клеток, утративших свои функции, — осуществляется с участием лизосомных ферментов.
Рис.
10.2. Строение эукариотической клетки:
/
— ядро; 2—ядрышко;
3
— шероховатый эндоплазматический
ретикулум;
4—
гладкий эндо- плазматический ретикулум;
5— цитозоль, 6— рибосомы; 7—лизосома;
8
— плазматическая мембрана;
9—
митохондрия;
10—
пероксисома;
II
— аппарат Гольджи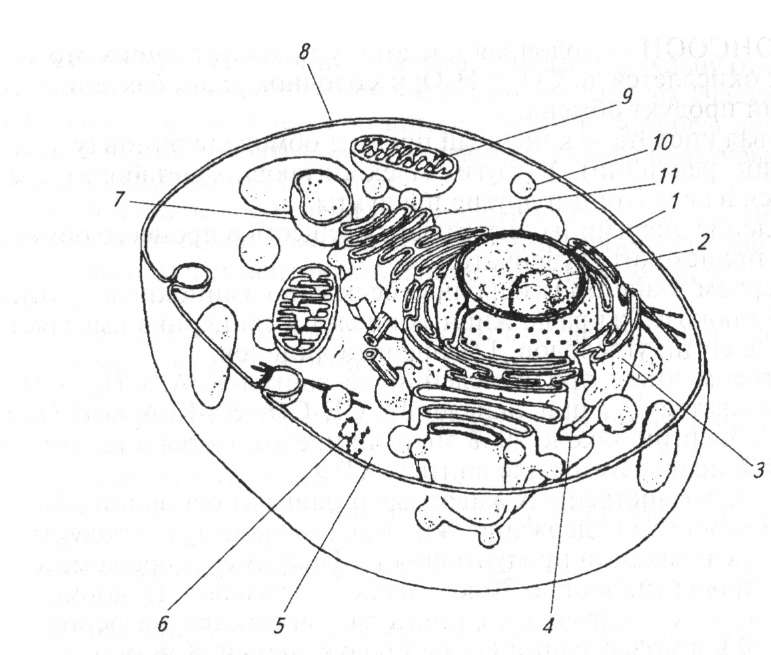
Цитозоль (цитоплазма) содержит ферменты различного назначения.
Основные этапы обмена веществ. Первый этап — пищеварение — процесс механической и химической обработки составных частей пищи в пищеварительных органах — распад углеводов до моносахаридов, белков до аминокислот, липидов до глицерина и жирных кислот и всасывание.
Второй этап — промежуточный обмен. Тканевый обмен включает распад продуктов переваривания, образование различных промежуточных соединений и конечных продуктов обмена.
Третий этап — образование и выделение конечных продуктов обмена из организма.
В процессе обмена веществ в организме образуются метаболиты, которые принимают участие в химических реакциях обмена веществ и влияют на их течение: аминокислоты, жирные и ароматические кислоты, пуриновые и пиримидиновые основания, простые сахара, амины, гормоны, витамины и др.
Одни и те же вещества могут быть метаболитами для одних организмов и конечным продуктом обмена для других. Например, СН3СНОНСООН — молочная кислота, у млекопитающих это метаболит, окисляется до СО, и Н20; у молочнокислых бактерий это конечный продукт обмена.
Мочевая кислота — конечный продукт обмена пуринов (у человека, птиц, рептилий). У других млекопитающих метаболит превращается в аллантоин и другие продукты.
Выделение энергии из питательных веществ в процессе обмена веществ происходит ступенчато.
На первом этапе при гидролизе белков до аминокислот, углеводов до глюкозы, жира до жирных кислот и глицерина выделяется 0,6 % энергии углеводов, 1 % энергии липидов.
На втором этапе при окислении до ацетил-КоА: СН3—СО— КоА выделяется '/3, при окислении СН3СО—S—КоА до С02 и НгО — 2/з энергии. Около 40 % энергии превращается в теплоту, а около 60 % используется для синтеза АТФ.
У сельскохозяйственных животных различают основной обмен, обеспечивающий поддержание жизнедеятельности, и продуктивный, обеспечивающий продуктивность. Например, корова массой 500 кг и продуктивностью 20 кг молока потребляет 15 кормовых единиц, из них 5 кормовых единиц затрачиваются на основной обмен и 10 кормовых единиц — на продуктивный обмен.
Методы изучения обмена веществ разнообразны. Общей характеристикой обмена веществ является дыхательный коэффициент (ДК), который учитывает количество кислорода, поглощаемого за определенный отрезок времени, и количество диоксида углерода выделяемое за это время: ДК = С02/02. Дыхательный коэффициент для углеводов равен 1. Так, при окислении одной молекулы глюкозы затрачивается шесть молекул кислорода и образуется шесть молекул диоксида углеоода:
![]()
Выделение энергии при окислении 1 г вещества составляет- для углеводов (ДК=1) 4,1ккал (17,22кДж), для жиров (ДК = 0,7) 9,2 ккал (38,64 кДж), для белков (ЦК = 0,8) 4,1 ккал (17,22 кДж).
Как видно из представленных данных, при окислении липидов выделяется в 2 раза больше энергии, чем при окислении углеводов и белков (1 ккал = 4,2 кДж). Для изучения обмена веществ широко применяют балансовые опыты. При этом учитывают количество веществ, поступивших с кормом за определенный срок (за сутки) и выделившихся из организма азота, углерода, фосфора, кальция и т. д. В результате анализа баланс определяют как положительный, если вещество откладывается в организме, и как отрицательный, если из организма выделяется вещества больше, чем поступает с кормом.
Метод меченых атомов позволяет проследить судьбу отдельных соединений в процессе обмена веществ, оценить их участие в метаболизме и выделение из организма. Многие вопросы по обмену веществ можно изучать с использованием метода культуры клеток или на изолированных органах.
Биологическое окисление. Биологическое окисление — это окислительно-восстановительные реакции, происходящие в клетках с участием ферментов, служащие источником энергии в организме.
Химизм горения и биологического окисления, например глюкозы, можно представить общей схемой:
С6Н1206 + 60, 6С02 + 6Н20 + 686 ккал (на 1 грамм-молекулу).
Но имеются и отличия:
горение происходит при высокой температуре, а тканевое окисление — при 37 °С;
горение в воде невозможно, а тканевое окисление происходит в водной среде;
при горении энергия высвобождается моментально в виде теплоты, а при биологическом окислении энергия высвобождается ступенчато, аккумулируется в молекулах АТФ.
Окисление в тканях может происходить:
за счет присоединения кислорода;
вследствие потери или отнятия от водорода электрона.
Под окислением понимают все химические реакции, в основе которых лежит отдача электронов и увеличение положительных валентностей. Если одно вещество окисляется, то другое восстанавливается, т. е. присоединяет электроны.
Окислительно-восстановительные реакции — это перенос электронов, иногда и протонов.
Биологическое окисление — это совокупность окислительно- восстановительных реакций переноса электронов, происходящих в клетках.
Субстратное окисление — это отнятие электронов от промежуточных продуктов обмена углеводов, жиров и белков. Катализируется дегидрогеназами.
Тканевое дыхание — разновидность биологического окисления, при котором акцептором электрона служит кислород.
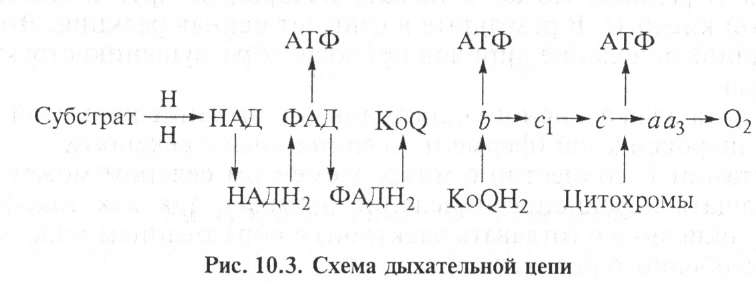
Окисление в дыхательной цепи — это ферментативный перенос электронов от субстрата к кислороду по дыхательной цепи. Ферменты тканевого дыхания находятся в митохондриях, они :трого упорядочены, обеспечивают передачу электронов и протонов от субстрата к кислороду, их называют метаболонами.
Различают четыре группы ферментов: пиридинзависимые де-
гидрогеназы; флавиновые ферменты; убихинон (кофермент Q); цитохромная система.
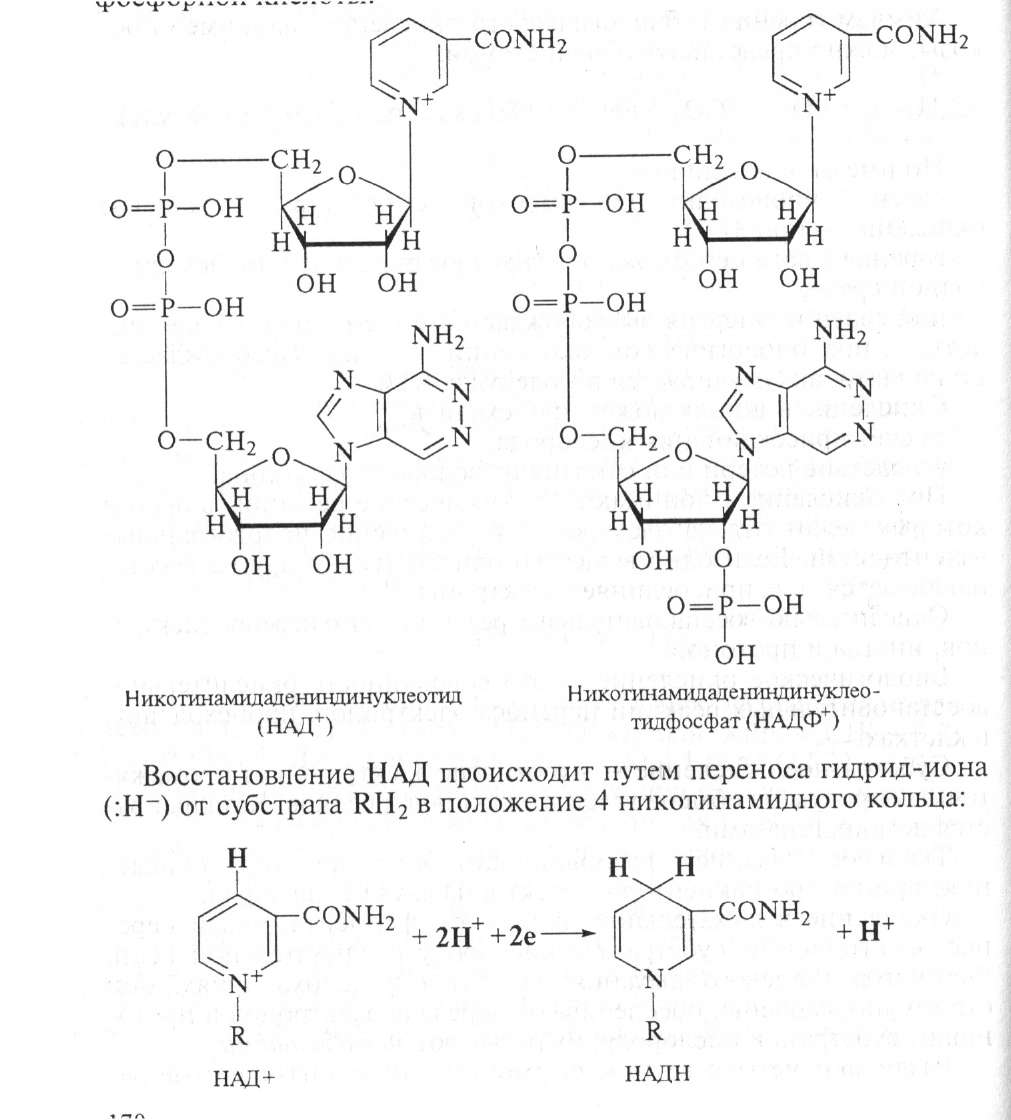
Пиридинзависимые дегидрогеназы — к этой группе относится свыше 150 ферментов. Коферментами их являются никотинамидадениндинуклеотид (НАД+) и никотинамидадениндинуклеотидфосфат (НАДФ+).
НАДФ+ отличается от НАД+ тем, что у 2-го углеродного атома рибозы атом водорода гидроксильной группы замещен остатком фосфатной кислоты:
Флавиновые ферменты — различают свыше 30 флавиновых ферментов. Коферментом их является флавинадениндинуклеотид (ФАД) и флавинмононуклеотид (ФМН):
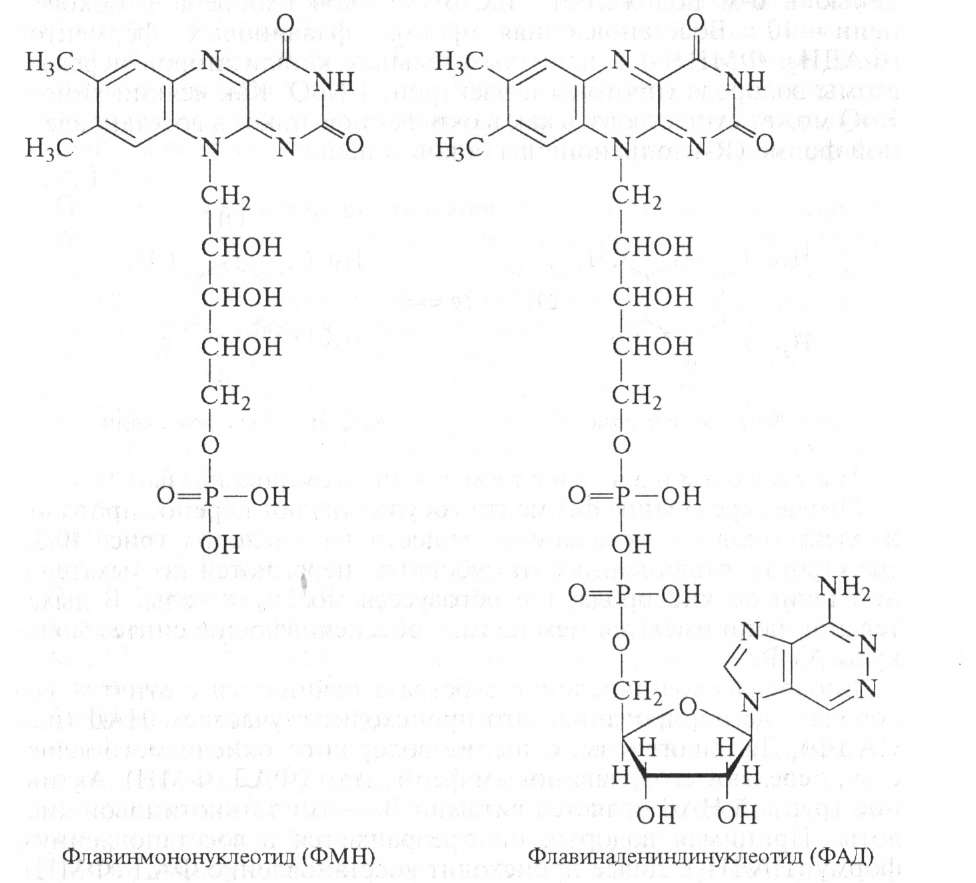
ФМН построен из молекулы витамина В2 и остатка фосфорной кислоты, а ФАД представляет собой ФМН, соединенный через фосфорную кислоту с АМФ. Восстановление ФАД (или ФМН) происходит путем переноса атомов водорода (и двух электронов) от субстрата RH2 в положение 1 и 10 молекулы рибофлавина:
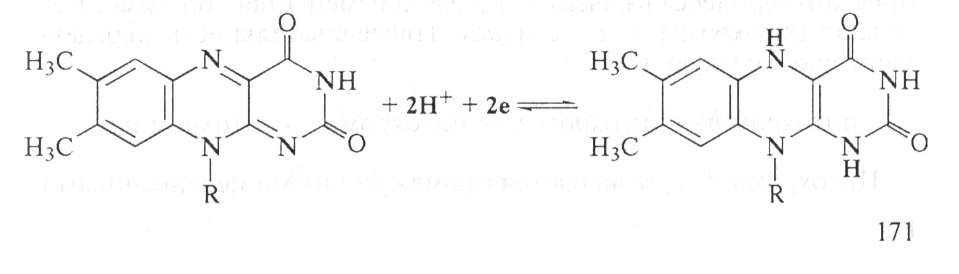
Убихинон (кофермент Q) относится к очень широко распространенным коферментам. По химической природе представляет собой 2,3-диметокси-5-метил-1,4-бензохинон с изопреновой цепью в 6-м положении. Число остатков изопрена в боковой цепи — 10. Восстановленная форма флавиновых ферментов (ФАДН2, ФМНН2) в цепи дыхательных катализаторов передает атомы водорода (протоны и электроны) KoQ. Как всякий хинон, KoQ может существовать как в окисленной, так и в восстановленной форме (R-изопреноидная боковая цепь):
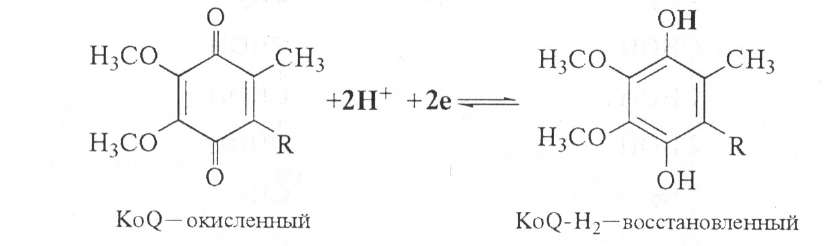
Цитохромная система — цитохромоксидазы.
Эти четыре группы ферментов осуществляют перенос протонов и электронов от окисляемых веществ на кислород (рис. 10.3). Электроны, отщепленные от субстрата, передаются по дыхательной цепи до кислорода, где образуется молекула воды. В дыхательной цепи имеются механизмы, обеспечивающие синтез молекулы АТФ.
Биологическое
окисление субстрата начинается с
отнятия водорода—дегидрирования.
Это происходит с участием НАД (или
НАДФ). Дегидрогеназы, отщепив водород
от окисляемого вещества, передают
его флавиновым ферментам (ФАД, ФМН).
Активной группой НАД является витамин
В5
— амид никотиновой кислоты. Принимая
водород, он превращается в восстановленную
форму (НАДН2).
Далее происходит восстановление ФАД
(ФМН), где активной группой является
витамин В2.
В дальнейшем атом водорода передается
на убихинон и образуется его
восстановленная форма KoQ
∙ Н2.
Следующие ферменты дыхательной цепи
— цитохромоксидазы. Эти хромопротеиды
содержат железо, способное изменять
свою валентность Fe+2
↔
Fe+3.
В ходе каталитического процесса
валентность железа изменяется обратимо.
Различают цитохромы b,
![]() ,
c
и
,
c
и ![]() .
Последовательность передачи электронов
следующая:
.
Последовательность передачи электронов
следующая:

а цитохром аа3 (цитохромоксидаза) — конечным ферментом, непосредственно взаимодействующим с кислородом. Окисленная форма Fe+3 принимает электроны от восстановленного цитохрома с, переходя в восстановленное Fe+2. Переносчиками электронов являются также белки, содержащие железо в виде ионов (не входящее в структуру гена). В этих белках несколько атомов железа связано с остатком цистеина. Указанные ферменты находятся в строгой последовательности в фиксированном состоянии на внутренней мембране митохондрий, их называют метаболонами (рис. 10.3).
Окислительное фосфорилирование. Окислительное фосфорилирование происходит в митохондриях в процессе биологического окисления вдыхательной цепи. Высвобождающаяся энергия аккумулируется в макроэргических соединениях АТФ. Энергия, освобождающаяся в процессе биологического окисления, только частично (около 40 %) рассеивается в виде теплоты, а большая часть (около 60 %) накапливается в форме макроэргических молекул АТФ. Молекула АТФ — это универсальный акцептор и донор химической энергии в клетках. Гидролиз каждой макроэргической связи АТФ сопровождается выделением 7,3 ккал (30,66 кДж) энергии на 1 грамм-молекулу. В дыхательной цепи при переносе каждой пары электронов на один атом кислорода образуется три молекулы АТФ, т. е. отношение фосфора к кислороду равно трем: Р/О = 3. Молекулы АТФ синтезируются в определенных участках дыхательной цепи. На каждом этапе синтеза АТФ аккумулируется 8 ккал (33,6 кДж) энергии на каждую грамм-молекулу образовавшейся АТФ.
Свободное окисление происходит без образования АТФ на наружной поверхности митохондрий с участием таких же ферментов, как внутри митохондрий. Промежуточные и конечные продукты окисления также не отличаются от продуктов, образующихся внутри митохондрий. Отличие состоит только в том, что в этом случае не образуются макроэргические соединения (АТФ). Свободное окисление происходит также в пероксисомах цитоплазмы, где главным ферментом является пероксидаза (каталаза), окисля ющая Н2О2. Свободное окисление важно для поддержания температуры тела в условиях холода, так как энергия, выделяющаяся при этом, рассеивается в виде теплоты.
![]()
Реакция происходит с участием кислорода и восстановленной формы НАДФ. При этом один атом молекулярного кислорода включается в R—ОН, другой идет на образование воды. Это так называемое монооксигеназное окисление. Фермент цитохром Р450 катализирует образование гидроксильных (—ОН) групп при синтезе желчных кислот, стероидных гормонов, катаболизме чужеродных соединений (ксенобионты).
Токсичность кислорода. Молекулярный кислород О2 в клетках может образовать супероксидный анион О2, который действует как окислитель (акцептор электрона) и как восстановитель (донор электрона).
Супероксид, пероксид водорода (Н2О2), гидроксильный радикал (-ОН) имеют высокую химическую активность, реагируют со многими веществами организма, оказывают повреждающее действие на липиды.
Активные формы кислорода способны отнимать водород из —СН2-групп, жирных кислот, превращая их в свободнорадикаль- ные группы —СН—. Такой радикал жирной кислоты легко присоединяет молекулу кислорода и превращается в пероксидный радикал жирной кислоты:

Такой радикал может отнимать водород от другой молекулы жирной кислоты. В результате возникает цепная реакция. Это пероксидное окисление липидов приводит к разрушению структуры мембран.
Защита от перекисного окисления — окисление каталазой, глу- татионпероксидазой (фермент, соединенный с селеном).
Витамин Е совместно с микроэлементом селеном может предотвращать перекисное окисление липидов, так как токоферол может окисляться (отдавать электрон) с образованием малоактивного свободного радикала.
Контрольные вопросы и задания
1. Что такое катаболизм, анаболизм, метаболизм? 2. Назовите основные этапы обмена веществ. 3. Дайте характеристику биологического окисления. 4. Что такое окислительное фосфорилирование и чем отличается от свободного окисления?
