
- •I. Физколлоидная химия
- •1. Физическая химия
- •1.1. Вода
- •1.1.1. Вода как уникальная молекула жизни
- •1.1.3. Буферные растворы
- •1.2. Биоэнергетика клетки
- •1.3. Термохимия
- •1.4. Химическая кинетика и катализ
- •2. Коллоидная химия
- •2.1. Классификация дисперсных систем
- •2.2. Классификация дисперсных систем по агрегатному состоянию дисперсной фазы
- •2.2. Поверхностные явления
- •2.3. Адсорбция
- •2.4. Коллоидные растворы (золи)
- •2.4.1. Характеристика коллоидных растворов
- •2.4.2. Растворы высокомолекулярных соединений
- •II. Биологическая химия
- •3. Белки
- •3.1. Общая характеристика белков
- •3.3. Методы выделения, фракционирования и очистки белков
- •3.3.1. Методы выделения белков
- •3.4. Физико-химические свойства белков
- •3.5. Аминокислоты
- •3.6. Структура белковой молекулы
- •I'm 1.8. Денатурация и ренатурация рибонукле- азы (по Анфинсену):
- •3.7. Классификация белков
- •3.7.1. Простые белки
- •3.7.2. Сложные белки
- •4. Нуклеиновые кислоты
- •4.1. Общая характеристика нуклеиновых кислот
- •4.2. Нуклеотиды и нуклеозиды
- •4.3. Дезоксирибонуклеиновая кислота
- •4.4. Рибонуклеиновые кислоты
- •5. Углеводы 5.1. Общая характеристика углеводов
- •5.2. Моносахариды
- •5.3. Олигосахариды
- •5.4. Полисахариды (глюканы)
- •6. Липиды
- •6.1. Общая характеристика липидов
- •6.2. Простые липиды
- •6.3. Сложные липиды
- •6.4. Двойной липидный слой клеточных мембран
- •Контрольные вопросы и задания
- •7. Витамины
- •7.1. Общая характеристика витаминов
- •7.2. Классификация и номенклатура витаминов
- •7.2.1. Жирорастворимые витамины
- •7.2.2. Водорастворимые витамины
- •8. Ферменты 8.1. Общая характеристика ферментов
- •8.3. Общие свойства ферментов
- •8.4. Активирование и ингибирование ферментов
- •8.2. Участие ионов металлов в активировании ферментов
- •8.5. Классификация и номенклатура ферментов
- •III класс. Гидролазы. Они разрывают внутримолекулярные связи путем присоединения
- •8.6. Применение ферментов
- •9. Гормоны
- •9.1. Уровни регуляции гормонов
- •9.2. Гормоны, выделяемые железами внутренней секреции
- •9.3. Гормоны местного действия
- •11. Обмен углеводов
- •11.1. Переваривание углеводов в пищеварительном тракте
- •11.2. Катаболизм глюкозы
- •11.3. Цикл трикарбоновых кислот
- •11.4. Пентозофосфатный путь окисления глюкозо-6-фосфата
- •11.5. Биосинтез углеводов
- •11.6. Регуляция обмена углеводов
- •12. Обмен липидов
- •12.1. Переваривание липидов в пищеварительном тракте
- •12.2. Промежуточный обмен липидов
- •2. Если синтезируется много сн3—со—КоА, а энергии для синтеза жира недостаточно, то образуется активированная ацетоуксусная кислота:
- •12.3. Биосинтез липидов
- •12.4. Метаболизм стеринов и стеридов
- •13. Обмен белков
- •13.2. Биологическая ценность белков
- •13.3. Особенности переваривания белков у моногастричных животных
- •13.4. Особенности переваривания белков у жвачных
- •13.5. Метаболизм белков в тканях
- •13.6. Особенности обмена отдельных аминокислот
- •13.7. Биосинтез белка
- •14. Обмен нуклеиновых кислот
- •14.1. Переваривание нуклеиновых кислот в пищеварительном тракте
- •14.2. Промежуточный обмен нуклеиновых кислот (распад нуклеиновых кислот в тканях)
- •14.3. Биосинтез нуклеиновых кислот
- •14.4. Рекомбинантные молекулы и проблемы генной
- •15. Обмен воды и солей
- •15.1. Содержание и роль воды в организме
- •15.2. Электролиты тканей
- •15.3. Потребность организма в минеральных веществах, их поступление и выделение
- •16. Взаимосвязь обмена белков, жиров и углеводов
- •17. Биохимия крови
- •18. Биохимия нервной ткани
- •18.1. Химический состав нервной ткани
- •18.2. Обмен веществ в нервной ткани
- •18.3. Химизм передачи нервного импульса
- •19. Биохимия мышечной ткани
- •19.1. Морфология и биохимический состав мышечной ткани
- •19.2. Механизм сокращения мышцы
- •19.3. Окоченение мышц
- •20. Биохимия молока и молокообразования
- •21. Биохимия почек и мочи
- •22. Биохимия кожи и шерсти
- •23. Биохимия яйца
- •Приложение
8.4. Активирование и ингибирование ферментов
Активность фермента зависит от присутствия активаторов, в качестве которых могут выступать различные соединения: НС1 для пепсина; желчные кислоты для панкреатической липазы; глутати- он, цистеин, витамин С для тканевых ферментов и папаина (растительный фермент); ионы металлов для многих ферментов (табл. 8.2).
8.2. Участие ионов металлов в активировании ферментов

Обычно трудно провести грань между металлоферментами и ферментами, активируемыми ионами металлов (последние легко диссоциируют). Некоторые ферменты активны лишь в присутствии металлов.
Например, при удалении ионов цинка угольная ангидраза практически лишена ферментативной активности, при этом ион Zn+2 не может быть заменен ионом другого металла. В одних случаях ионы металлов выполняют роль простетических групп ферментов; в других способствуют присоединению субстрата к активному центру и образованию фермент-субстратного комплекса.
Ингибиторы полностью или частично подавляют активность ферментов. К таким факторам относятся прежде всего агенты, вызывающие денатурацию белка: нагревание, кислоты, щелочи, соли тяжелых металлов.
Специфические ингибиторы подавляют активность какого- либо одного фермента или группы ферментов. Изучение действия этих ингибиторов имеет важное значение, они могут дать ценную информацию о природе активного центра фермента, о механизме образования фермент-субстратного комплекса.
Известны вещества, специфически связывающие ту или иную группу в молекуле фермента, выключая ее из химической реакции. Например, IСН2—СООН (иодацетат), его амид и ряд других соединений легко входят в связь с SH-группами ферментов. Некоторые ферменты блокируются фосфорорганическими соединениями.
Ингибиторы позволяют определить функции множественных форм ферментов (изоэнзимов). На ингибировании ферментов основан механизм действия многих токсинов и ядов на организм. Например, при отравлениях синильной кислотой смерть наступает в результате торможения дыхательных ферментов. Влияние инсектицидов—результат блокирования фермента холинэстеразы. Нервно-паралитические яды (зоман, зарин, Vx) тоже блокируют ферменты.
Различают конкурентное и неконкурентное ингибирование.
Конкурентное ингибирование вызывают вещества, имеющие структуру, похожую на субстрат, но немного отличающуюся от структуры истинного субстрата. Примером этого может служить торможение активности сукцинатдегидрогеназы малоновой кислотой. Этот фермент катализирует окисление путем дегидрирования янтарной кислоты в фумаровую (рис. 8.5).
Если в среду добавить малоновую кислоту (ингибитор), то в силу структурного сходства ее с истинным субстратом янтарной кислотой (наличие двух ионизированных карбоксильных групп) она будет реагировать с активным центром с образованием фермент-ингибиторного комплекса. Однако при этом переноса водо-
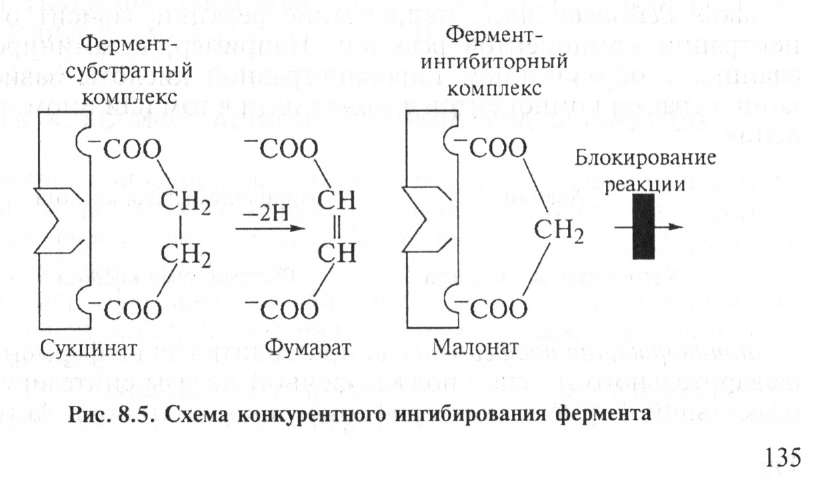
рода от малоната не происходит, так как структуры субстрата янтарной кислоты и малоната несколько различаются, они конкурируют за связывание с активным центром и степень ингибирования будет зависеть от соотношения количества янтарной и малоновой кислот.
Метод конкурентного ингибирования широко применяют в медицине и ветеринарии, в частности действие сульфаниламидных препаратов основано на такого рода ингибировании.
Известно, что бактерии используют парааминобензойную кислоту для синтеза фолиевой кислоты, необходимой для их роста.
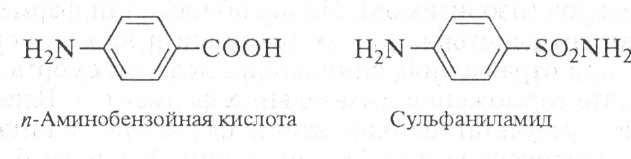
Благодаря структурному сходству сульфаниламид блокирует действие фермента, в результате рост бактерий подавляется.
Некоторые аналоги витамина В6 и фолиевой кислоты, в частности дезоксиптиридоксин и аминоптерин, действуют как конкурентные ингибиторы (антивитамины), тормозящие многие биохимические процессы в организме.
Неконкурентное ингибирование вызывают вещества, не имеющие структурного сходства с субстратами и часто связывающиеся не с активным центром фермента, а с любым другим сайтом его молекулы. При этом образуется ковалентная связь, фермент полностью инактивируется, а торможение (ингибирование) бывает необратимым (например, действие иодацетата, хлороводородной кислоты и др.).
Кроме того, на активность фермента влияют и другие факторы: закон действия масс: направление реакции зависит от концентрации компонентов реакции. Например, дезаминирование аланина с образованием пировиноградной кислоты зависит от концентрации компонентов и может идти в том или ином направлении:

активирование проферментов: протеолитические ферменты пищеварительного тракта и поджелудочной железы синтезируются в неактивной форме в виде проферментов (зимогенов). Активирование их происходит под действием специфических агентов. Например, трипсиноген (поджелудочная железа) в кишечнике превращается в трипсин под действием энтерокиназы (открыто в лаборатории И. П. Павлова);
химическая модификация фермента: ключевые ферменты энергетического обмена — фосфорилаза, гликогеназа и другие контролируются путем химической модификации — фосфорилирования и дефосфорилирования;
регуляция активности ферментов по принципу обратной связи (очень распространенная форма регуляции): концентрация конечного продукта является мощным ингибирующим фактором. Например, в клетках Е. coli изолейцин, являющийся конечным продуктом, избирательно подавляет активность треониндегидратазы (первую фазу превращения лейцина в изолейцин);
другие типы регуляции: к ним могут быть отнесены конкуренция ферментов за общий субстрат, выключение одного из ферментов (изоферментов).
О количестве фермента судят по скорости катализируемой реакции при определенных условиях — по уменьшению количества субстрата или по образованию продукта реакции.
За единицу (Е) любого фермента принимают то его количество, которое в оптимальных условиях катализирует превращение 1 мкмоль субстрата в 1 мин (мкмоль/мин). Кроме того, активность фермента обозначают в каталах (kat) — моль/с; 1Е ферм. = = 6,67 нкатал. Активность фермента выражают, определяя удельную или молекулярную активность.
Удельная активность фермента — это единица ферментативной активности на 1 мг белка.
Молекулярная активность фермента — это число молекул субстрата, подвергающихся превращению одной молекулой фермента в 1 мин. Например, одна молекула каталазы эритроцитов способна расщепить в 1 мин 5 • 106 молекул Н202.
