
- •Лабораторный практикум
- •Как выполнить и оформить лабораторную работу
- •Лабораторная работа №1. Правила техники безопасности при работе в химической лаборатории. Химическая посуда и ее назначение.
- •Лабораторная работа №2. Атомно-молекулярная теория. Определение эквивалента карбонат натрия.
- •Лабораторная работа №3. Классы неорганических соединений.
- •1.1. Теоретическая часть
- •Лабораторная работа № 4.Скорость химической реакции
- •Лабораторная работа №5. Приготовление растворов
- •Лабораторhая работа №6.Дисперсные системы. Эмульсии
- •Лабораторная работа №7.Качественный анализ.
- •Лабораторная работа №8. Определение жесткости воды и ее умягчение
- •В 10 л воды содержится 136 мг сульфата кальция и 190 мг хлорида магния. Чему равна жесткость этой воды? приложение
- •Список использованных источников
Лабораторная работа №2. Атомно-молекулярная теория. Определение эквивалента карбонат натрия.
Цель работы: Усвоение понятий эквивалент, молярная масса эквивалента, расчет эквивалентов простых и сложных веществ, знакомство с простейшим экспериментальным методом определения эквивалента элемента.
Приборы и реактивы: Колба емкостью 50 мл с газоотводной трубкой; мерный цилиндр емкостью 100 мл; кристаллизатор; стеклянная пластинка; карбонат натрия безводный; раствор хлорида натрия (насыщенный); соляная кислота 2н.
Теоретическая часть:
Немецкие химики Венцель и Рихтер установили (1793г.), что вещества реагируют и образуются в эквивалентных количествах.
Современная формулировка закона эквивалентов: массы реагирующих веществ относятся между собой как эквиваленты этих веществ
Эквивалент Э - условная химическая частица в Z раз меньшая соответствующей формульной единицы ФЕ вещества, участвующего в реакции. Под формульной единицей понимается химическая формула вещества. Для реакции:
2Al(OH)3 + 3 H2SO4 = Al2(SO4)3 + 6 H2O
Формульное количество 2 моль 3 моль 1 моль 6 моль
Эквивалентное количество 6 моль 6 моль 6 моль 6 моль
Эквивалентное число Z 3 2 6 1
Фактор эквивалентности
f = 1/Z 1/3 1/2 1/6 1
По аналогии с молярной массой вещества M вводится понятие молярной массы эквивалента вещества Mэкв:
Mэкв
=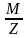 = f
·M
.
= f
·M
.
Эквивалент может быть также определен как количество вещества, равноценное в химической реакции 1 молю атомов водорода или 1 молю электронов.
1 моль атомов водорода имеет молярную массу М ≈ 1 (точнее 1,008) г/моль; 1 моль электронов эквивалентен количеству электричества F, известному как число Фарадея:
q = 1,6·1019Кл·6,02·1023моль = 96484 Кл/моль = F.
Эквивалентное число Z численно равно валентности элемента для простого вещества или сумме степеней окисления катиона или аниона (по модулю) для сложного вещества.
Примеры расчета эквивалентов веществ.
Рассчитать эквивалент железа в реакциях:
а) Fe + H2SO4 (разб.) = FeSO4 + H2;
б) 2Fe +6H2SO4 (конц.) = Fe2(SO4)3 +3 SO2 + 6H2O.
Для реакции (а) Fe – 2e = Fe+2 и эквивалентное число Z=2. Эквивалент железа равен Э = ½ ФЕ, молярная масса эквивалента железа равна
Мэкв = ½ М = 55,85 : 2 = 27,925 г/моль.
Для реакции (б) Fe – 3e = Fe+3 и эквивалентное число Z=3. Эквивалент железа равен Э = ⅓ ФЕ, молярная масса эквивалента железа равна
Мэкв = ⅓ М = 55,85 : 3 = 18,617 г/моль.
Вычисление эквивалентного числа для кислот, оснований и солей в реакциях обмена.
Для кислоты эквивалентное число определяется количеством ионов водорода, замещающихся ионами металла, т.е. основностью кислоты:
а) H3PO4 + NaOH = NaH2PO4 + H2O, Z(H3PO4) =1
б) H3PO4 + 2 NaOH = Na2HPO4 + 2H2O, Z(H3PO4) =2
в) H3PO4 + 3 NaOH = Na3PO4 + 3H2O, Z(H3PO4) =3
Для основания эквивалентное число определяется количеством ионов гидроксида, замещающихся анионами кислоты, т.е. кислотностью основания:
а) Al(OH)3 + HCl = Al(OH)2Cl + H2O, Z [Al(OH)3] = 1
б) Al(OH)3 + 2HCl = Al(OH)Cl2 + 2H2O, Z [Al(OH)3] = 2
в) Al(OH)3 + 3HCl = Al(OH)3 + 3H2O, Z [Al(OH)3] = 3
Для соли эквивалентное число определяется произведением валентности (степени окисления) катиона (или аниона по модулю) n на количество катионов (или анионов) m: Z = n·m
а) NaCl , Z =1·1=1; б) Na2SO4 , Z = 1·2=2; в) Al2(SO4)3, Z=3·2=6;
г) Na[HSO4], Z=1·1=1; д) [Al(OH)]Cl2, Z=2·1=2;
e) [Cu(NH3)4](OH)2, Z=2·1=2.
Вычисление эквивалентного числа окислителя и восстановителя в окислительно-восстановительной реакции.
Эквивалентное число окислителя и восстановителя в окислительно-восстановительной реакции определяется количеством принятых или отданных электронов.
3 H2S + K2Cr2O7 + 4 H2SO4 = Cr2(SO4)3 + 3 S + K2SO4 + 7 H2O
восстановитель:
H2S
– 2e
= S
+ 2H+,
Z
= 2, Мэкв
=
=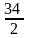 =17
г/моль;
=17
г/моль;
окислитель: Cr2O72- + 14 H+ + 6e = 2 Cr3+ + 7 H2O, Z = 6,
Мэкв
=
=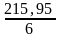 =
35,99 ≈ 36 г/моль
=
35,99 ≈ 36 г/моль
Экспериментально эквивалент элемента может быть определен химическим путем - определением количества присоединяемого или замещаемого элементом водорода, кислорода или другого элемента, эквивалент которого известен, или электрохимическим путем на основании закона Фарадея, согласно которому при прохождении 96494 Кл электричества через раствор электролита на электродах превращается один эквивалент вещества.
В данной работе использован наиболее простой и доступный способ определения эквивалента активного металла, основанный на измерении объема водорода при реакции вытеснения его из раствора соляной кислоты:
Me
+
n
HCl
= MeCln
+
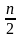 H2
H2
Согласно закону эквивалентов, один эквивалент металла вытесняет один эквивалент водорода, имеющий молярную массу эквивалента 1 г/моль.
Используя закон Авогадро, можно определить объем, который занимает один эквивалент водорода при определенных физических условиях. При нормальных физических условиях ( р = 1,013·105 Па или р=760 мм рт. ст., Т= 298 К ) 1 моль водорода, имеющий массу 2 г/моль, занимает объем
V = 22,4 л, тогда 1 моль эквивалента водорода, имеющий массу 1 г/моль, должен занимать объем Vэкв = 11,2 л. Таким способом можно рассчитать эквивалентный объем любого газа при нормальных условиях.
Экспериментальная часть:
Наполнить кристаллизатор насыщенным раствором поваренной соли, в котором растворимость диоксида углерода меньше, чем в воде. Тем же раствором наполнить мерный цилиндр емкостью 100 мл и закрыть его стеклянной пластинкой, надвигая ее скользящим движением.
Перевернуть цилиндр вверх дном и опустить его в кристаллизатор. Удалить под раствором стеклянную пластинку и закрепить цилиндр в лапке штатива так, чтобы края цилиндра были ниже уровня раствора в кристаллизаторе, следя за тем, чтобы в цилиндр не попал воздух.
В колбу емкостью 50 мл налить 8-10 мл 2н. раствора соляной кислоты, вытереть горло колбы фильтровальной бумагой и закрепить ее в штативе в горизонтальном положении.
Взвесить на аналитических весах 0,3-0,4 г карбоната натрия и поместить навеску вместе с бумагой в горло колбы таким образом, чтобы кристаллы не могли преждевременно упасть в кислоту, плотно закрыть колбу пробкой с газоотводной трубкой и подвести открытый изогнутый конец трубки под цилиндр.
Вынуть колбу из штатива и медленно стряхнуть карбонат натрия в кислоту аккуратными наклонами колбы. В конце опыта стряхнуть бумажку с остатками кристаллов в колбу. По окончании выделения газа вновь закрепить колбу в штативе.
Измерить в цилиндре объем выделившегося диоксида углерода и с помощью миллиметровой линейки измерить расстояние l от уровня воды в кристаллизаторе до уровня воды в цилиндре.
Записать комнатную температуру и атмосферное давление.
Оформление работы и расчеты. Зарисовать схему прибора и записать данные опыта:
Таблица 1. Данные опыта.
№ |
Параметры |
Обозначение |
Единицы измерения |
Значение |
1 |
Масса карбоната натрия |
g |
г |
|
2 |
Объем выделившегося диоксида углерода |
V |
мл |
|
3 |
Расстояние от уровня воды в кристаллизаторе до уровня воды в цилиндре |
l |
мм |
|
4 |
температура опыта |
t |
С |
|
5 |
атмосферное давление |
Р |
мм. рт.ст. |
|
По уравнению Менделеева-Клайперона вычислить массу диоксида углерода. Для определения парциального давления СО2 следует из атмосферного давления вычесть давление столба жидкости в мм.рт.ст. Последнее вычислить по формуле
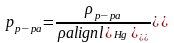
Плотность
насыщенного раствора хлорида натрия
равна 1,20 г/см3,
плотность ртути равна 13, 60 г/см3.
Парциальным давлением водяного пара h
ввиду его малого значения в насыщенном
растворе поваренной соли в данном опыте
можно пренебречь. Таким образом,
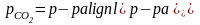 .
.
Зная, что эквивалент кислотного оксида СО2 в реакции нейтрализации, протекающей с образованием Na2CO3, равен половине его моля, и применяя закон эквивалентов, вычислить эквивалент карбоната натрия. Найти абсолютную и относительную ошибки определения.
Относительная погрешность опыта по уравнению:
Δ
M
=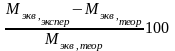 %
%
где Мэкв,экспер – молярная масса эквивалента карбоната натрия, рассчитанная из опытных данных по уравнению, Мэкв,теор – теоретическая молярная масса эквивалента карбоната натрия, рассчитанная по уравнению.
Вопросы для защиты:
Почему для заполнения мерного цилиндра используют насыщенный раствор хлорида натрия, а не воду?
Как рассчитать абсолютную и относительную ошибки опыта?
Приведите уравнение Менделеева-Клайперона.
Единицы измерения давления и их взаимосвязь.
Что такое эквивалент.
Как определить молярную массу эквивалента соли, кислоты, основания?
Определите эквивалентное число и фактор эквивалентности для веществ:
а) Fe2O3,б) HClO4 , в) NaHS, г) MgOHCl, д) Ca(OH)2.
Как связаны молярная масса вещества и молярная масса эквивалента? Рассчитайте молярную массу эквивалента веществ, приведенных в вопросе 7.
Какой объем занимает при нормальных условиях 1 моль эквивалента
газообразного вещества: а) кислорода, б) хлора; в) углекислого газа?
Используя закон эквивалентов, рассчитайте объем оксида
углерода (II), который потребуется для восстановления железа из 1 кг
оксида железа (III) при нормальных условиях.
