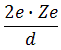1. Опыты Резерфорда по рассеянию альфа-частиц
|
= |
|
• |
|
F
=
•![]()
2. Планетарная модель атома
Согласно этой модели в центре атома находится положительно заряженное ядро, в котором сосредоточена почти вся масса атома. Вокруг ядра вращаются по орбитам отрицательно заряженные электроны. Электроны движутся вокруг ядра на относительно больших расстояниях, подобно тому, как планеты вращаются вокруг солнца. Из совокупности этих электронов образуется электронная оболочка илиэлектронное облако.
3. Постулаты Бора
- Атом может находиться только в особенных стационарных, или квантовых, состояниях, каждому из которых отвечает определенная энергия. В стационарном состоянии атом не излучает электромагнитных волн.
-
Электрон
в атоме,
не теряя энергии, двигается по определённым
дискретным круговым орбитам, для которых
момент
импульса квантуется:
![]() ,
где
,
где
![]() —
натуральные
числа, а постоянная
Планка. Пребывание электрона на
орбите определяет энергию этих
стационарных
состояний.
—
натуральные
числа, а постоянная
Планка. Пребывание электрона на
орбите определяет энергию этих
стационарных
состояний.
-
При переходе электрона с орбиты
(энергетический уровень) на орбиту
излучается или поглощается квант
энергии
![]() ,
где
,
где
![]() —
энергетические
уровни, между которыми осуществляется
переход. При переходе с верхнего уровня
на нижний энергия излучается, при
переходе с нижнего на верхний —
поглощается.
—
энергетические
уровни, между которыми осуществляется
переход. При переходе с верхнего уровня
на нижний энергия излучается, при
переходе с нижнего на верхний —
поглощается.
Используя данные постулаты и законы классической механики, Бор предложил модель атома, ныне именуемую Боровской моделью атома[1]. В дальнейшем Зоммерфельд расширил теорию Бора на случай эллиптических орбит. Её называют моделью Бора-Зоммерфельда.
4. Радиус Боровской орбиты
Бо́ровский ра́диус — радиус ближайшей к ядру орбиты электрона атома водорода в модели атома, предложенной Нильсом Бором в 1913 г. и явившейся предвестницей квантовой механики. В модели электроны движутся по круговым орбитам вокруг ядра, при этом орбиты электронов могут располагаться только на определённых расстояниях от ядра, в зависимости от их энергии.
Боровский радиус имеет значение 5,2917720859(36)·10−11 м[1] (цифры в скобках указывают погрешность в последних значащих цифрах на уровне 1σ), то есть приблизительно 53 пм или 0.53 ангстрема. Это значение может быть вычислено в терминах других физических констант
![]()
где:
![]() —
электрическая
постоянная
—
электрическая
постоянная
![]() —
постоянная
Дирака или приведенная
постоянная
Планка,
то есть постоянная Планка
—
постоянная
Дирака или приведенная
постоянная
Планка,
то есть постоянная Планка
![]() ,
деленная на
,
деленная на
![]() .
.
![]() —
масса
электрона
—
масса
электрона
![]() -
элементарный
заряд
-
элементарный
заряд
![]() —
скорость
света
—
скорость
света
![]() -
постоянная
тонкой структуры
-
постоянная
тонкой структуры
5.Выражение энергии электрона атома
Полная энергия, соответственно, равна
![]()
6.Обобщенная формула Бальмера
V=R(1/k2 -1/n2 )
7. Таким образом, опыт Франка — Герца показал, что спектр поглощаемой атомом энергии не непрерывен, а дискретен, минимальная порция (квант электро-магнитного поля), которую может поглотить атом Hg, равна 4,9 эВ. Значение длины волны λ = 253,7 нм свечения паров Hg, возникавшее при V > 4,9 В, оказалось в соответствии со вторым постулатом Бора
![]() ,
,
где E0 и E1 — энергии основного и возбужденного уровней энергии.
8. Потенциальная его энергия
![]()
9.Квантовые числа — энергетические параметры, определяющие состояние электрона и тип атомной орбитали, на которой он находится.
Главное квaнтовое число n определяет общую энергию электрона и степень его удаления от ядра (номер энергетического уровня); оно принимает любые целочисленные значения, начиная с 1 (n = 1, 2, 3, . . .)
Орбитальное (побочное или азимутальное) квантовое число l определяет форму атомной орбитали. Оно может принимать целочисленные значения от 0 до n-1 (l = 0, 1, 2, 3,..., n-1). Каждому значению l соответствует орбиталь особой формы. Орбитали с l = 0 называются s-орбиталями, l = 1 – р-орбиталями (3 типа, отличающихся магнитным квантовым числом m), l = 2 – d-орбиталями (5 типов), l = 3 – f-орбиталями (7 типов).
Магнитное квантовое число m определяет ориентацию орбитали в пространстве относительно внешнего магнитного или электрического поля. Его значения изменяются от +l до -l, включая 0. Например, при l = 1 число m принимает 3 значения: +1, 0, -1, поэтому существуют 3 типа р-АО: рx, рy, рz.
Спиновое квантовое число s может принимать лишь два возможных значения +1/2 и -1/2. Они соответствуют двум возможным и противоположным друг другу направлениям собственного магнитного момента электрона, называемого спином (от англ. веретено). Для обозначения электронов с различными спинами используются символы:
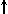 и
и
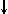 .
.
10. Напомним, что состояние электрона в атоме однозначно определяется набором четырех квантовых чисел:
· главного n ;
· орбитального l , обычно эти состояния обозначают 1s, 2d, 3f;
· магнитного ( );
· магнитного спинового ( ).
Распределение электронов в атоме происходит по принципу Паули, который может быть сформулирован для атома в простейшем виде:в одном и том же атоме не может быть более одного электрона с одинаковым набором четырех квантовых чисел: n, l, , :
Z (n, l, , ) = 0 или 1,
где Z (n, l, , ) - число электронов, находящихся в квантовом состоянии, описываемых набором четырех квантовых чисел: n, l, , . Таким образом, принцип Паули утверждает, что два электрона, связанные в одном и том же атоме различаются значениями, по крайней мере, одного квантового числа.
11. Правилами отбора в спектроскопии называют ограничения и запрет на переходы между уровнями квантомеханической системы с поглощением или излучением фотона, наложенные законами сохранения и симметрией.
15. В основе теории деления тяжелых ядер лежит капельная модель ядра, согласно которой ядро представляет собой как бы каплю заряженной жидкости. Как в капле обычной жидкости, поверхность ядра может колебаться. Ядро делится в том случае, если действие сил отталкивания между протонами превосходит силы притяжения между нуклонами. В тяжелых ядрах это возможно из-за большого числа протонов и больших размеров ядра. Напомним, что ядерные силы короткодействующие и при больших размерах ядра они не способны противостоять силам электрического отталкивания, действующим на любых расстояниях.
16.
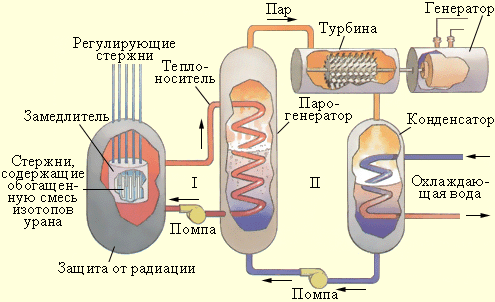
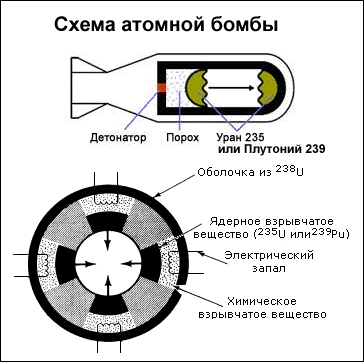
17.
18. Термоядерная реакция — это реакция синтеза легких ядер в более тяжелые.
Для ее осуществления необходимо, чтобы исходные нуклоны или легкие ядра сблизились до расстояний, равных или меньших радиуса сферы действия ядерных сил притяжения (т.е. до расстояний 10-15 м). Такому взаимному сближению ядер препятствуют кулоновские силы отталкивания, действующие между положительно заряженными ядрами. Для возникновения реакции синтеза необходимо нагреть вещество большой плотности до сверхвысоких температур (порядка сотен миллионов Кельвин), чтобы кинетическая энергия теплового движения ядер оказалась достаточной для преодоления кулоновских сил отталкивания. При таких температурах вещество существует в виде плазмы. Поскольку синтез может происходить только при очень высоких температурах, ядерные реакции синтеза и получили название термоядерных реакций
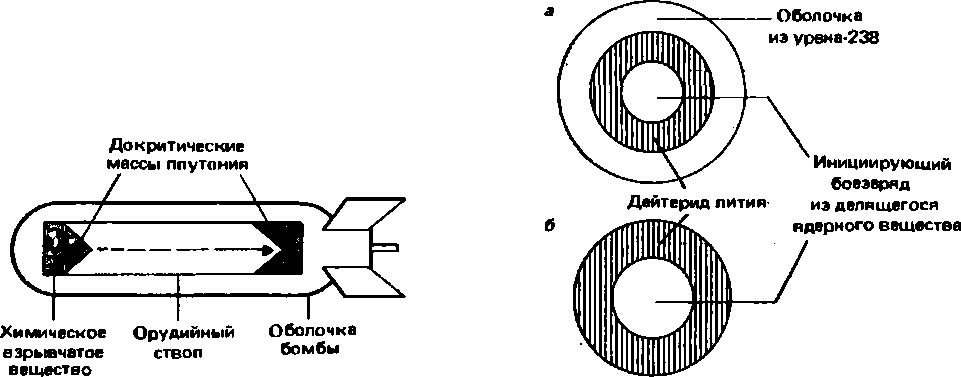
19.
20. Типы фундаментальных взаимодействий.
Существует четыре типа взаимодействий:
- гравитационное
- электромагнитное
- ядерное (сильное)
- слабое
Наиболее сильным является взаимодействие между ядерными частицами. Это взаимодействие принято называть сильным.
Следующим по величине является электромагнитное взаимодействие. Оно меньше сильного на два порядка.
Далее следует взаимодействие, обусловленное в реакциях нейтрино. По порядку величины эти взаимодействия меньше сильных в 1014 раз. Эти взаимодействия принято называть слабыми.
Самое слабое из взаимодействий – гравитация. Оно меньше сильного на 39 порядков – в 1039 раз! С расстоянием гравитационные силы убывают столь же медленно, как и электромагнитные. Чрезвычайная малость гравитационных сил позволяет игнорировать их в физике микрочастиц.
Приведем таблицу характерного времени действия различных типов взаимодействия:
22.
Типы взаимодействия |
Относительная величина |
Характерное время, сек |
Сильное Электромагнитное Слабое Гравитационное |
1 10-2 10-14 10-39 |
10-23 10-21 10-9 10+16 ≈ 3*108 лет |