
Лабораторная работа N11
Изучение сериальннх закономерностей в спектре водорода. Определение постоянной ридберга.
ЦЕЛЬ РАБОТЫ: 1. Градуировка монохроматора по ртутной лампе;
2. Исследование спектров в видимой области (серия
Бальмера);
3. Определение постоянной Ридберга.
ОБОРУДОВАНИЕ: монохроматор УМ-2, ртутная лампа, выпрямитель ВС-4,
индукционная катушка, спектральная трубка водорода.
ЛИТЕРАТУРА: 1. Шпольский Э. С. Атомная Физика . М. 1982.
2. Фриш С. Э. Оптические свойства атомов. Н. Физматгиз.1963.
3. Савельев И. В. Курс обшей Физики т. 3. М. 1980.
4. Кортнев А.В. и др. Практикум по физике. "Высшая школа", 1963.
5. Инструкция - универсальный монохроматор УМ-2.
ТЕОРИЯ
Дискретный характер линейчатого спектра атома водорода и закономерности полученные Бальмером и Ритцем находятся в прямом противоречии с классическим истолкованием модели атома Резерфорда. Первая попытка построения неклассической теории атома была предпринята в 1913 году Нильсом Бором.
В основе этой теории лежала идея связать в единое целое эмпирические закономерности линейчатых спектров, ядерную модель атома резерфорда, квантовый характер излучения и поглощения света, подтвержденные обширным экспериментальным материалом.
В теории Бора не содержалось принципиального отказа от описания поведения электрона в атоме при помощи законов классической физики. Однако Бору пришлось классическое описание дополнить некоторыми ограничениями, накладываемыми на возможные состояния электронов в атоме. Эти ограничения были сформулированы в виде постулатов, физический смысл которых не только не мог быть объяснен в рамках теории, но, более того, противоречил сохраняющемуся в теории классическому описанию движения электрона в атоме, но, тем не менее, они привели к описанию некоторых свойств атомных систем.
Теория Бора применима не только к атому водорода, но и к так называемой водородоподобной системе, состоящей из ядра с зарядом Ze и одного электрона, вращающегося вокруг ядра Не +, Li ++ .
I постулат: существуют некоторые стационарные состояния атома, находясь в которых он не излучает энергию. (Этим состояниям соответствуют определенные орбиты, вращаясь по которым электроны не излучают энергию.)
II постулат: в стационарном состоянии атома, электрон, двигаясь по круговой орбите, должен иметь квантовые значения момента количества движения.
![]() ,
где n=1,
2, 3… .
,
где n=1,
2, 3… .
III постулат: при переходе атома из одного стационарного состояния в другое испускается или поглощается один квант энергии.
![]()
При
![]() –
выделение кванта.
–
выделение кванта.
I и III постулаты связаны с невозможностью обоснования устойчивости ядерной модели атома, а также - со спектральными закономерностями в атоме водорода и квантовой структурой излучения.
Действительно,
![]() ,а
,а
![]() ,
,
где целые числа, входящие в формулы серий определяют квантованные значения энергии.
При ni = 1 – основное энергетическое состояние или невозбужденное. При ni W = 0, т. е., если электрон удален из атома, то атом ионизирован. Знак " – " показывает, что электрон связан в атоме с ядром силой притяжения.
II постулат явился гениальной догадкой Бора. Он позволяет рассчитать спектр атома водорода.
В теории Бора сохранены основные черты планетарной модели - электроны в атомах совершают орбитальное движение вокруг ядра под действием кулоновских сил. Однако орбитами электронов могут быть не все, возможные по уравнениям механики, а только стационарные, определяемые условиями квантования.
Ограничимся рассмотрением круговых стационарных орбит, т.е., примем для атома водорода следующую модель: электрон в атоме водорода равномерно движется по окружности вокруг ядра с зарядом Ze. В этом случае центростремительной силой является кулоновская сила, следовательно, имеет место соотношение Fц = Fк.
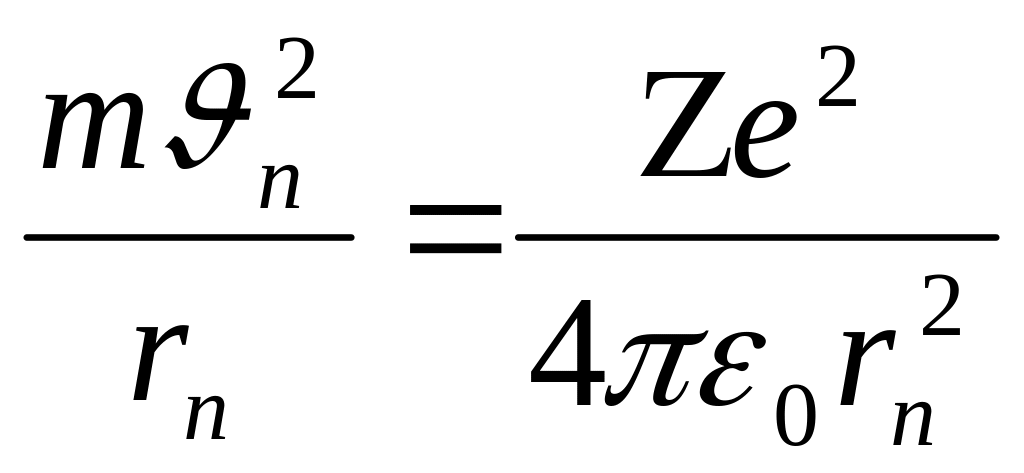 (1)
(1)
![]() (2)
(2)
где е – заряд электрона,
Z – порядковый номер элемента в таблице Менделеева.
rn – радиус орбиты.
Из всех возможных движений по окружности надо выбрать такие, которые удовлетворяют условию квантования
![]() (3)
(3)
Из (2) и (3) можно определить неизвестные n и rn
![]() откуда
откуда
![]() (4)
(4)
Чем меньше "n" (ближе орбита к ядру), тем больше скорость вращения электрона.
Подставив (4) в (3), получим:
![]() откуда
откуда
![]() (5)
(5)
т.е., радиусы стационарных орбит относятся как целые числа 1:4:9:16:25 ....
Полученные соотношения недоступны экспериментальной проверке. Для проверки теории надо вычислить такие величины, которые можно проверить на опыте. Такой величиной является энергия, излучаемая и поглощаемая атомами.
Найдем полную энергию электрона, находящегося в стационарном состоянии.
Wполн.= Wк+Wп
Поле создается положительным ядром и на расстоянии rn от него, где находится электрон, потенциал будет:
![]()
Потенциальная энергия электрона в атоме будет отрицательной.
![]()
Кинетическая энергия электрона на орбите "n" будет равна
![]() (6)
(6)
Тогда полная энергия электрона на орбите "n" будет:
![]()
![]() (7)
(7)
Подставляя (5) в (7), получим:
![]() (8)
(8)
Отрицательное значение полной энергии электрона в атоме означает, что при удалении электрона из атома не происходит выделения энергии (совершения работы), а наоборот, необходима затрата энергии извне, равная Wполн., если считать, что удаленный электрон будет иметь нулевую полную энергию.
Из (8) следует, что электрон в поле ядра может обладать только некоторыми дискретными значениями полной энергии, так как " n " может принимать значения 1, 2, 3,..., но не дробные.
Квант лучистой энергии, излученный при переходе электрона из одного стационарного состояния в другое будет равен
![]()
Введем
волновое число
![]() ,
учитывая что
,
учитывая что
![]()
![]() (9)
(9)
Обозначим множитель через R (постоянная Ридберга).
![]() (10)
(10)
Численное значение постоянной Ридберга, полученное из выражения (10) равно Rтеор. = 109737,303 см -1, а экспериментальное Rэксп. = 1О9677, 581 см -1 такое расхождение определяется несколькими причинами, одна из них состоит в том, что при выводе формулы (8) ядро атома считалось неподвижным. В действительности ядро имеет конечную массу, поэтому движение электрона и ядра происходит вокруг общего центра тяжести. Тогда энергия электрона в атоме и постоянная R будут зависеть от массы ядра и запишутся в виде:
 (11)
(11)
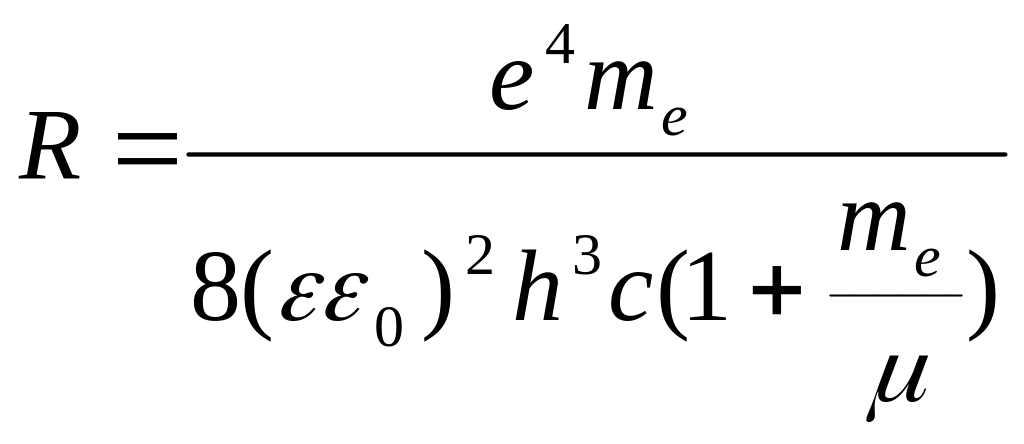 (12)
(12)
Соотношение (9) показывает, что волновые числа выражаются разностью двух слагаемых - термов, следовательно, теория Бора правильно устанавливает характер излучения водородоподобных атомов.
Теория Бора сделала ясным физический смысл спектральных серий. Спектральные серии представляют собой монохроматические излучения, которые возникают в результате перехода атома в стационарное состояние из всех возможных возбужденных состояний, расположенных выше данного. Так, серия Лаймана соответствует переходам из возбужденных состояний в нормальное, характеризуемое значением квантового числа n = 1. Волновые числа серии Лаймана выражаются соотношением:
![]() (13)
(13)
Серия Бальмера образуется в результате перехода на уровень n = 2:
![]() (14)
(14)
Идеи Бора оказались чрезвычайно плодотворными:
Теория Бора позволила выяснить физический смысл спектральных серий.
Все линии одной серии имеют границу со стороны коротких волн (n=). Эта граница и является пределом, к которому стремятся, сгущаясь линии, принадлежащие данной серии.
Все линии известные из опытных данных имеют длины волн, совпадающие с расчетными до шестого знака, что служит лучшей проверкой рассматриваемой теории спектров и оправданием постулатов.
Радиус орбиты, вычисленный по формуле (4) при n = 1 r=5,410-11м совпадает с радиусом орбиты электрона подсчитанным другим способом.
Теория Бора объясняет правильно не только спектр испускания водорода, но такие и спектр поглощения. Установлено, что спектры поглощения газообразных веществ имеют такой же линейчатый характер, как и спектры испускания. В спектре поглощения имеются те же линии, что и в спектре испускания. Однако, в то время, как в спектре излучения имеются серии Лаймана, Бальмера, Пашена и другие, в спектре поглощения атомарного водорода имеется только одна серия Лаймана. Лишь только в том случае, когда водородные атомы оказываются возбужденными, в спектре поглощения водорода обнаруживаются линии, принадлежащие серии Бальмера. По теории Бора так и должно быть, ибо нормально свободные атомы водорода находятся в стационарном состоянии с наименьшей энергией (n=1) и могут, следовательно, поглощать кванты только такой энергии, результатом поглощения которой явится переход электронов на более высокие уровни.
Теория Бора позволяет вычислить величину работы, которую необходимо совершить для удаления электрона из атома водорода, т.е. Для образования водородного иона. В нормальном состоянии электрон находится в стационарном состоянии с энергией W1= -13,5 эВ. За пределами атома водорода электрон свободен, потенциальная энергия его равна нулю и полная энергия электрона определяется только величиной его кинетической энергии. Наименьшее возможное значение кинетической энергии свободного электрона равно нулю. Поэтому за пределами атома водорода наименьшее значение энергии электрона будет также равно нулю. Очевидно, чтобы перевести электрон из основного стационарного состояния в свободное, надо затратить энергию Wполн. = 13,5 эВ. Соответствующие измерения подтвердили, что для образования иона водорода действительно необходимо затратить энергию, равную 13,5 эВ.
Бору удалось качественно объяснить закономерности расположения элементов в периодической системе Менделеева на основе представления о слоях и оболочках, в которые группируются "разреженные" состояния электронов и которые заполняются по мере увеличения числа электронов в атоме.
Теория Бора была весьма крупным шагом в развитии теории атома. Она с полной отчетливостью показала неприменимость классической физики к внутриатомным явлениям и главенствующее значение квантовых законов в микромире.
После первых успехов теории все яснее давали себя знать ее недочеты. Все попытки построения теории атома гелия окончились неудачей.
Гипотеза о том, что в стационарном состоянии движение электрона происходит по одной из орбит, не была обоснована.
Слабой стороной теории Бора была ее внутренняя противоречивость: она не была ни последовательно классической (квантование), ни последовательно квантовой теорией (понятие траектории).
Эта теория не может объяснить спектры излучения более сложных атомов и различную интенсивность спектральных линий. Эти трудности были преодолены квантовой теорией, показавшей неприменимость классических представлений к микрообъектам.
Несмотря на перечисленные недостатки, боровская теория явилась одним из важнейших этапов в создании современной квантовой механики, установившей закономерности поведения частиц малой массы и объяснившей все особенности строения и свойств атомов, молекул и твердых тел. В то же время квантовая механика, принимающая во внимание волновые свойства электрона, объяснила первые успехи боровской теории и установила пределы ее применимости. Оказалось, что в состоянии большего возбуждения атома (большие n), (когда
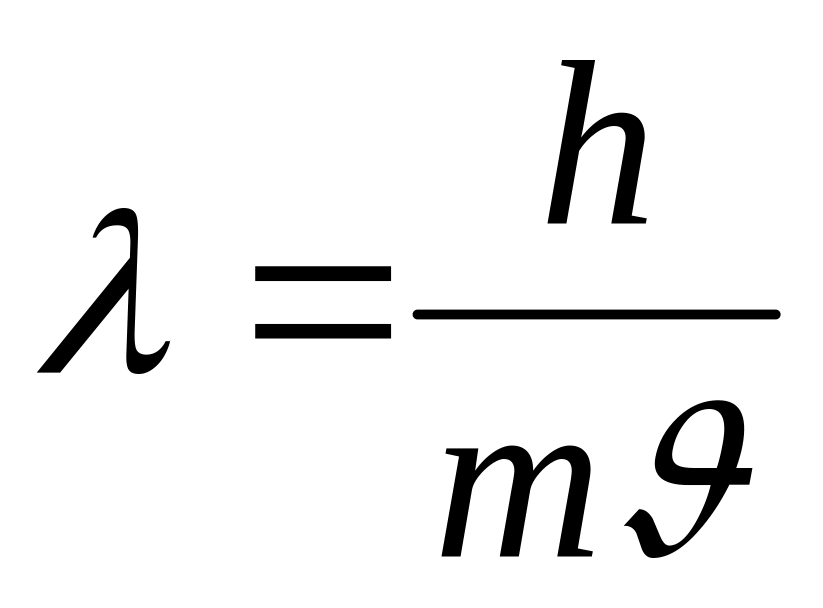 мала по сравнению с линейными размерами,
определяющими область движения
электрона) можно приближенно говорить
о траектории электрона.
мала по сравнению с линейными размерами,
определяющими область движения
электрона) можно приближенно говорить
о траектории электрона.
