
- •2. Равновесия в гетерогенных системах
- •2.1. Равновесия в насыщенных растворах малорастворимых электролитов
- •2.2. Условия образования осадка
- •2.3. Влияние ионной силы, одноименного иона и рН на растворимость осадков
- •2.4. Влияние комплексообразования на растворимость и условия осаждения малорастворимых соединений
2.4. Влияние комплексообразования на растворимость и условия осаждения малорастворимых соединений
При образовании комплексных соединений понижается равновесная концентрация ионов металла. Вследствие этого в присутствии комплексообразующих веществ растворимость осадков увеличивается. При соответствующих условиях можно понизить концентрацию ионов металла таким образом, что не будет достигаться Ks данного малорастворимого соединения. На этом основана маскирование реакций осаждения.
При расчетах условий осаждения или маскирования ионов металлов в присутствии комплексообразующих реагентов для вычисления равновесных концентраций ионов металлов и лигандов можно использовать уравнения, приведенные в разделе 1.6.
Необходимые для расчетов значения констант устойчивости комплексов и Ks малорастворимых соединений могут быть взяты из соответствующих таблиц приложения. Для простоты вычислений коэффициенты активности не учитываются.
Пример
16. Образуется
ли осадок PbSO4,
если к 1×10-4
М раствору нитрата свинца, содержащему
2 М ацетат . натрия, добавить 0.01 М сульфат
натрия. В указанных условиях преобладает
ацетатный комплекс состава
![]()
Решение. По таблице 4 находим, что константа устойчивости комплекса равна 25.7. Вычислим равновесную концентрацию ионов Рb2+ по уравнению (1.121), принимая общую концентрацию комплекса равной концентрации взятой соли, т. е. 1×10-4 М:
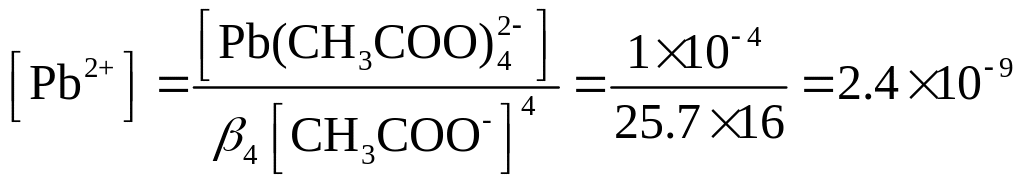
ИП в данном растворе будет равно ИП = [Pb2+][SO42-] = 2.4×10-7×10-2 = 2.4×10-9. Полученное значение меньше величины KS (1.6×10-8), следовательно, осадок PbSO4 не образуется.
Пример 17. При какой концентрации аммиака не будет образовываться осадок AgCl, если к 5×10-3 М раствору нитрата серебра добавить 0.1 М хлорид калия?
Решение. Ионы Ag+ образуют аммиачные комплексы состава Ag(NH3)+ и Ag(NH3)2+. Константы устойчивости их равны соответственно 1.74×103 и 1.12×107.
Чтобы осадок AgCl не образовывался при указанной концентрации С1-, необходимо, чтобы концентрация ионов серебра не превышала следующей величины:

По уравнению (1.129) находим закомплексованность

Равновесная концентрация аммиака может быть вычислена по уравнению (1.130)
![]()
В первом приближении можно пренебречь первыми двумя слагаемыми, тогда
![]()
При этой концентрации аммиака комплекс Ag(NH3)2+ будет преобладать в растворе, поэтому расчет можно не уточнять.
Находим общую концентрацию аммиака, при которой не будет образовываться осадок AgCl C
![]()
Пример 18. К 10-3 М раствору хлорида цинка добавлен 0.2 М КОН. Образуется ли осадок ZnS, если ввести в этот раствор 0.1 М Na2S. В данных условиях цинк образует комплексный анион Zn (OH)42- , константа устойчивости которого β4 равна 2×1015, KS (ZnS) 1.6×10-24.
Решение. Находим равновесную концентрацию иона Zn2+ по уравнению (1.121)

Концентрацию Zn(OH)42- можно принять равной общей концентрации соли (10-3 М), а равновесную концентрацию ОН- ионов приравнять общей концентрации КОН, взятого в большом избытке.
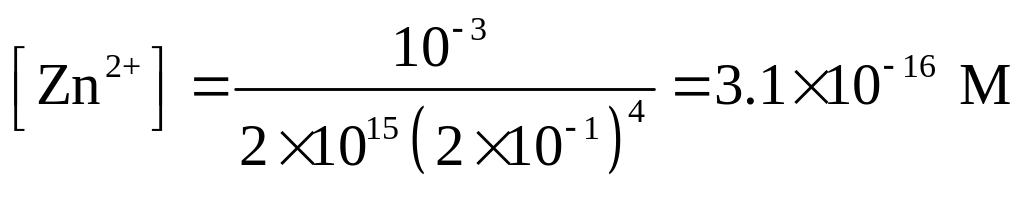
Для вычисления концентрации сульфид-иона необходимо знать концентрацию ионов водорода. В 0.2 М растворе КОН
![]()
При этих условиях уравнение (1.101) для расчета [S2-] примет вид

Вычислим ИП ионов Zn2+ и S2- в исследуемом растворе
ИП - [Zn2+] [S2-] = 3.1×10-16×0.83= 2.58×10-16
ИП > KS, осадок ZnS образуется.
Пример 19. Будет ли происходить осаждение ZnC2O4 при добавлении к 10-3 раствору аммиачных комплексов цинка 0.1 М оксалата натрия, если равновесная концентрация аммиака в растворе составляет 0.1 М; KS (ZnC2O4) = 2.75.1O-8?
Решение. Вычисляем функцию закомплексованности в данном растворе (уравнение 1.130). Константы устойчивости аммиачных комплексов цинка равны β1 = 2.34×102; β 2 = 6.45×04; β3 = 2.04×107; β4 - 2.88×109.
Ф = 1 + 2.34×102-0,1 + 6.45×104×10-2 + 2.04×107×10-3 + 2.88×109×10-4 = 1 + 23.4 + 645 + 2.04×104 + 2.88×105 = 3.09×105.
Найдем равновесную концентрацию ионов Zn2+ из уравнения (1.129)
![]()
Вычисляем ионное произведение
ИП - [Zn2+] [С2О42-] = 3×10-9 ×10-1 = 3×10-10;
ИП < Ks, осадок в данных условиях не образуется.
З а д а ч и
Образуется ли осадок тиоцианата серебра из 1×10-2 М раствора аммиачного комплекса серебра при добавлении к нему 0.1 М тиоцианата калия, если равновесная концентраций аммиака составляет 1.0 М и в данных условиях преобладает комплекс
 ?
?Будет ли образовываться осадок Cd(ОН)2 в 5×10-3 М растворе аммиачного комплекса кадмия Cd (NH3)42+, если равновесная концентрация аммиака равна 0.1 М?
При равновесной концентрации аммиака, равной 1.0 М, Ni2+ образует в основном коммплекс состава Ni(NH3)42+. Может ли в этих условиях образовываться осадок Ni(OH)2, если общая концентрация ионов Ni2+ равна 1×10-2 М?
При равновесной концентрации аммиака, равной 0.1 М, ионы меди (II) образуют комплексыCu(NH3)22+, Cu(NH3)32+ и Cu(NH3)42+. Вычислить равновесные концентрации Сu2+ и ОН- и оценить возможность образования осадка Сu(ОН)2, если общая концентрация Сu (II) равна 1×10-3 М.
При равновесной концентрации ОН-, равной 0.2 М, Рb (II) существует в растворе в виде гидроксо-комплекса Рb(ОН)3-. Образуется ли осадок PbSO4; если в этих условиях к 0.02 М раствору плюмбита добавить 0.5 М сульфат натрия?
270. Будет ли осаждаться сульфид цинка из раствора, содержащего 0.01 М ZnCl2 и 1.04 М KCN, если общая концентрация сероводорода, пропущенного через этот раствор, равна 0.1 М, а рН равен 12? В указанных условиях Zn2+ образует в основном комплекс Zn(CN)42-.
271. При равновесной концентрации аммиака, равной 0.5 М, Си (II) существует в растворе в основном в виде комплексных ионов Cu(NH3)42+. Образуется ли осадок сульфида меди, если в этих условиях через 0.01 М раствор аммиачного комплекса меди (II) пропустить сероводород в таком количестве, чтобы общая концентрация его была равна 0.05 М?
Будет ли происходить осаждение сульфида ртути (II), если в 1×10-2 М раствор иодидного комплекса ртути (II), в котором равновесная концентрация I- равна 1 М, пропустить сероводород до насыщения при рН = 2? В данных условиях в растворе образуется в основном комплекс состава HgI42-.
При какой концентрации S2О32- в растворе не будет образовываться осадок бромида серебра при добавлении к 0.01 М раствору нитрата серебра 0.1 М бромида калия? Состав тиосульфатного комплекса серебра, который будет в этих условиях доминировать в растворе, соответствует формуле Ag(S2O3)23-.
Найти концентрацию S2O32-, необходимую для маскирования ионов серебра в 1×10-3 М растворе AgNO3, к которому добавлен 0.1 М КС1, если в данных условиях в основном может образовываться комплекс Ag(S2O3)23- .
Ионы меди образуют с тиосульфат-ионами комплексы Cu(S2O3)-, Cu (S2O3)23- и Cu(S2O3)35-. Будет ли осаждаться CuI, если к 1×10-3 М раствору тиосульфатных комплексов меди (I), в котором равновесная концентрация S2O32- равна 0.01 М, добавить 0.1 М KI?
276. Сколько г бромида калия необходимо добавить к 100 мл 2×10-3 М раствора аммиачного комплекса серебра Ag(NH3)2+, в котором равновесная концентрация аммиака равна 5×10-1 М, чтобы образовался осадок бромида серебра?
Сколько г оксалата натрия надо добавить к 250 мл 0.01 М раствора аммиачных комплексов цинка, в котором равновесная концентрация аммиака равна 10-1 М, чтобы мог образоваться осадок ZnC2O4? В указанных условиях возможно образование нескольких комплексов цинка Zn (NH3)2+, Zn(NH3)22+, Zn (NH3)32+ и Zn(NH3)42+.
В присутствии избытка цианид-ионов Сu(I) образует в основном комплекс Сu(CN)43-. Будет ли происходить осаждение Cu2S из 1×10-2 М раствора цианидного комплекса Сu(I), если равновесная концентрация цианид-ионов равна 0.1 М, а концентрация сульфид-ионов составляет 5× 10-3 М?
Найти концентрацию сульфид-иона, при которой будет происходить осаждение сульфида кадмия из 5× 10-3 М раствора CdCl2, содержащего цианид калия, если равновесная концентрация цианид-ионов равна 0.05 М. В данных условиях возможно образование комплексов Cd(CN)+, Cd(CN)2, Cd(CN)3- и Cd(CN)42-.
К 50 мл 1×10-2 M раствора СаС12, содержащего 2×10-2 M этилендиаминтетрауксусную кислоту, добавлен 0.1 г фторида натрия. Образуется ли осадок CaF2, если рН раствора равен 6?
Сколько г оксалата натрия надо добавить к 100 мл 1×10-3 М раствора СаС12, содержащего 1.5×10-3 М этилендиаминтетрауксусную кислоту, чтобы образовался осадок СаС2О4, если рН раствора равен 7?
282. Какова должна быть концентрация гидроксид-ионов для маскирования осаждения ZnCO3 в 2×10-3 М растворе ZnSO4 при добавлении к нему 0.1 М карбоната натрия, если в данных условиях может образоваться комплекс Zn(ОН)42-?
283. При какой концентрации аммиака не будет образовываться осадок оксалата меди (II) при добавлении к 5× 10-3 М раствору сульфата меди (II) 0.1 М оксалата натрия, если считать, что в этих условиях образуется комплекс Cu(NH3)42+?
Численные значения см. в приложении
В задачах №№ 236-264 влияние ионной силы раствора на растворимость осадков не учитывать
