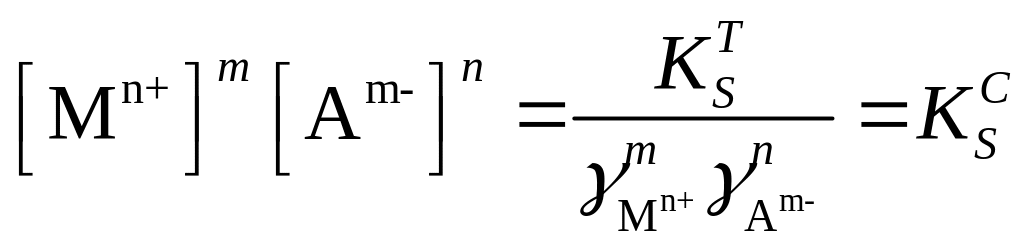- •2. Равновесия в гетерогенных системах
- •2.1. Равновесия в насыщенных растворах малорастворимых электролитов
- •2.2. Условия образования осадка
- •2.3. Влияние ионной силы, одноименного иона и рН на растворимость осадков
- •2.4. Влияние комплексообразования на растворимость и условия осаждения малорастворимых соединений
2.3. Влияние ионной силы, одноименного иона и рН на растворимость осадков
Термодинамическая константа растворимости для осадка состава МmАn записывается следующим образом:
|
(2.6) |
Зная,
что
![]() (уравнение 1.16), можно найти зависимость
между произведением концентраций ионов
и термодинамической константой
растворимости (
).
(уравнение 1.16), можно найти зависимость
между произведением концентраций ионов
и термодинамической константой
растворимости (
).
|
(2.7) |
|
(2.8) |
Величина коэффициента активности зависит от ионной силы раствора и уменьшается с ее увеличением (формулы для соответствующих расчетов приведены в уравнениях 1.17, 1.18, 1.19). Следовательно, растворимость осадка зависит также от ионной силы раствора: с ее возрастанием растворимость повышается С этим явлением связан так называемый солевой эффект - увеличение растворимости осадка в присутствии посторонних солей.
Пример
9, Вычислить
растворимость хлорида серебра в 0.05М
растворе нитрата калия и сравнить ее с
растворимостью хлорида серебра в чистой
воде.
![]()
Решение. Обозначим растворимость AgCl в воде через х и подставим в выражение для
![]()
![]()
![]()
Для определения растворимости осадка в растворе нитрата калия вычислим ионную силу и коэффициент активности. При этом концентрациями ионов Ag+ и Сl- можно пренебречь, так как они незначительны по сравнению с концентрацией посторонней соли.
![]()
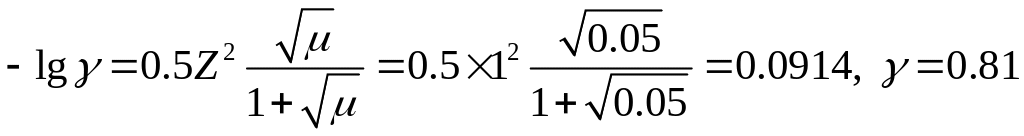
Если через х1 обозначить растворимость AgCl в растворе нитрата калия, то по уравнению (2.8) получим
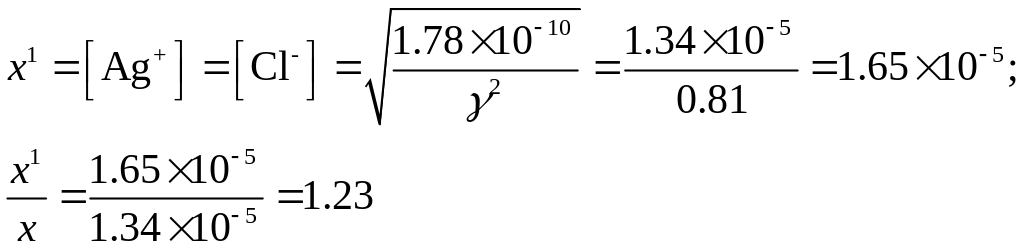
Растворимость хлорида серебра в 0.05 М растворе нитрата калия возросла в 1.23 раза по сравнению с растворимостью его в отсутствие посторонних ионов.
Изменение концентраций ионов, входящих в состав осадка, приводит к нарушению существовавшего равновесия и установлению нового. При увеличении концентрации одного из ионов малорастворимого соединения в насыщенном растворе его уменьшается концентрация другого иона. При этом равновесие между осадком и раствором сместится в сторону образования твердой фазы и количество осадка увеличится. На этом основано действие избытка осадителя для достижения полноты осаждения.
Рассмотрим, как вычисляется изменение равновесных концентраций в насыщенном растворе, происходящее при введении одноименного иона.
Пример
10.
Смешано по 1×10-3
М хлорида бария и 1.5×10-3
М раствора сульфата натрия. Вычислить
концентрацию ионов Ва2+
в растворе;
![]()
Решение. Найдем концентрацию ВаС12 и Na2SO4 после разбавления:
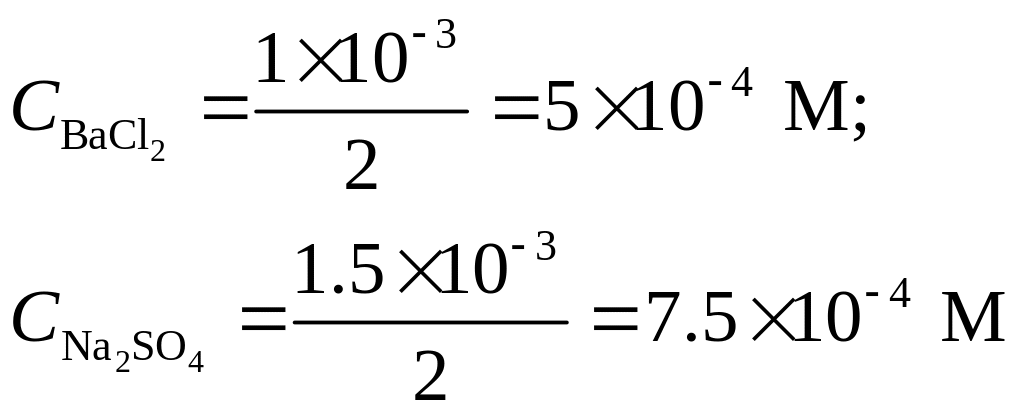
Сульфат натрия находится в избытке.
Равновесную концентрацию SO42- находим, учитывая происшедшую в системе реакцию
ВаС12 + Na2SO4 = BaSO4 + 2NaCl,
![]()
Концентрацию ионов Ва2+ определяем из константы растворимости
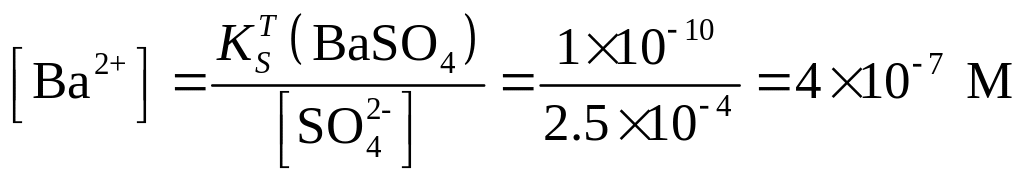
Пример
11. Как
изменится концентрация иона Mg2+,
если в насыщенном растворе
магний-аммоний-фосфата концентрацию
фосфат-ионов увеличить в 2 раза, а иона
аммония - в 8 раз ?
![]()
Решение. Выразим константу растворимости магний-аммоний-фосфата через произведение концентраций входящих в состав соли ионов
![]()
В насыщенном растворе [Mg2+] = [NH4+] = [PO43-] = x;
![]()
Таким образом, концентрация ионов Mg2+ в насыщенном растворе равна 6.3×10-5 М. После увеличения, в соответствии с условиями задачи, концентрации ионов фосфата и аммония изменятся
![]()
![]()
Тогда концентрация ионов магния станет равной

Концентрация
ионов Mg2+
вследствие увеличения концентрации
ионов NH4+
и РО43-
уменьшилась в
![]() раза.
раза.
Заметное влияние на растворимость осадков, образованных анионами слабых кислот, оказывает кислотность раствора, поскольку концентрация анионов-осадителей зависит от рН раствора.
Рассмотрим равновесие в насыщенном растворе соли МА (А- - анион слабой кислоты) в присутствии ионов водорода
|
(2.9) |
Константа равновесия реакции (2.9) запишется следующим образом:
|
(2.10) |
Константа равновесия реакции (2.9) будет тем больше, чем больше соли и меньше константа диссоциации кислоты.
Для выявления условий осаждения малорастворимых солей необходимо определить равновесную концентрацию аниона-осадителя при заданном рН, либо решить обратную задачу: найти концентрацию ионов водорода, при которой [A-] будет достаточной для образования осадка.
Равновесия в растворах слабых одноосновных и многоосновных кислот рассмотрены в разделах 1.1 и 1.4. Воспользуемся уравнениями (1.96-1.106) , выведенными для расчета равновесных концентраций анионов слабых кислот, и рассмотрим ряд примеров, показывающих, каким образом рН среды влияет на растворимость малорастворимых солей.
Пример
12.
Образуется ли осадок CaF2,
если к 0.01 М раствору CaCl2,
содержащему 1 М HCl,
добавлен 0.1 М NaF
?
![]()
![]()
Решение. Найдем равновесную концентрацию F- иона по уравнению (1.97), поскольку [H+] >> KHF.
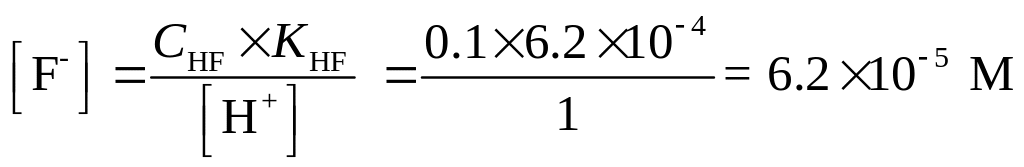
CHF = 0.1 M, [H+] = [HCl] = 1 M
ИП = [Ca2+][F-]2 = 1×10-2×(6.2×10-5)2 = 3.85×10-11
ИП < , следовательно, осадок не образуется.
Пример 13. При какой концентрации ионов водорода не будет происходить осаждение CaF2 при добавлении к 1×10-3 М CaCl2 0.05 М NaF ?
Решение. Предельное значение равновесной концентрации F- иона, ниже которой осадок не будет образовываться, может быть найдено из следующего соотношения:
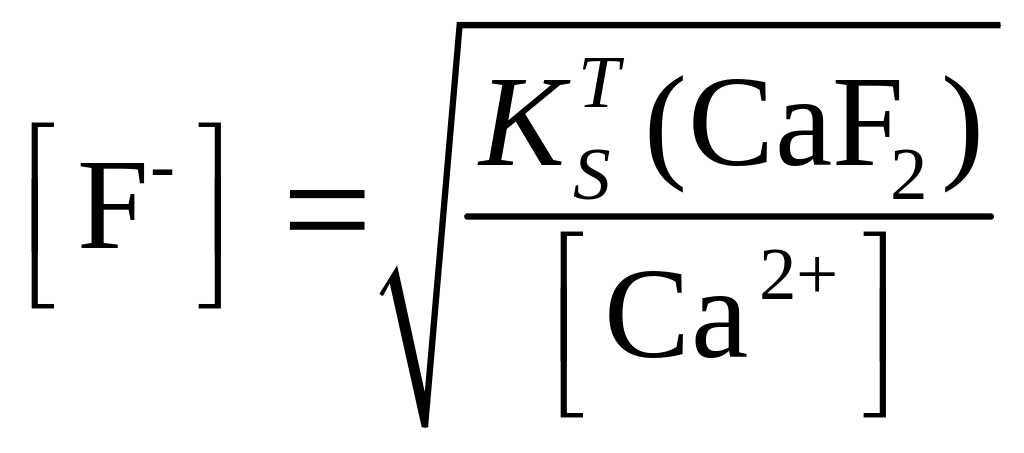
При концентрации ионов Са2+, равной 1×10-4 М
![]()
По уравнению (1.96) вычислим концентрацию ионов водорода, при которой равновесная концентрация F- ионов не будет превышать найденное значение:

Пример
14. Найти
растворимость BaF2
в 0.1 М HCl
![]()
![]() .
.
Решение. В данных условиях имеет место следующее равновесие:
![]()
Обозначим растворимость осадка через х. Тогда концентрация ионов Ва2+ тоже будет равна х; общая концентрация фтороводородной кислоты и ее анионов (СОбш..hf) соответственно 2х. Определим концентрацию F- ионов.
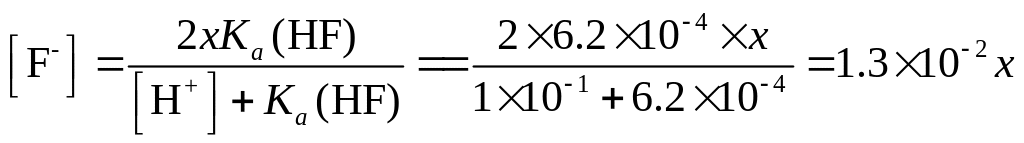
Из величины Ks осадка можно вычислить:
![]()
![]()
![]()
В случае многоосновных кислот при расчете концентрации анионов в зависимости от рН воспользуемся уравнениями (1.96, 1.101, 1.102).
Пример
15. Найти
растворимость гидрофосфата кальция в
10-3
М
НС1.
![]() ,
,![]() ,
,![]() ,
,
![]() .
.
Решение.
![]()
В этих условиях при взаимодействии осадка с ионами водорода наряду с недиссоциированными молекулами Н3РО4 в растворе могут находиться ионы Н2РО4-, HPO42-, РО43-.
Если обозначить растворимость, осадка через x, то общая концентрация всех форм фосфорной кислоты также будет равна х.
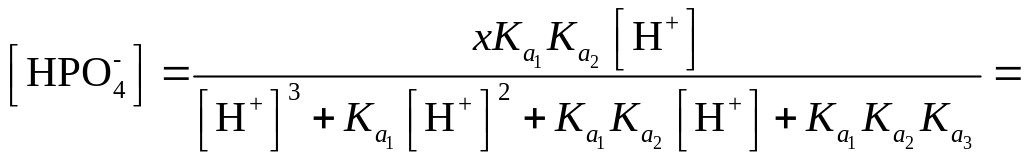
![]()
![]()
![]()
З а д а ч и
Вычислить растворимость сульфата бария в 0.1 М растворе хлорида калия.
Определить растворимость хромата серебра в 0.05М растворе нитрата натрия.
Определить растворимость фосфата серебра в 0.05М растворе нитрата калия.
Определить растворимость хромата стронция: а) в 0.01 М хлориде калия; б) в 0.01 М нитрате магния; в) в 0.01 М хлориде алюминия.
Определить растворимость роданида серебра в 0.02 М растворе сульфата алюминия. Во сколько раз растворимость в растворе соли превышает растворимость в воде?
Зная, что
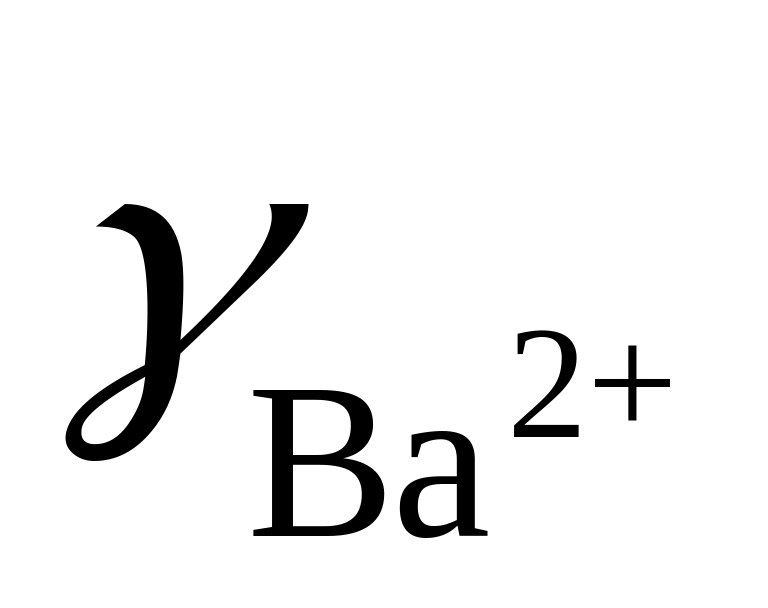 =
0.38 и
=
0.38 и
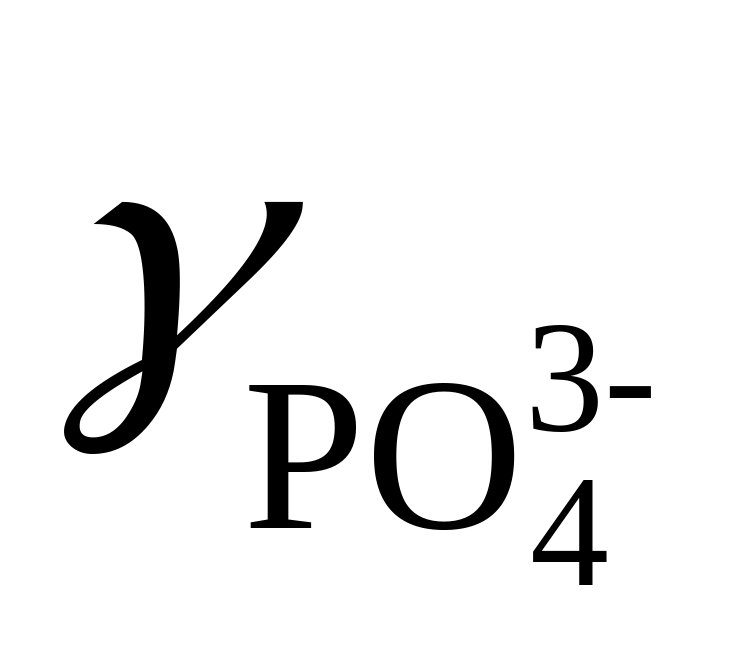 = 0.095 (μ =0.1), вычислить произведение
активностей фосфата бария, если
растворимость его в данных условиях
0.225 мг/100 мл.
= 0.095 (μ =0.1), вычислить произведение
активностей фосфата бария, если
растворимость его в данных условиях
0.225 мг/100 мл.
236. В насыщенном растворе сульфата бария концентрация иона бария увеличена в 10 раз. Рассчитать концентрацию сульфат-иона.
B насыщенном растворе фторида кальция концентрация иона кальция увеличена в 10 раз. Найти концентрацию фторид-иона.
В насыщенном растворе иодида свинца концентрация иодид-ионов увеличена в 10 раз. Найти концентрацию иона свинца.
В насыщенном растворе магний-аммоний-фосфата концентрация фосфат-иона увеличена в 2 раза. Вычислить концентрацию иона магния.
В насыщенном растворе магний-аммоний-фосфата концентрация фэсфат-иона увеличена в 3 раза, а концентрация иона аммония - в 10 раз. Определить концентрацию иона магния.
Какова концентрация ионов серебра в растворе, если к 5.5 л насыщенного раствора бромида серебра добавлено 100 мл 7%-ного раствора бромида калия?
Какова концентрация ионов магния в растворе, если к 100 мл насыщенного раствора гидроксида магния добавлено 10 мл 2%-ного раствора гидроксида натрия?
К 400 мл насыщенного раствора магний-аммоний-фосфата прибавлено 40 мл 10%-ного раствора фосфата аммония. Найти концентрацию ионов магния.
К 200 мл насыщенного раствора магний-аммоний-фосфата прибавлено 20 мл 11%-ного раствора фосфата натрия. Найти концентрацию ионов магния в этом растворе.
Смешано по 500 мл 3%-ного раствора нитрата серебра и 1%-ного раствора хлороводородной кислоты. Рассчитать концентрацию ионов серебра в этом растворе.
Смешано по 1 л насыщенных растворов сульфата свинца и хлорида свинца. Найти концентрацию сульфат-ионов.
Образуется ли осадок CaF2 в растворе, содержащем 0.01 М СаС12 и 0.1 М NaF при рН = 1.3?
Образуется ли осадок BaF2 в растворе, содержащем 1×10-2 М ВаС12 и 0.1 M NaF при рН = 2?
Будет ли образовываться осадок PbF2 в растворе, содержащем 1×10-2 М Pb(NO3)2 и 01 М NaF, при концентрации ионов водорода, равной 0,4 г-ион/л?
Найти растворимость CaF2, если рН раствора равен 1?
Найти растворимость CaF2, если рН раствора равен 3?
Оценить возможность образования осадка РbС2О4 в растворе, содержащем 0.01 М Pb(NO3)2 и 0.1 М Na2C2O4, если рН раствора равен 1.
253. Как изменится растворимость Ag2C2O4 при изменении кислотности от [H+] = 2 M до рН = 5?
254. Образуется ли осадок сульфида цинка в растворе, содержащем 2×10-2 М ZnCl2 при насыщении его сероводородом, если рН раствора равен 2.3, а концентрация сероводорода равна 0.l M?
Произойдет ли осаждение сульфида цинка в растворе, содержащем 1 г хлористого цинка в 250 мл, при насыщении его сероводородом? рН = 2.5; концентрация сероводорода 0/1 М.
Образуется ли осадок сульфида кадмия в растворе, содержащем 5×10-4 М сульфат кадмия, при насыщении его сероводородом? Концентрация сероводорода 0.1 М, рН = 0.5.
Будет ли происходить осаждение сульфида марганца в растворе при насыщении сероводородом, если концентрация МnС12 в этом растворе равна 5×10-2 моль/л, рН = 2?
Образуется ли осадок сульфида марганца в растворе, содержащем 2×10-1 М сульфат марганца, при насыщении его сероводородом ? Концентрация сероводорода 0.1 М, рН = 12.3.
Возможно ли образование осадка сульфида никеля в растворе, содержащем 1×10-5 М сульфат никеля при насыщении его сероводородом? Концентрация сероводорода 0.1 М, рН = 2.3.
Образуется ли осадок сульфида цинка, если раствор, содержащий 0.5 М уксусную кислоту и 2×10-3 М хлорид цинка, насыщать сероводородом? Концентрация сероводорода 0.1 М.
Образуется ли осадок сульфида цинка, если раствор, содержащий 0.5 М соляную кислоту и 2×10-3 М хлорид цинка, насыщать сероводородом? Концентрация сероводорода 0.1 М.
При каком значении рН не будет образовываться осадок сульфида железа (II), если раствор, содержащий 5×10-3 М сульфат железа (II), насыщать сероводородом? Концентрация сероводорода 0.1 М.
При каком значении Ks не будет образовываться осадок сульфида катиона трехвалентного металла в 1×10-3 М растворе соли этого катиона при насыщении сероводородом? Концентрация сероводорода 0.1 М, рН = 3.
При каком значении рН раствора происходит практически полное осаждение 1×10-5 М сульфида цинка, если раствор насыщать сероводородом? Концентрация сероводорода 0.1 М.