
- •ГЕНЕТИКА
- •Генетичне картування прокаріот ………….…….
- •Кількість ауксотрофних мутантів
- •Загальні відомості
- •Визначення концентрації життєздатних частинок бактеріофага Т4В
- •Література: [1, 2, 3, 4, 12].
- •Загальні відомості
- •Суспензія
- •1 петля
- •2 петлі
- •1 петля
- •Камера Горяєва,
- •Література: [2, 4, 6].
- •Розрахунок розведень вихідної суспензії клітин S. cerevisiae 15В-П4
- •після опромінення різними дозами УФ-променів (концентрація суспензії 5×106 клітин/мл)
- •4,9 мл води
- •0,9 мл води
- •0,9 мл води
- •0,9 мл води
- •КОНТРОЛЬ
- •ДОСЛІДИ
- •0,1 мл 0,5 М NaNO2
- •Витримка
- •Витримка
- •Витримка
- •0,1 мл 0,5 М NaNO2
- •0,1 мл 0,5 М NaNO2
- •Загальні відомості
- •Таблиця 5.1
- •Ростові фактори для ідентифікації біохімічних мутантів*
- •ПС + пептон
- •Контрольні запитання
- •Література: [1, 2, 5, 9].
- •Загальні відомості
- •ПА + стрептоміцин
- •Фосфатний буфер, 4,5 мл × 6× 3
- •Контрольні запитання
- •Література: [2, 3, 6, 9].
- •Нічна культура E. coli
- •Селективні середовища
- •Селективні середовища
- •Фосфатний буфер,
- •Колба, 50 мл
- •Фосфатний буфер,
- •Контрольні запитання
- •Література: [1, 2, 3, 8, 10, 11, 12].
- •Загальні відомості
- •Опрацювання результатів
- •Контрольні запитання
- •Література: [1, 2, 4, 5, 8, 11,12].
- •Рис.8.1. Виділення ДНК з Bacillus subtilis 23
- •Базова
- •Допоміжна
- •Осад ДНК
- •Осад ДНК
- •Осад очищеної ДНК
- •Віджати від спирту,
- •Розчин ДНК
- •Повторна депротеїнізація
- •та центрифугування, осадження 96 % і промивання 70 % етанолом
- •Розчин ДНК з РНКазою
|
|
|
|
|
|
56 |
|
|
|
|
|
|
|
Таблиця 5.1 |
|
|
Ростові фактори для ідентифікації біохімічних мутантів* |
||||||
Чашк |
1 |
2 |
3 |
4 |
5 |
6 |
|
и |
|||||||
|
|
|
|
|
|
||
7 |
Аденін |
(Біотин) |
Феніл- |
Аланін |
Аргінін |
Лейцин |
|
аланін |
|||||||
|
|
|
|
|
|
||
8 |
Гипоксан- |
Фолієва |
Серин |
Цистеїн |
Орнітин |
Гліцин |
|
тин |
кислота |
||||||
|
|
|
|
|
|||
|
|
Пантоте- |
Трипто- |
Треонін |
Аспарагі- |
|
|
9 |
Цитозин |
нова |
нова |
Ізолейцин |
|||
фан |
|||||||
|
|
кислота |
|
кислота |
|
||
|
|
|
|
|
|||
|
|
Піридок- |
Тирозин |
Тіосуль- |
|
|
|
10 |
Гуанін |
фат |
Пролін |
Гістидин |
|||
|
|
син |
|
натрію |
|
|
|
|
|
|
|
|
|
||
|
|
|
Парааміно- |
|
Глута- |
|
|
11 |
(Тимін) |
(Тіамін) |
бензойна |
Метіонін |
мінова |
Лізин |
|
|
|
|
кислота |
|
кислота |
|
|
12 |
Урацил |
Рибофла- |
Нікотино- |
Холін |
Інозит |
Валін |
|
|
|
він |
ва кислота |
|
|
|
|
*У дужках наведені речовини, що входять до складу мінімального середовища для сахароміцетів, а також незасвоювані ними.
У разі висіву 12 чашок ріст спостерігається на одній чашці по горизонталі (з ряду 1 – 6) і на одній чашці по вертикалі (з ряду 7 – 12). Так, аденінзалежний мутант ростиме на чашках № 1 і № 7, аланінзалежний – на чашках № 7 і № 4 і т.д.
Проводячи ідентифікацію специфічності ауксотрофії, аналізують вирослі колонії. З них відбирають тільки ті варіанти, які дають ріст на повному середовищі й не ростуть на мінімальному (необхідно порівняти дві чашки).
Завдання на виконання
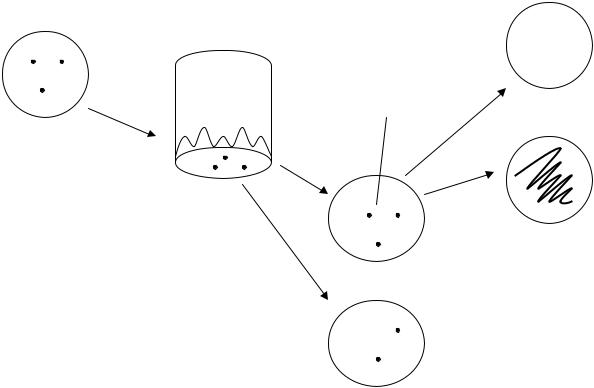
I. Метод відбитків для відбору мутантів. За методом відбитків для відбору мутантів використовують чашки з колоніями дріжджів, що виросли після обробки УФ-променями або азотистою кислотою (нітритом натрію) (рис. 5.1).
Кожну з чашок з колоніями, що виросли з мутагенобробленої культури дріжджів 15B-ПЧ, відбивають за допомогою оксамиту на дві чашки із повним середовищем з пептоном та мінімальним середовищем.
Засіяні чашки вміщують у термостат на дві доби при температурі 30 °С. Через дві доби оглядають вирослі колонії. На повному середовищі з пептоном мають вирости всі колонії, на мінімальній – тільки прототрофи. Порівнюють ріст колоній з ростом у вихідній культурі. На мінімальному середовищі ауксотрофи утворять лише плями клітин, що не діляться. Колонії, що виросли на тих же місцях на чашках із повним середовищем з пептоном, відсівають на повне й мінімальне середовища для перевірки на наявність аксотрофних мутантів.
57
Засіяні чашки вміщують у переверненому вигляді в термостат з
температурою 30 °С на п’ять діб. |
|
|
|
МС |
|
ПС |
5 |
|
2 |
||
|
||
АТ |
АТ |
|
1 |
|
|
4 |
6 |
|
|
ПС |
|
|
ПС + пептон |
МС
3
Рис. 5.1. Схема постановки дослідів методом відбитків (реплік):
1 – чашка Петрі з колоніями дріжджів, що виросли після обробки мутагеном; 2 – відбиток колоній на оксамиті; 3, 4 – відбитки колоній з оксамиту на чашки з повним + пептон (ПП) і мінімальним (МС) середовищами; 5, 6 – відбір ауксотрофних мутантів із повного середовища (ПС) і МС; АТ – колонія ауксотрофа
II. Ідентифікація ауксотрофних мутантів. У порожню стерильну чашку,
попередньо марковану номером суміші факторів, вносять 0,1 мл розчину певного ростового фактора (див. табл. 5.1). Потім чашки заливають 20 мл теплого розплавленого мінімального середовища. Після застигання середовища чашки із середовищем вміщують у сушильну шафу з температурою близько 70 °С на 5 хв для підсушування середовища. Чашку з лунками протирають спиртом, обпалюють, після чого в кожну з лунок вносять стерильною піпеткою по 1 мл стерильної дистильованої води, у якій готують суспензію клітин із відібраних колоній ауксотрофних мутантів.
Для орієнтування в аналізі результатів на дні засіяних чашок з ростовими добавками, а також на контрольних чашках з повною й мінімальною дозами необхідно накреслити зліва направо стрілку, за якою буде орієнтований реплікатор.
