
- •Аптечная технология
- •Часть II
- •Витебск вгавм
- •Свойства ингредиентов
- •Лицевая сторона паспорта письменного контроля
- •Свойства ингредиентов
- •Свойства ингредиентов
- •Оборотная сторона паспорта письменного контроля
- •Свойства ингредиентов
- •Оборотная сторона паспорта письменного контроля
- •Свойства ингредиентов
- •Оборотная сторона паспорта письменного контроля
- •Для приготовления 20 суппозиториев необходимо 1,11 г эритромицина.
- •Содержание
- •Аптечная технология
- •Часть II
- •210026, Г. Витебск, ул. 1-я Доватора, 7/11.
Свойства ингредиентов
Acidum salicylicum – белые мелкие игольчатые кристаллы или легкий кристаллический порошок без запаха. Мало растворима в холодной воде (1:500), растворима в горячей воде (1:5), легко растворима в спирте (1:3).
Bismuthi subnitras – белый аморфный или мелкокристаллический порошок. Практически не растворим в воде и спирте, легко растворим в соляной кислоте.
Camphora – белые кристаллические куски, или бесцветный кристаллический порошок, или спрессованные плитки с кристаллическим строением, легко режущиеся ножом и слипающиеся в комки. Обладает сильным характерным запахом и пряным, горьким, затем «охлаждающим» вкусом. Мало растворима в воде, легко – в спирте, эфире, хлороформе, жирных и эфирных маслах.
Хранение. Список Б.
Vaselinum – однородная тянущаяся нитями мазеобразная масса без запаха, белого или желтого цвета. Хранят в хорошо закупоренных банках, в прохладном месте.
Lanolinum hydricum – ланолин водный: густая вязкая масса желтовато-белого цвета. Состав: ланолина безводного 75 частей, воды 25 частей.
Хранят в хорошо укупоренной таре, предохраняющей от действия света, в сухом прохладном месте.
Ингредиенты прописи совместимы.
Выписана сложная лекарственная форма для наружного применения – мазь.
При приготовлении лекарственной формы расчеты не выполняются, поэтому оборотная сторона паспорта письменного контроля не заполняется.
В рецепте прописана комбинированная мазь, содержащая мазь-суспензию и мазь раствор.
Мазь-раствор представляет собой мазь, содержащую вещество растворимое в основе (камфора). Суспензионными называются мази, содержащие сухие вещества, нерастворимые в основе и распределенные в ней по типу суспензии (кислота салициловая и висмута нитрат основной). Общая масса мази равна 23,2 г, масса сухих веществ 5,0, что составляет 5,0·100/23,2=21,5%, следовательно для лучшего диспергирования сухие вещества измельчают с частью (1/2 массы твердой фазы) расплавленной основы.
В выпарительную чашку вносят 10 г вазелина и 8,0 ланолина и сплавляют на водяной бане, перемешивают до однородности. Когда температура смеси будет не более 40ºС в нее добавляют 0,2 г камфоры и перемешивают до полного растворения. В предварительно подогретую ступку вносят 2,0 г висмута нитрата основного и 3,0 кислоты салициловой, добавляют около 2,5 г приготовленной мази-раствора, тщательно перемешивают. К полученной пульпе добавляют оставшуюся мазь, перемешивают. Помещают во флакон для отпуска.
Готовая мазь отпускается в баночке из оранжевого стекла. Наклеивают номер рецепта, основную этикетку «Наружное» и дополнительную этикетку «Хранить в прохладном и защищенном от света месте».
Лицевая сторона паспорта письменного контроля
Дата 08.12.11 № рецепта 12
Vaselini 10,0
Lanolini 8,0
Camphorae 0,2
Bismuthi subnitratis 2,0
Acidi salicylici 3,0
Общая масса = 23,2 г
Приготовил (подпись)
Проверил (подпись)
Отпустил (подпись)
Самостоятельная работа на занятии.
Приготовить лекарственные формы по рецептам и оформить к отпуску.
Поросенку.
Recipe: Oxytetracyclini
hylrochloridi 0,5
Anaesthesini 0,1
Vaselini 25,0
Lanolini 5,0
Misce. Da. Signa. Наружное. Наносить два раза в день
на пораженные участки кожи.
Собаке.
Recipe: Acidi salicylici 0,5
Zinci oxydi 10,0
Talci 2,5
Vaselini ad 25,0
Misce. Da. Signa. Наружное. Наносить два раза в день
на пораженные участки кожи.
Литература.
1. Гаврилов А.С. Фармацевтическая технология. Изготовление лекарственных препаратов: учебник / А.С. Гаврилов. – М.: ГЭОТАР-Медиа, 2010. – 624 с.
2. Кугач В.В. Курс лекций по аптечной технологии лекарственных средств. – Изд. 3-е, перераб. и дополн. – Витебск, 2010. – 349 с.
3. Ветеринарная фармакология: учебное пособие для студентов вузов по специальности «Ветеринарная медицина»/ Н.Г. Толкач, И.А. Ятусевич, А.И. Ятусевич, В.В. Петров; - Ред. А.И. Ятусевич. – Минск: ИВЦ Минфина, 2008. – 685 с.
ЗАНЯТИЕ 24
Тема: «Суппозитории. Технология суппозиториев методом ручного выкатывания».
Основные вопросы по теме:
1. Суппозитории. Характеристика лекарственной формы.
2. Характеристика суппозиторных основ.
3. Стадии приготовление суппозиториев. Приготовление суппозиториев.
4. Приготовление суппозиториев методом выкатывания (ручного формирования).
Материальное обеспечение: плакаты, фармакопея, масло какао, доксициклина гидрохлорид, коллекция суппозиторных основ и суппозиториев, баночки или картонные коробочки для отпуска, весы аптечные тарирные, комплект гирь, ступки №6 с пестиками, баня водяная или устройство для плавления суппозиторных основ, пилюльная машинка, капсулаторки или шпателя, целлюлоидные пластинки.
Домашнее задание.
Изучить основные вопросы по теме занятия. Описать свойства ингредиентов и описать технологию приготовления лекарственной формы методом выкатывания.
Собаке
Recipe: Doxycyclini hydrochloridi 0,1
Ichthyoli 0,2
Olei Cacao 1,5
Misce fiat suppositorium
Da talis dosis № 10.
Signa. Ректальное. По одному суппозиторию на ночь.
Суппозитории – твердые однодозовые лекарственные формы, которые содержат одно или более действующих веществ, диспергированных или растворенных в подходящей основе, которая растворяется или диспергируется в воде или плавится при температуре тела.
Требования к суппозиториям:
- однородность массы;
- одинаковая форма;
- твердость, обеспечивающая удобство применения. Определяют устойчивость суппозиториев и пессариев к разрушению;
- отклонения в массе от среднего значения;
- распадаемость для суппозиториев на липофильной основе должна быть не более 30 минут, на гидрофильной не более 60 минут;
- время полной деформации для суппозиториев на гидрофобной основе;
- обязательная проверка доз для веществ списка А и Б.
Введение лекарственных веществ в основу.
От способа введения лекарственных веществ в основу зависит скорость высвобождения и, следовательно, скорость всасывания и терапевтический эффект суппозиториев.
В зависимости от свойств.
Вещества, растворимые в жирах – фенол, анестезин, камфора, хлоралгидрат, фенилсалицилат, тимол, ментол, растирают с измельченной основой или растворяют в расплавленной гидрофобной основе. При введении больших количеств таких веществ возможно образование эвтектических смесей, и как результат, понижение температуры плавления суппозиториев. В этом случае добавляют уплотняющие вещества – парафин, спермацет, воск.
Вещества, растворимые в воде, должны быть растворены в минимальном количестве воды. Растворение облегчает равномерное распределение малых доз лекарственного вещества в основе, улучшает условия всасывания, облегчает быстрое фармакологическое действие. К полученному раствору в качестве эмульгатора и для придания пластичности суппозиторной массы вводят ланолин безводный 1,0-1,5г на 30,0 масла какао.
Если количество вещества велико и требует большого количества воды, то лекарственное вещество лишь растирают с несколькими каплями воды, потом смешивают с основой. Независимо от количества обязательно в растворенном виде вводят соли алкалоидов, новокаин, колларгол, протаргол, танин. В противном случае они не оказывают терапевтического действия.
Вещества, нерастворимые в воде и в основе – дерматол, ксероформ, висмута нитрат основной, стрептоцид и др., в состав суппозиторной массы вводят в виде мельчайшего порошка. Степень дисперсности этих веществ должна быть максимально высокой, иначе не будет обеспечен тесный контакт с тканями организма и терапевтический эффект. Если указанные лекарственные вещества прописаны в небольших количествах (до 5 %), их растирают с несколькими каплями жидкого масла (расклинивающий эффект Ребиндера), а затем смешивают с измельченным маслом какао. Если вещества прописаны в значительных количествах, их измельчают в ступке, а затем смешивают с измельченной основой.
Густые и густоватые жидкие вещества, например, ихтиол, нефть нафталанская, бальзамы, смешивают непосредственно с измельченной основой. В этом случае нет необходимости в добавлении ланолина в качестве пластификатора.
Густые и сухие экстракты растирают с равным количеством спирто-водно-глицериновой смеси.
Жидкие ингредиенты, не содержащие летучих веществ, могут быть предварительно сконцентрированы путем осторожного выпаривания.
Собаке.
Recipe: Xeroformii 0,1
Ichthyoli 0,2
Olei Cacao 1,5
Misce fiat suppositorium
Da talis dosis № 15.
Signa. Ректальное. По одному суппозиторию на ночь.
Свойства ингредиентов
Xeroformium – мелкий аморфный порошок желтого цвета, со слабым своеобразным запахом. Практически нерастворим в воде, спирте, эфире и хлороформе. Содержит 50-55 % окиси висмута. Хранение: в таре, предохраняющей от действия света и влаги.
Ichthyolum – почти черная, в тонком слое бурая, сиропообразная жидкость, своеобразного резкого запаха и вкуса. Растворим в воде, глицерине, частично в спирте и эфире. Водные растворы ихтиола при взбалтывании сильно пенятся. Ихтиол содержит 10,5 % органически связанной серы. Несовместим в растворах с иодистыми солями, алкалоидами и солями тяжелых металлов. Хранение в стеклянных банках.
Oleum (Butyrum) Cacao – куски светло-желтого цвета с приятным шоколадным запахом и вкусом. Температура плавления 30-34°С.
Ингредиенты прописи совместимы.
Распределительным способом выписана сложная лекарственная форма для ректального применения – суппозитории.
Расчеты на оборотной стороне паспорта письменного контроля
Ксероформа 0,1·15=1,5
Ихтиола 0,2·15=3,0 г;
Масла какао 1,5·15=22,5 г
Общая масса 27,0
Ср. масса суппозитория 1,8
Технология приготовления
На вощеную бумагу отвешивают 22,5 г измельченного масло какао. Шпателем делают в нем углубление, отвешивают 3,0 г ихтиола. Отвешивают 1,5 г ксероформа и помещают в ступку, тщательно растирают и по частям добавляют отвешенное масло какао, когда будет добавлено в ступку приблизительно 3-5 г масла какао добавляют ихтиол, тщательно перемешивают и по частям добавляют оставшееся масло какао, тщательно перемешивая. Массу уминают, взвешивают. Результаты отмечают на оборотной стороне рецепта и в паспорте. Формируют брусок, равный 15 делениям резака пипюльной машинки. Дозируют, выкатывают шарики, а затем конусы.
Готовые суппозитории заворачивают в вощенную бумагу, упаковывают в картонную коробку, наклеивают этикетку «Наружное».
Лицевая сторона паспорта письменного контроля
Дата 11.11.11 № рецепта 10
Olei Cacao 22,5
Ichthyoli 3,0
Xeroformii 1,5
Общая масса 27,0 г; 1,8 № 15
Приготовил (подпись)
Проверил (подпись)
Отпустил (подпись)
Самостоятельная работа на занятии.
Приготовить лекарственную форму и оформить к отпуску.
Собаке.
Recipe: Doxycyclini hydrochloridi 0,1
Ichthyoli 0,2
Olei Cacao 1,5
Misce fiat suppositorium
Da talis dosis № 10.
Signa. Ректальное. По одному суппозиторию на ночь.
Литература.
1. Гаврилов А.С. Фармацевтическая технология. Изготовление лекарственных препаратов: учебник / А.С. Гаврилов. – М.: ГЭОТАР-Медиа, 2010. – 624 с.
2. Кугач В.В. Курс лекций по аптечной технологии лекарственных средств. – Изд. 3-е, перераб. и дополн. – Витебск, 2010. – 349 с.
3. Ветеринарная фармакология: учебное пособие для студентов вузов по специальности «Ветеринарная медицина»/ Н.Г. Толкач, И.А. Ятусевич, А.И. Ятусевич, В.В. Петров; - Ред. А.И. Ятусевич. – Минск: ИВЦ Минфина, 2008. – 685 с.
ЗАНЯТИЕ 25
Тема: «Суппозитории. Приготовление суппозиториев методом выливания».
Основные вопросы по теме:
1. Стадии приготовления суппозиториев методом выливания, необходимые расчеты.
2. Изготовление суппозиторной массы.
3. Дозирование массы и формирование суппозиториев.
4. Технология палочек.
Материальное обеспечение: плакаты, фармакопея, стрептоцид, анестезин, твердый жир, коллекция суппозиторных основ и суппозиториев, баночки или картонные коробочки для отпуска, весы аптечные тарирные, комплект гирь, ступки №6 с пестиками, баня водяная или устройство для плавления суппозиторных основ, формы для выливания суппозиториев, капсулаторки или шпателя, целлюлоидные пластинки.
Домашнее задание.
Изучить основные вопросы по теме занятия. Описать свойства ингредиентов и описать технологию приготовления лекарственной формы методом выливания
Козе.
Recipe: Streptocidi 0,1
Anaesthesini 0,08
Basis quantum satis
Ut, fiat suppositorium m=3,0
Da talis dosis № 10
Signa. Ректальное. По одному суппозиторию два раза в день.
___________________________________________________
Пример рецепта
Собаке.
Recipe: Rutini 0,01
Riboflavini 0,02
Basis quantum satis
Ut, fiat suppositorium m=3,0
Da talis dosis № 20
Signa. Ректальное. По одному суппозиторию два раза в день.
Rutinum – зеленовато-желтый мелкокристаллический порошок без вкуса и запаха. Практически нерастворим в воде, растворим в разбавленных растворах едких щелочей. Хранение: в хорошо укупоренной таре, предохраняющей от действия света.
Riboflavinum – желто-оранжевый кристаллический порошок горького вкуса, со слабым специфическим запахом. На свету неустойчив, мало растворим в воде и спирте. Водные растворы имеют желтую окраску и интенсивную желтовато-зеленую флуоресценцию.
GXM - 5 T – гидрогенезат хлопкового масла с добавлением эмульгатора Т-2 – гидрофобная основа с температурой плавления 35-37°С.
Ингредиенты прописи совместимы.
Расчеты на оборотной стороне паспорта письменного контроля
Рутина 0,0130=0,3 г
Рибофлавина 0,0230=0,6 г
GХМ-5 Т 90,0
Технология приготовления
Особенности в изготовлении суппозиториев методом выливания состоят в том, что при расчете количества основы необходимо учитывать объем гнезда формы, т.е. массу основы на одно гнездо и объем который занимает лекарственное вещество. Для того чтобы рассчитать количество основы с учетом объема, занимаемого лекарственным веществом пользуются либо коэффициентом замещения, либо обратным коэффициентом замещения. Коэффициент замещения Еж показывает количество лекарственного вещества, занимающего тот же объем, что и 1,0 г жировой основы с относительной плотностью 0,95 г/см3. При расчетах удобнее пользоваться обратным коэффициентом замещения 1/ Еж, который показывает количество жировой основы, занимающей объем, равный 1,0 г лекарственного вещества.
В данном рецепте необходимо приготовить 30 свечей массой 3,0 г (с использованием суппозиторных ячеек 3,0 см3). Общая суппозиторная масса рана 90,0 г. Количество лекарственных веществ 1 %, поэтому никаких расчетов проводит не надо.
В ступку вносят 0,3 г рутина и измельчают, затем 0,6 г рибофлавина и тщательно перемешивают. Основу расплавляют, вносят в ступку около 0,5 г и перемешивают со смесью лекарственных веществ. Полученную пульпу смешивают с оставшейся основой. Разливают в формы с объемом суппозиторных ячеек 3,0 см3, предварительно смазанных мыльным спиртом, так как основа гидрофобная. Упаковывают и оформляют к отпуску.
Готовые суппозитории заворачивают в вощенную бумагу, упаковывают в картонную коробку, наклеивают этикетку «Наружное». Готовые суппозитории хранят в аптеках согласно постановлению № 35 -10 суток.
Лицевая сторона паспорта письменного контроля
Дата 5.12.11 № рецепта 9
Rutini 0,3
Riboflavini 0,6
GXM - 5 T 90,0
Общая масса 90,9 г; 3,0г № 30
Приготовил (подпись)
Проверил (подпись)
Отпустил (подпись)
Самостоятельная работа на занятии.
Приготовить лекарственную форму по рецепту и оформить к отпуску.
Козе.
Recipe: Streptocidi 0,1
Anaesthesini 0,08
Basis quantum satis
Ut, fiat suppositorium m=3,0
Da talis dosis № 10
Signa. Ректальное. По одному суппозиторию два раза в день.
Литература.
1. Гаврилов А.С. Фармацевтическая технология. Изготовление лекарственных препаратов: учебник / А.С. Гаврилов. – М.: ГЭОТАР-Медиа, 2010. – 624 с.
2. Кугач В.В. Курс лекций по аптечной технологии лекарственных средств. – Изд. 3-е, перераб. и дополн. – Витебск, 2010. – 349 с.
3. Ветеринарная фармакология: учебное пособие для студентов вузов по специальности «Ветеринарная медицина»/ Н.Г. Толкач, И.А. Ятусевич, А.И. Ятусевич, В.В. Петров; - Ред. А.И. Ятусевич. – Минск: ИВЦ Минфина, 2008. – 685 с.
ЗАНЯТИЕ 26
Тема: «Болюсы и пилюли. Технология пилюль»
Основные вопросы по теме:
1. Характеристика пилюль как лекарственной формы.
2. Вспомогательные вещества в технологии пилюль и принципы их подбора
3. Технологическая схема приготовления пилюль.
Материальное обеспечение: плакаты, фармакопея, стрептоцид, мука ржаная, вода очищенная, баночки или картонные коробочки для отпуска, весы аптечные тарирные, комплект гирь, ступки №6 с пестиками, коллекция пилюль и болюсов, пилюльная машинка, капсулаторки или шпателя, целлюлоидные пластинки.
Домашнее задание.
Изучить основные вопросы по теме занятия. Описать свойства ингредиентов и описать технологию приготовления лекарственной формы.
Курице.
Recipe: Streptocidi 0,06
Farinae secalinae et
Aquae purificatae q. s.
Ut, fiant pilule N 3
Da. Signa. Внутреннее. По одной пилюле три раза в день.
Приготовление пилюль слагается из следующих стадий:
1) смешения ингредиентов;
2) получения пилюльной массы;
3) формовки пилюльного стержня;
4) разрезывания стержня;
5) формовки;
6) обсыпки или покрытия пилюль.
При приготовлении пилюль все твердые вещества превращают в мельчайший порошок и только тогда перемешивают до однородной массы. Порядок их смешения такой же, как при приготовлении сложных порошков. Если в состав пилюль входят ядовитые и сильнодействующие вещества, то их предварительно растворяют в воде или спирте. Смешение и замешивание пилюльной массы производят в ступках. Пилюльная масса должна представлять собой хорошо уминаемое тесто, отстающее от стенок ступки и пестика. Для снятия массы со стенок и пестика применяют топкие шпатели.
Готовую пилюльную массу взвешивают, количество массы указывают в рецепте и переносят на пилюльную машинку (рисунок). Пилюльная машинка состоит из доски, двух режущих поверхностей (резаков), деревянной дощечки для выкатывания стержня и ролика (кружка) для округления нарезанных пилюль. Резаки делают из нержавеющей стали, алюминия, пластмассы и применяют в зависимости от химических свойств ингредиентов, входящих в состав пилюльной массы. Доски должны быть из древесины твердых пород (бук, береза и т. п.) или заменяться матовым стеклом.
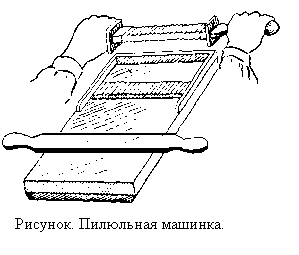
Приготовленную и взвешенную массу выкатывают в палочку такой длины, чтобы она уложилась точно между концами резака. Количество желобков на резаке с обеих сторон по 30, но они разного размера. Если прописано более 30 пилюль, массу делят на две и более равные части и из каждой части выкатывают соответствующее количество пилюль.
Нарезанные пилюли закругляют при помощи ролика (кружка). Высота бортиков ролика должна соответствовать размеру пилюли. Готовые пилюли должны быть одинаковыми, круглыми, гладкими и при падении с высоты 10- 15 см отскакивать от доски. В процессе приготовления пилюль не следует прикасаться руками ни к пилюльной массе, ни к стержню, ни к готовым пилюлям. Пилюльную палочку берут кусочком пергаментной бумаги, пилюли обсыпают из совочка и т. д. Для того чтобы пилюли не сливались между собой, их обсыпают порошками. С этой целью применяют ликоподий, крахмал, молочный сахар, порошок солодкового корня и белую глину. Можно использовать ароматные порошки; коры корицы, фиалкового корня и т. д. Готовые пилюли обсыпают ликоподием или крахмалом, а пилюли с окислителями (нитратом серебра или перманганатом калия) -белой глиной. Указание обсыпать пилюли в рецепте обозначают следующими словами: consperge - обсыпь, conspergantur - пусть будут обсыпаны, consperge Saccharo (Amylo, Lycopodio)- обсыпь сахаром (крахмалом, ликоподием).
Пилюли можно покрывать оболочками, но только по назначению ветеринарного врача. Для этого по указанию применяют сахар или вещества, предохраняющие пилюли от действия желудочного сока (фенилсалицилат, стеариновую кислоту).
Самостоятельная работа на занятии.
Приготовить лекарственную форму и оформить ее к отпуску.
Курице.
Recipe: Streptocidi 0,05
Farinae secalinae et
Aquae purificatae quantum satis
Ut, fiant pilule N 3
Da.Signa. Внутреннее. По одной пилюле три раза в день.
Литература.
1. Гаврилов А.С. Фармацевтическая технология. Изготовление лекарственных препаратов: учебник / А.С. Гаврилов. – М.: ГЭОТАР-Медиа, 2010. – 624 с.
2. Кугач В.В. Курс лекций по аптечной технологии лекарственных средств. – Изд. 3-е, перераб. и дополн. – Витебск, 2010. – 349 с.
ЗАНЯТИЕ 27
Тема: «Болюсы и пилюли. Технология болюсов»
Основные вопросы по теме:
1. Характеристика болюсов как лекарственной формы.
2. Вспомогательные вещества в технологии болюсов и принципы их подбора.
3. Технологическая схема приготовления болюсов.
Материальное обеспечение: плакаты, фармакопея, фенбендазол, стрептоцид, мука ржаная, порошок корней алтея, вода очищенная, баночки или картонные коробочки для отпуска, весы аптечные тарирные, комплект гирь, ступки №6 с пестиками, коллекция пилюль и болюсов, пилюльная машинка, капсулаторки или шпателя, целлюлоидные пластинки.
Домашнее задание.
Изучить основные вопросы по теме занятия. Описать свойства ингредиентов и описать технологию приготовления лекарственной формы.
Лошади.
Recipe: Streptocidi 10,0
Pulveris radicis Althaeae et
Aquae purificatae quantum satis
Ut, fiat bolus
Da talis dosis N 6
Signa. Внутреннее. По одному болюсу три раза в день.
_______________________________________________________
Корове.
Recipe: Norsulfazoli 60,0
Farinae secalinae et
Aquae purificatae quantum satis
Ut, fiant boli N 6
Da.Signa. Внутреннее. По одному болюсу три раза в день.
Болюсы (Boli). Приготовляют их аналогично пилюлям, но масса должна быть более мягкая. Ядовитые вещества в них обычно не назначают. Болюсы готовят весом от 0,5 до 50,0. Форма болюсов может быть различной в зависимости от их величины; мелким болюсам придают форму шариков, а большим — продолговатую, яйцевидную. При приготовлении болюсной массы в качестве вспомогательных веществ употребляют ржаную муку, белую глину, солод, патоку, зеленое мыло, сахарный сироп и т. п.
Отвешенные лекарственные вещества растирают и смешивают до однородной массы. К полученной смеси лекарственных веществ прибавляют вспомогательные сыпучие вещества в тех же соотношениях, что и при приготовлении пилюль. Затем постепенно добавляют воду или другое жидкое вспомогательное вещество до придания массе требуемой консистенции. Всю массу взвешивают, после чего развешивают на равные части, исходя из числа болюсов, и выкатывают каждый болюс отдельно. Готовые болюсы обсыпают индифферентным порошком.
Болюсы прописывают на 1-2 дня, так как при хранении они быстро затвердевают. Кроме того, болюсная масса легко подвергается брожению. Назначают болюсы главным образом лошадям, реже собакам, кошкам и другим животным. Болюсы отпускают в коробках, а содержащие отсыревающие вещества - в стеклянных или фарфоровых банках.
Самостоятельная работа на занятии.
Приготовить лекарственную форму по рецептам и оформить ее к отпуску.
Лошади.
Recipe: Fenbendazoli 2,0
Farinae secalinae et
Aquae purificatae quantum satis
Ut, fiat bolus
Da.Signa. Внутреннее. На прием.
______________________________________________________
Лошади.
Recipe: Streptocidi 10,0
Rad. Althaeae pulv. et
Aquae purificatae quantum satis
Ut, fiat bolus
Da talis dosis N 3
Signa. Внутреннее. По одномуболюсу три раза в день.
Литература.
1. Гаврилов А.С. Фармацевтическая технология. Изготовление лекарственных препаратов: учебник / А.С. Гаврилов. – М.: ГЭОТАР-Медиа, 2010. – 624 с.
2. Кугач В.В. Курс лекций по аптечной технологии лекарственных средств. – Изд. 3-е, перераб. и дополн. – Витебск, 2010. – 349 с.
3. Ветеринарная фармакология: учебное пособие для студентов вузов по специальности «Ветеринарная медицина»/ Н.Г. Толкач, И.А. Ятусевич, А.И. Ятусевич, В.В. Петров; - Ред. А.И. Ятусевич. – Минск: ИВЦ Минфина, 2008. – 685 с.
ЗАНЯТИЕ 28
Тема: «Стерильные и асептически приготавливаемые лекарственные формы».
Основные вопросы по теме:
1. Характеристика и номенклатура стерильных лекарственных форм.
2. Создание асептических условий в аптеке.
3. Стерилизация. Понятие, фармакопейные методы стерилизации.
4. Воздушная стерилизация.
5. Стерилизующая фильтрация.
6. Стерилизация оксидом этилена.
7. Радиационная стерилизация.
8. Контроль стерильности.
Материальное обеспечение: плакаты, фармакопея, сухожаровой шкаф, автоклавы, коробки стерилизационные, термостат, индикаторы стерилизации.
Домашнее задание.
Изучить основные вопросы по теме занятия. Ознакомится с фармакопейной статью ГФ РБ «Стерилизация».
Стерилизация – это процесс умерщвления в объекте или удаления из него микроорганизмов всех видов, находящихся на всех стадиях развития.
В фармацевтической практике используют следующие методы стерилизации:
термические – паровой и воздушный;
химические – газовый и стерилизация растворами;
стерилизация фильтрованием;
радиационная стерилизация.
Все перечисленные методы стерилизации являются фармакопейными.
Тепловые методы стерилизации.
Для стерилизации посуды и лекарственных препаратов используют исключительно способы, основанные на воздействии высоких температур.
Высокая температура вызывает необратимую коагуляцию протоплазмы, пирогенетическое разрушение микробной клетки и повреждение ее форменных систем. Большинство патогенных микроорганизмов погибают при температуре около 60ºС. Их споры выдерживают более высокую температуру. Кипящая вода и текучий пар убивает микроорганизмы значительно быстрее, чем сухой горячий воздух. Пар под давлением (температура выше 100ºС) действует еще эффективнее. Выбор метода зависит от свойств стерилизуемого объекта.
Паровой метод стерилизации осуществляют насыщенным водяным паром при избыточном давлении 1,1 кгс/см2 (0,11 МПа) и температуре 120ºС; 2 кгс/см2 (0,2 МПа) и температуре 132ºС.
Стерилизацию проводят в паровых стерилизаторах – автоклавах – различной конструкции. Наиболее удобны те паровые стерилизаторы, в которых автоматически поддерживаются заданные давление и температура. Широкое распространение получили стерилизаторы типа ВК-15, ВК-30, ВК-75, ГП-280. Состоят из корпуса со стерилизационной и водопаровой камерой, крышки, кожуха, электронагревательных элементов.
Растворы лекарственных веществ стерилизуют насыщенным водяным паром при 120ºС:
Объемом до 100 мл – 8 мин;
Объемом свыше 100 до 500 мл – 12 мин;
Объемом свыше 500 до 1000 мл – 15 мин.
Стерилизацию растворов проводят в герметично укупоренных флаконах или бутылках, а масла в герметично укупоренных сосудах стерилизуют при 120ºС в течение 2 ч.
Кроме растворов лекарственных веществ, паровым методом можно стерилизовать изделия из стекла, фарфора, металла, перевязочные и вспомогательные материалы (вату, марлю, бинты, резиновые пробки, фильтровальную бумагу, пергамент, резиновые перчатки, спецодежду).
Время стерилизации при 120ºС – 45 мин, а при 132ºС – 20 мин.
Стерилизацию перечисленных объектов проводят в стерилизационных коробках, биксах или двухслойной упаковке из бязи или пергамента.
В исключительных случаях допускается стерилизация при температуре ниже 120ºС. Конкретизация отдельных режимов должна быть обоснована и указана в нормативной документации.
Воздушный метод (стерилизация сухим жаром)
Воздушный метод стерилизации осуществляют сухим горячим воздухом в воздушных стерилизаторах (сушильных шкафах) при температуре 160ºС, 180ºС и 200ºС. Эффективность метода зависит от температуры, времени, свойств стерилизуемых объектов, правильности их расположения внутри стерилизационной камеры. Этим методом стерилизуют термоустойчивые порошки: натрия хлорид, цинка оксид, тальк, белую глину, стрептоцид, а также минеральные и растительные масла, глицерин, вазелин. Режимы стерилизации представлены в таблице 1.
Таблица 1.
Режимы стерилизации горячим воздухом.
Масса образца, г |
Температура, ºС |
Время стерилизации, мин |
Порошки |
||
до 25 |
180 |
30 |
от 25 до 100 |
180 |
40 |
от 100 до 200 |
180 |
60 |
Минеральные и растительные масла |
||
до 200 |
180 |
30 |
от100 до 500 |
180 |
40 |
Воздушным методом стерилизуют также изделия из стекла, фарфора, силиконовой резины, установки для стерилизующего фильтрования с фильтрами, приемниками.
Режим стерилизации 160ºС - 2,5 ч, 180ºС -1 ч.
Контроль эффективности термических методов осуществляют с помощью контрольно-измерительных приборов, химических и биологических тестов.
Для контроля паровой стерилизации в качестве химических тестов используют вещества, изменяющие свой цвет или физическое состояние при определенных параметрах стерилизации.
Если после стерилизации вещество расплавилось и цвет индикатора изменился, стерилизация считается состоявшейся. Отрицательный результат свидетельствует о грубом нарушении режима стерилизации или неисправности манометра.
Контроль воздушной стерилизации осуществляется с помощью специальной индикаторной бумаги на основе термоиндикаторной краски, которая меняет свой цвет в зависимости от температуры и продолжительности ее воздействия.
Можно использовать индикатор плавления, например, сахарозу.
Химические методы стерилизации используют для стерилизации изделий из резины, полимерных материалов, стекла, коррозиестойких металлов.
Для газовой стерилизации используют окись этилена с различными флегматизаторами: бромистым метилом, двуокисью углерода, хладонами и др. Стерилизацию проводят в газовых стерилизаторах или микроанаэростатах.
В связи с токсичностью окиси этилена и бромистого метила применение стерилизованных этими газами изделий допускается только после их дегазации, т.е. выдержки в вентилируемом помещении до допустимых остаточных количеств.
Для стерилизации растворами используют 6 % раствор пероксида водорода и надкислоты (дезоксон-I). Изделие полностью погружают в раствор, выдерживают в нем определенное время. Затем промывают стерильной водой в асептических условиях. Эффективность стерилизации зависит от концентрации раствора, времени стерилизации и температуры.
Стерилизация фильтрованием используется для стерилизации термолабильных веществ. Заключается в фильтровании через глубинные и мембранные фильтры, задерживающие микроорганизмы и их споры.
Мембранные фильтры характеризуются ситовым механизмом задержания и постоянным размером пор при эксплуатации. Максимальный диаметр пор стерилизующего мембранного фильтра не превышает 0,3 мкм.
Глубинные фильтры характеризуются сложным механизмом задержания (ситовым, адсорбционным, инерционным) и в большинстве случаев непостоянным размером пор. Для мембранных фильтров указывается в паспорте «точка пузырька» (минимальное давление газа, необходимое для вытеснения жидкости из фильтра) – величина, непосредственно связанная с максимальным диаметром пор в фильтре.
При стерилизации фильтрованием перед стерилизующим фильтром помещают один или несколько префильтров. Поры префильтра больше пор фильтра или равны им.
Стерилизацию фильтрованием и розлив растворов проводят в асептических условиях. Эффективность стерилизации фильтрованием проверяют прямым посевом пробы фильтрата в питательную среду.
Радиационный метод стерилизации может быть рекомендован для изделий из пластмасс, изделий одноразового использования в упаковке, перевязочных материалов, некоторых лекарственных средств и других видов медицинской продукции.
Облучение объектов в конечной упаковке производят на гамма-установках, ускорителях электронов и других источниках ионизирующего излучения.
Самостоятельная работа на занятии.
Составить таблицу сравнительных характеристик фармакопейных способов стерилизации.
Литература.
1. Кугач В.В. Курс лекций по аптечной технологии лекарственных средств. – Изд. 3-е, перераб. и дополн. – Витебск, 2010. – 349 с.
2. Гаврилов А.С. Фармацевтическая технология. Изготовление лекарственных препаратов: учебник / А.С. Гаврилов. – М.: ГЭОТАР-Медиа, 2010. – 624 с.
3. Государственная фармакопея Республики Беларусь В 3т. Т 1. Общие методы контроля качества лекарственных средств/ Центр экспертиз и испытаний в здравоохранении; Под общ. ред. Г.В. Годовальникова. – Минск: Минский государственный ПТК полиграфии, 2006 – 656 с.
4. Ветеринарная фармакология: учебное пособие для студентов вузов по специальности «Ветеринарная медицина»/ Н.Г. Толкач, И.А. Ятусевич, А.И. Ятусевич, В.В. Петров; - Ред. А.И. Ятусевич. – Минск: ИВЦ Минфина, 2008. – 685 с.
ЗАНЯТИЕ 29
Тема: «Лекарственные формы для инъекций. Пирогенные вещества».
Основные вопросы по теме:
1. Лекарственные формы для инъекций. Основные требования.
2. Пирогенные вещества, характеристика.
3. Контроль пирогенности.
4. Вода для инъекций.
5. Другие растворители в инъекционных лекарственных формах.
Материальное обеспечение: плакаты, фармакопея, ЛАЛ-реагент, вода для инъекций (коллекция).
Домашнее задание.
Изучить основные вопросы по теме занятия. Ознакомится с фармакопейной статью ГФ РБ «Вода для инъекций», «Лекарственные средства парентерального применения».
Общие требования, предъявляемые к растворам для инъекций и инфузий:
-отсутствие пирогенных веществ;
-стерильность;
-стабильность;
-отсутствие механических включений.
Пирогенные вещества – пирогены (от греч. pyr – огонь, жар, genan – производить) – вещества бактериального происхождения, вызывающие у теплокровных животных и человека повышение температуры тела, лихорадку, изменение в картине крови, увеличение проницаемости сосудов, падение артериального давления и др.
Термин «пирогены» был впервые введен в 1875 г. для обозначения веществ, выделенных из загнивающего мяса и вызывающих лихорадку у животных. С 1953 г. термин «пирогенные вещества» узаконен международным симпозиумом.
По химическому строению пирогенные вещества – безбелковые вещества с большой молекулярной массой, липополисахаридной природы. Липополисахаридный комплекс может быть разложен на 3 основные части: так называемый «липоид А» (токсичная часть), иммуноспецифическая полисахаридная цепь, характерная для каждого вида микробов и общий полисахарид.
Пирогенные вещества синтезируются в мембране грамотрицательными бактериями и располагаются на поверхности клеток, оттуда попадают в окружающую среду. Пирогенные вещества – высокомолекулярные соединения, с молекулярной массой до 106 Дальтон. Пирогенная активность грамположительных микроорганизмов в 10000-100000 раз слабее.
Пирогены являются термостабильными веществами. Они не разрушаются при температуре стерилизации 120ºС и 132ºС. Поэтому при приготовлении лекарственных форм для инъекций очень важно строгое соблюдение асептики.
Пирогенные вещества определяют в бактериологических лаборатория на кроликах. Относительная чувствительность обнаружения пирогенных веществ составляет 1-10 нг/мл. Недостатки методики: зависимость результатов от индивидуальной чувствительности животного; большее восприятие пирогенной реакции человеком по сравнению с кроликом; высокие затраты на содержание и уход за животными.
Для определения пирогенности воды и растворов для инъекций применяют Лимулус-тест или лал-тест. В основе этого теста лежит способность лизата амебоцитов (клеток крови) мечехвоста реагировать с эндотоксинами (липосахаридами) грамотрицательных бактерий.
Сырьем для получения лал-реагента служит кровь мечехвостов - морских животных, обитающих у берегов Северной Америки, Японии, Китая, Вьетнама, Индии. Перед использованием сублимационно высушенный лизат растворяют в апирогенной воде.
Реакция лизата амебоцитов с эндотоксинами была открыта в США в 1964 г. Первые исследования были проведены на мечехвостах вида Limulus Polyphemus. Лизат полученный из их крови Limulus Amebocyte Lisate - сокращено – ЛАЛ-реактив, а сама реакция – ЛАЛ-тест.
Промышленный выпуск ЛАЛ-реактива начался в США в конце 70-х годов. Официально этот тест был включен в фармакопею США в 1980 г., в фармакопею Италии в 1985 г.
Испытание на бактериальные эндотоксины (БЭ) проводят для определения наличия или количества эндотоксинов, источником которых являются грамотрицательные бактерии, с использованием лизата амебоцитов мечехвоста Limulus polyphemus или Tachypleus tridentatus. Существует три принципа проведения:
принцип гель-тромба, основанный на образовании геля;
турбодиметрический принцип, основанный на помутнении в результате расщепления эндогенного субстрата.
хромогенный принцип, основанный на появлении окраски после расщепления синтетического пептидохромогенного комплекса.
ЛАЛ-тест дает возможность количественного определения концентрации эндотоксина в исследуемом образце. Для этого сравнивают реакцию LAL-реактива с раствором исследуемого образца, который содержит эндотоксин неизвестной концентрации, и его реакцию с раствором стандартного препарата эндотоксина известной концентрации, которая выражается в единицах эндотоксина на один миллилитр раствора.
Применение ЛАЛ-теста в медицине и фармации имеет несколько направлений:
Применение в клинической практике для диагностики заболеваний, вызванных грамотрицательными микроорганизмами.
Применение в фармации для постадийного контроля и оценки качества готового продукта.
ЛАЛ-тест имеет ряд преимуществ перед биологическим: он дешевле, чувствительнее в 5–10 раз, результат получают быстрее, возможно количественное определение пирогенов. Кроме того, с его помощью возможен контроль препаратов, которые нельзя подвергнуть испытанию на кроликах, в том числе сырье.
ЛАЛ- тест сегодня – единственный реактив, который может быть использован для постадийного контроля растворов для инъекций на апирогенность. Наиболее рациональными точками контроля являются исходное сырье, вода для инъекций, фильтры, растворы перед стерилизующим фильтрованием, ампулы и флаконы.
Самостоятельная работа на занятии.
Работа с фармакопейными статьями по данной теме занятия. Изучение принципа применение ЛАЛ-теста.
Литература.
1. Кугач В.В. Курс лекций по аптечной технологии лекарственных средств. – Изд. 3-е, перераб. и дополн. – Витебск, 2010. – 349 с.
2. Гаврилов А.С. Фармацевтическая технология. Изготовление лекарственных препаратов: учебник / А.С. Гаврилов. – М.: ГЭОТАР-Медиа, 2010. – 624 с.
3. Государственная фармакопея Республики Беларусь В 3т. Т 1. Общие методы контроля качества лекарственных средств/ Центр экспертиз и испытаний в здравоохранении; Под общ. ред. Г.В. Годовальникова. – Минск: Минский государственный ПТК полиграфии, 2006 – 656 с.
ЗАНЯТИЕ 30
Тема: «Стабилизация растворов для инъекций»
Основные вопросы по теме:
1. Гидролиз лекарственных средств и пути его предотвращения.
2. Гидролиз солей, образованных сильным основанием и слабой кислотой.
3. Гидролиз солей, образованных слабым основанием и сильной кислотой.
4. Гидролиз солей, слабым основанием и слабой кислотой.
5. Стабилизация растворов легко окисляющихся веществ.
6. Особенности приготовления раствора селенита натрия.
Материальное обеспечение: плакаты, фармакопея, папаверина гидрохлорид, кислота хлористоводородная, вода для инъекций, цилиндры мерные вместимостью 50 мл, пипетки вместимостью 1 мл, колба мерная вместимость 100 мл, воронки, весы аптечные ручные, комплект гирь, фильтры беззольные, вата длинноволокнистая, флакон для отпуска, этикетки, бумага пергаментная, нить для обвязки, карандаш простой, коллекция консервирующих веществ инъекционных препаратов (бензиловый спирт, нипагин, нипазол, натрия метабисульфит и др.), капсулаторки или шпателя.
Домашнее задание.
Изучить основные вопросы по теме занятия. Описать свойства ингредиентов и технологию приготовления лекарственной формы.
Собаке.
Recipe: Analgini 25 % – 50 ml pro injectionibus
Da.Signa. Внутримышечное. По 1 мл два раза в день.
Особенности приготовления раствора селенита натрия:
Водный раствор селенита натрия готовится в концентрациях 0,01% для мелких животных и 0,1% для крупных, как и все лекарственные формы для инъекций в асептических условиях. Кроме растворителя никакие вспомогательные вещества не добавляют. Раствор селенита натрия не подвергают термической стерилизации, так как при воздействии высоких температур селенит натрия разрушается до селената натрия, оказывающего при введении раздражающее действие. После вскрытия флакона, раствор нужно использовать в течение 2-х часов, остатки уничтожить.
Поросятам.
Recipe: Natrii selenitis 0,01
Aquae purificatae sterilisatae 100 ml
Misce fiat solutio para asepticae
Da. Signa. Подкожное. По 2 мл на введение.
Пример рецепта
Собаке.
Recipe: Solutionis Papaverini hydrochloridi 1 % - 30 ml
Sterilisetur!
Da. Signa. Внутримышечное. По 2 мл два раза в день.
