
Энтропия системы, совершающей необратимый процесс, возрастает
![]() .
(4)
.
(4)
Выражения (3) и (4) относятся только к замкнутым системам.
Таким образом, энтропия замкнутой системы может либо возрастать, либо оставаться постоянной. Это можно представить неравенством Клаузиуса
![]() (5)
(5)
Этот принцип лежит в основе еще одной формулировки второго начала термодинамики: все реальные процессы изменения состояния в изолированной системе протекают с увеличением энтропии.
Состоянию равновесия системы соответствует максимально возможное значение энтропии
![]() (6)
(6)
К. Больцман дал энтропии молекулярно-кинетическое толкование как меры перехода упорядоченных форм движения частиц вещества в беспорядочное (тепловое) движение. При этом он установил связь между энтропией и термодинамической вероятностью системы; энтропия S изменяется пропорционально логарифму термодинамической вероятности W
S=klnW, (7)
где k -постоянная Больцмана.
Термодинамическая вероятность - это число комбинаций из элементов, составляющих систему, при которых может осуществляться данное состояние системы.
Для идеального газа, например, макросостояние (давление, объем и температура газа) обусловлено совокупностью микросостояний составляющих газ молекул (их скоростями, массами, распределением в объеме газа). Термодинамическая вероятность макросостояния газа- это число микросостояний, при которых возможно данное макросостояние. Нетрудно заключить, что наибольшая вероятность соответствует равномерному распределению молекул по всему объему газа с установившимся значением средней кинетической энергии, т.е. состоянию, при котором все молекулы газа находятся в равновесном тепловом движении. Этому состоянию соответствует и максимальная энтропия. Формула Больцмана позволяет дать энтропии следующее статистическое толкование: энтропия является мерой неупорядоченности системы. Процессы в замкнутой системе идут в направлении увеличения числа микросостояний, т.е. от менее вероятных состояний к более вероятным, до тех пор, пока вероятность состояния не станет максимальной.
ПРАКТИЧЕСКАЯ ЧАСТЬ.
В данной работе определяют изменение энтропии при нагревании припоя от комнатной температуры до температуры плавления и при его плавлении. Полное изменение энтропии при нагревании и плавлении припоя
![]() ,
(8),
,
(8),
где
![]() и
и
![]() - изменение
энтропии соответственно при нагревании
припоя от комнатной температуры
- изменение
энтропии соответственно при нагревании
припоя от комнатной температуры
![]() до температуры плавление
до температуры плавление
![]() и при полном
плавлении.
и при полном
плавлении.
Вычислим изменение энтропии
![]() (9)
(9)
При нагревании (участок 1 - 2 на рис.1)
![]() (10),
(10),
с - удельная теплоемкость твердого припоя, m- масса припоя.
При плавлении (участок 2 - 3 на рис.1)
![]() (11),
(11),
где
![]() - удельная
теплота плавления.
- удельная
теплота плавления.
t,мин
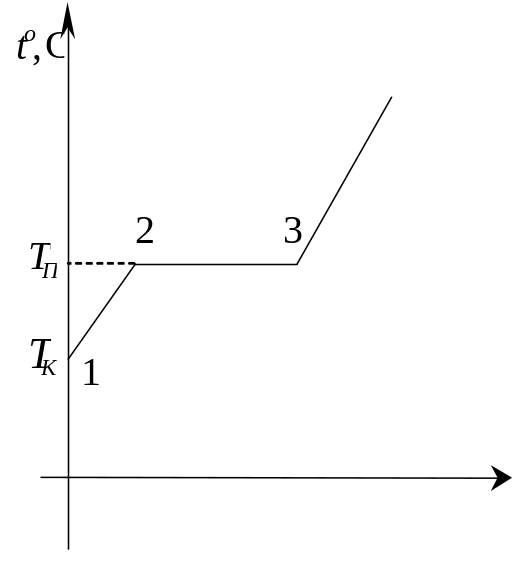
Рис. 1.
Тогда
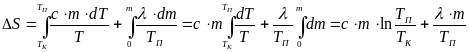 ,
или
,
или
![]() .
(12)
.
(12)
Р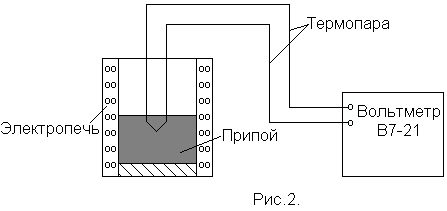 абочая
схема установки приведена на рис.2. В
данной работе температура припоя
измеряется термопарой хромель-алюмель
(см.
Примечание).
абочая
схема установки приведена на рис.2. В
данной работе температура припоя
измеряется термопарой хромель-алюмель
(см.
Примечание).
Один
контакт термопары погружен в припой,
помещенный в электропечь, другой -
находится при комнатной температуре.
При включении электропечи происходит
нагревание и плавление припоя. Его
температуру определяют из градуировочного
графика (приведен на панели установки)
по значениям термоЭДС
![]() ,
которые измеряются электронным
вольтметром В7 - 21.
,
которые измеряются электронным
вольтметром В7 - 21.
