
- •По дисциплине «химия»
- •Природа химической связи и ее характеристики
- •Разрыв связи в молекуле может быть осуществлен:
- •Находим объем, занимаемый 1 атомом хрома в кристаллической решетке
- •14. Произведите оценку длины связей в молекулах no и so, используя справочные данные о межъядерных расстояниях в простых веществах.
- •22. Оцените длины связей в молекулах ClO и co, используя справочные данные о межъядерных расстояниях в простых веществах.
- •Ковалентная связь. Гибридизация атомных орбиталей и геометрическая форма молекул
- •Из табл. 2 приложения находим эо атомов хлора и йода, которые равны 2,83 и 2,21 соответственно. Определяем разность эо атомов
- •По графику, приведенному на рис. 1, определяем си связи. Си 5 %. Тогда
- •Метод молекулярных орбиталей
- •Ионная связь и межмолекулярные взаимодействия
- •Многовариантное задание
- •Исходные данные
- •Список литературы
- •Приложение
- •Значения длины связи
- •Относительная электроотрицательность некоторых элементов
- •Виды гибридизаций ао и геометрические параметры частиц
- •Строение и ожидаемая полярность молекул
- •Ионные радиусы
- •Содержание
Метод молекулярных орбиталей
По методу молекулярных орбиталей (ММО) молекула рассматривается как единое целое – ядра атомов составляют каркас молекулы, а электроны атомов становятся общими для всей молекулы и располагаются на молекулярных орбиталях (МО). Метод основан на следующих положениях:
1. Атомные орбитали (АО) могут образовывать МО, если их энергии близки по величине и симметрия относительно оси связи одинакова;
2. МО образуются в результате линейной комбинации АО (ЛК АО), то есть сложения или вычитания АО (метод ЛК АО): если МО образуется в результате сложения АО, то её энергия будет ниже, чем энергия исходных АО. Такая орбиталь называется связывающей МО (обозначается , или в зависимости от типа перекрывания электронных облаков). В случае вычитания АО возникающая МО имеет большую энергию, чем исходная АО и называется разрыхляющей (обозначается *, * или *). Электрон, находящийся на связывающей МО, обеспечивает связь между атомами, а электрон, находящийся на разрыхляющей МО, ослабляет связь между атомами;
3. Каждая МО характеризуется набором трех квантовых чисел. При заполнении электронами МО выполняются принцип Паули и правило Гунда;
4. Число МО равно числу взаимодействующих АО реагирующих атомов (например, при взаимодействии двух АО со стороны каждого атома в молекуле типа А2 образуется четыре МО, из которых две - связывающие и две - разрыхляющие);
5. По возрастанию
энергии МО двухатомных молекул первого
периода и начала второго периода (до N2
включительно) можно расположить в
следующий ряд: σ![]() <
σ
<
σ![]() <
σ
<
σ![]() <
σ
<
σ![]() <
π
<
π![]() =
π
=
π![]() <
σ
<
σ![]() <
π
<
π![]() =
=
= π![]() <
σ
<
σ![]() .
МО двухатомных молекул конца второго
периода по возрастанию энергии
располагаются в несколько иной ряд:
.
МО двухатомных молекул конца второго
периода по возрастанию энергии
располагаются в несколько иной ряд:
σ < σ < σ < σ < σ < π = π < π = π < σ ;
6. Число связей (иначе порядок связи) n для двухатомных молекул определяют по формуле
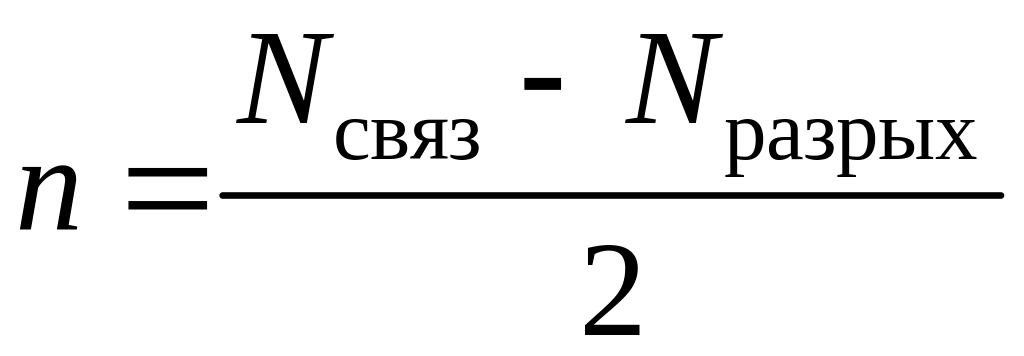 ,
(6)
,
(6)
где
![]() – количество электронов на связывающих
МО;
– количество электронов на связывающих
МО;
![]() –
количество электронов на разрыхляющих
МО. С увеличением порядка связи в
однотипных молекулах растет энергия
связи и уменьшается ее длина;
–
количество электронов на разрыхляющих
МО. С увеличением порядка связи в
однотипных молекулах растет энергия
связи и уменьшается ее длина;
7. Если на МО имеются непарные электроны, то молекула обладает свойствами парамагнетика, если все электроны спарены, то она диамагнитна.
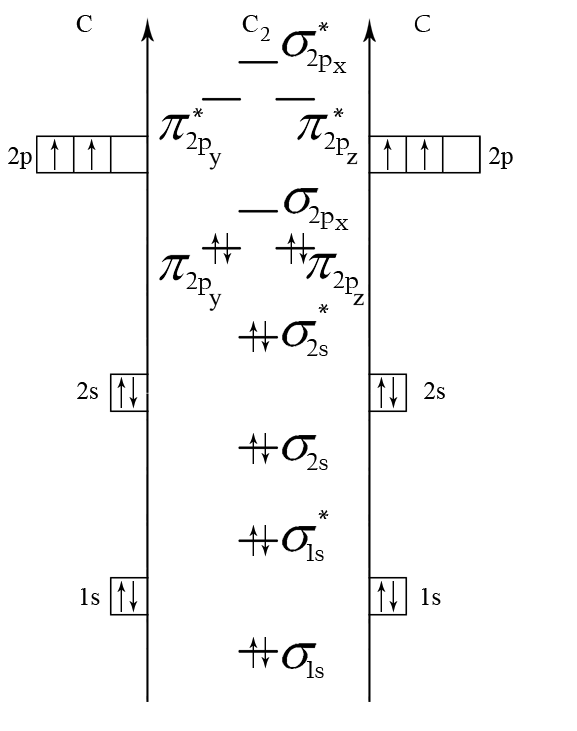
Образование молекул по ММО принято представлять в виде энергетических диаграмм (рис. 3). В средней части диаграммы изображены МО, а по краям расположены АО взаимодействующих атомов в соответствии с их энергиями. Связывающие МО всегда находятся ниже исходных АО, а разрыхляющие МО – выше, поскольку им соответствует более высокая энергия.
Образование химической связи можно также записывать через электронные конфигурации атомов и молекул. Например, образование химической связи в молекуле С2 может быть представлено следующим образом:
2С [1s22s22p2] → C2 [(σ )2(σ )2(σ )2(σ )2(π )2(π )2].
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()

Рис. 3. Энергетическая диаграмма молекулы С2 по ММО
Из энергетической диаграммы молекулы С2 (см. рис. 3) следует, что она диамагнитная, а порядок связи равен
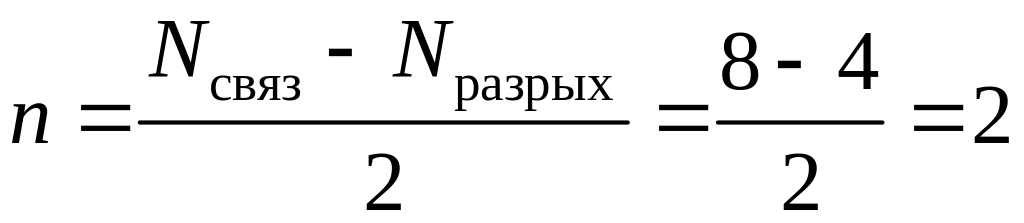 .
.
При описании по ММО двухатомных молекул, образованных разными по природе элементами, следует учитывать, что исходные АО одинаковых подуровней у взаимодействующих атомов будут обладать различными значениями энергии. У более электроотрицательного атома энергия АО несколько ниже, чем у атома с меньшим значением ЭО (рис. 4) Поэтому в таких молекулах связывающие МО располагаются ближе к АО атома с большим значением ЭО, а разрыхляющие – ближе к атому с меньшим значением ЭО. Разность b между энергиями АО взаимодействующих атомов характеризует полярность связи, а разность а между энергиями АО и ближайшей к атому МО характеризует ковалентность связи. Чем больше b (меньше а), тем больше полярность связи, то есть выше ее СИ и меньше СК.
![]()
![]()
![]()
![]()
![]()
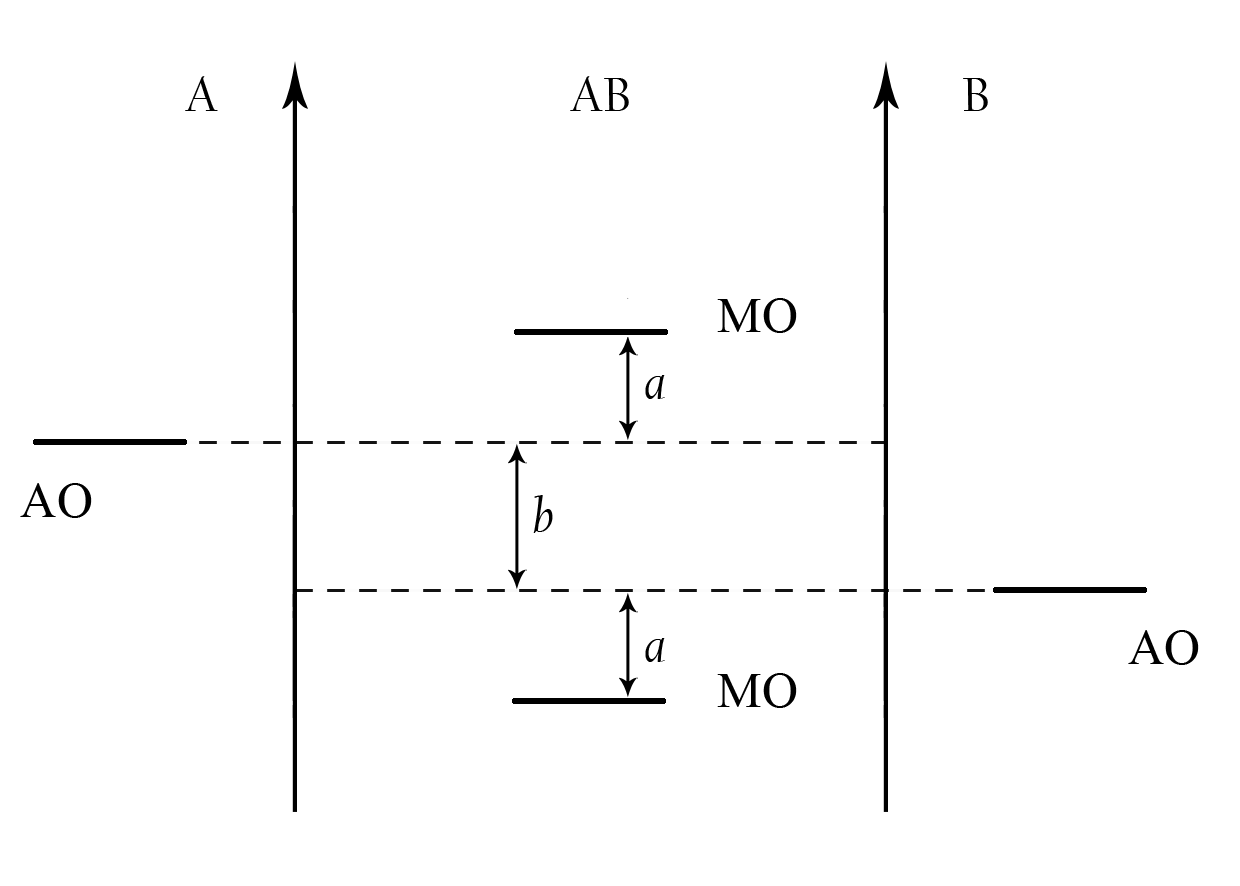
Рис. 4. Энергетическая диаграмма гетероядерной молекулы
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()





а) б)
Рис. 5. Энергетические диаграммы СN– и NO
Пример 1. Составьте энергетическую диаграмму МО для частиц СN– и NО. Определите порядок связи и магнитные свойства каждой частицы.
Р е ш е н и е
Ион СN– состоит из атома углерода и иона N–. Электроны в этих частицах распределяются по АО следующим образом:
С [1s2 2s2 2p2] N– [1s2 2s2 2p4].
Для распределения электронов по МО необходимо сравнить ЭО атомов. Из табл. 2 приложения выбираем ЭО(С) = 2,5 и ЭО(N) = 3. Поскольку ЭО(С) < ЭО(N), то энергия исходных АО иона N– будет меньше, чем у атома углерода. Строим энергетическую диаграмму
(рис. 5, а). Определяем порядок связи
n = (10 – 4) /2 = 3.
В ионе СN– нет непарных электронов, значит, частица – диамагнитная.
Молекула NО состоит из атомов азота и кислорода. Электроны в этих атомах распределяются по АО следующим образом:
N [1s2 2s2 2p3] О [1s2 2s2 2p4].
ЭО(N) = 3, а ЭО(О) = 3,5. Значит, энергия АО кислорода будет меньше, чем у азота. Последовательность возрастания энергии МО принимаем по более ЭО элементу, то есть по кислороду (рис. 5, б). Порядок связи в молекуле следующий:
n = (10 – 5)/2 = 2,5.
NО – парамагнетик.
ЗАДАЧИ
1.
Как изменяются длина связи, энергия
диссоциации и магнитные свойства в
ряду: О![]() ,
О
,
О![]() ,
О2 ,
О
?
Ответ мотивируйте.
,
О2 ,
О
?
Ответ мотивируйте.
2. Какая из частиц NO+, NO или NO– характеризуется наименьшей длиной связи?
3. Рассмотрите с позиции ММО возможность образования молекул В2, F2, BF. Какая из этих молекул наиболее устойчивая?
4. Объясните с позиции ММО, почему не могут существовать молекулы Ве2 и Nе2.
5. Опишите электронное строение молекул СО и СN с позиции методов ВС и МО. Какая из этих молекул характеризуется большей кратностью связи?
6. Нарисуйте энергетическую схему образования молекул О2 и B2 по методу МО. Определите порядок связи и магнитные свойства молекул.
7. В ряду следующих молекул и ионов выберите частицу, у которой наибольшая энергия связи: Ве – Ве2 – Ве . Ответ объясните с позиции ММО.
8. В ряду следующих молекул и ионов выберите частицу, у которой наибольшая энергия связи: С – С2 – С . Ответ объясните с позиции ММО.
9. Как изменяется порядок и энергия связей в ряду молекулярных ионов N O F ?
10. Используя метод МО, сравните порядок связей и магнитные свойства молекулы В2 и молекулярного иона В .
11. По методу МО составьте энергетическую диаграмму образования связей в молекулах Li2, F2, Ne2. Укажите порядок связи. Сделайте вывод об относительной прочности этих связей.
12. По ММО сопоставьте прочность химической связи в частицах данного набора: Н – Н2 – Н – Н .
13.
Используя метод МО, укажите, какие из
приведенных ниже частиц будут
диамагнитными, а какие – парамагнитными:
Не
,
С
,
О![]() ,
В
.
,
В
.
14. По методу МО сопоставьте прочность химической связи в частицах данного набора: Li – Li2 – Li – Li .
15. В рамках метода МО объясните, почему существуют (или не существуют) следующие частицы: F2, Ar2, H .
16. По методу МО сопоставьте прочность химической связи в частицах данного набора: О – О2 – О – О .
17. По методу МО составьте энергетическую диаграмму образования связей в молекулах СО, FО, СN. Укажите порядок связи. Сделайте вывод об относительной прочности этих связей.
18. Составьте энергетические диаграммы образования связей в частицах ВС2-, СО2+ и FО2+. Укажите число электронов на связывающих и разрыхляющих МО и определите порядок связи. В какой из указанных частиц связь будет самой прочной, самой длинной? Какие из этих частиц парамагнитные?
19. По методу МО сопоставьте прочность химической связи в молекулах данного набора: В2 С2 О2 F2.
20. Как объяснить, что отрыв электрона от молекулы СО приводит к ослаблению связи, а от молекулы NO к её упрочнению?
21. Какая система является более стабильной: а) NO, NO + или
NO–; б) СN или СN–. Ответ обоснуйте, используя метод МО.
22. Составьте энергетическую диаграмму АО и МО молекул LiН и НF. Какие орбитали в них являются связывающими, а какие - разрыхляющими? Определите порядок связи в этих молекулах.
23. Как изменяются порядок связи и магнитные свойства в ряду молекулярных ионов: FС2-, FВ2-, FО–? Ответ обоснуйте, используя метод МО.
24. Охарактеризуйте магнитные свойства молекул В2, Не2, СО, FС. Определите порядок связи в этих молекулах.
25. Какая из молекул характеризуется более высокой энергией диссоциации на атомы: В2 или С2? Сопоставьте магнитные свойства этих молекул.
