
- •По дисциплине «химия»
- •Природа химической связи и ее характеристики
- •Разрыв связи в молекуле может быть осуществлен:
- •Находим объем, занимаемый 1 атомом хрома в кристаллической решетке
- •14. Произведите оценку длины связей в молекулах no и so, используя справочные данные о межъядерных расстояниях в простых веществах.
- •22. Оцените длины связей в молекулах ClO и co, используя справочные данные о межъядерных расстояниях в простых веществах.
- •Ковалентная связь. Гибридизация атомных орбиталей и геометрическая форма молекул
- •Из табл. 2 приложения находим эо атомов хлора и йода, которые равны 2,83 и 2,21 соответственно. Определяем разность эо атомов
- •По графику, приведенному на рис. 1, определяем си связи. Си 5 %. Тогда
- •Метод молекулярных орбиталей
- •Ионная связь и межмолекулярные взаимодействия
- •Многовариантное задание
- •Исходные данные
- •Список литературы
- •Приложение
- •Значения длины связи
- •Относительная электроотрицательность некоторых элементов
- •Виды гибридизаций ао и геометрические параметры частиц
- •Строение и ожидаемая полярность молекул
- •Ионные радиусы
- •Содержание
Разрыв связи в молекуле может быть осуществлен:
1) гомолитически, то есть с образованием атомов АВ А + В;
2) гетеролитически, то есть с образованием ионов АВ Аz+ + Bz-.
При изменении энергий связей в рядах однотипных соединений можно отметить следующие закономерности:
- чем больше разность между электроотрицательностями (ЭО) элементов, тем больше энергия связи между их атомами (правило Полинга);
- чем больше размеры атомов, тем меньше энергия связи;
- энергия связи в кристалле всегда больше, чем в соответствующей молекуле;
- энергия диссоциации по гомолитическому механизму ниже, чем по гетеролитическому.
Длина связи lА-В (нм) – это расстояние между ядрами химически связанных атомов. Эта характеристика зависит от размеров электронных оболочек и степени их перекрывания. Между длиной связи и ее энергией имеется определенная корреляция: чем меньше длина связи, тем больше энергия связи. Для приближенной оценки длины ковалентной связи в молекуле можно использовать формулу
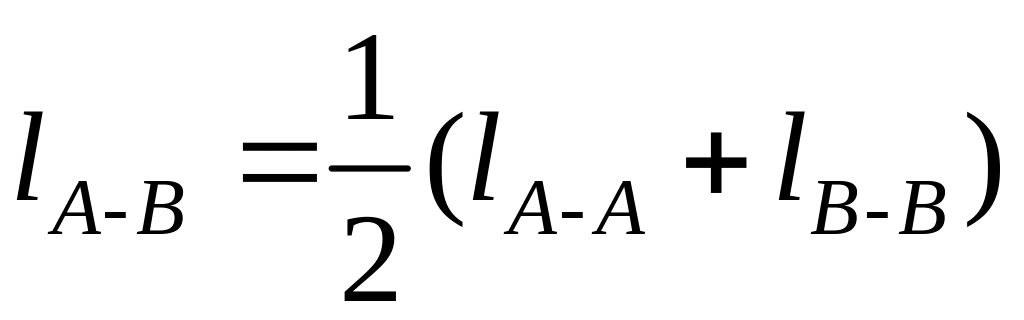 ,
(3)
,
(3)
где
![]() ,
,
![]() - межъядерные расстояния в молекулах
А2
и В2.
Половина межъядерного расстояния в
простой двухатомной молекуле называется
ковалентным
радиусом атома
rА.
- межъядерные расстояния в молекулах
А2
и В2.
Половина межъядерного расстояния в
простой двухатомной молекуле называется
ковалентным
радиусом атома
rА.
Для веществ, находящихся в кристаллическом состоянии, принято говорить о константе решетки K . Константа решетки - это расстояние между центрами двух соседних структурных частиц в кристалле. В ионном кристалле константа решетки равна сумме эффективных радиусов ионов.
Угол между воображаемыми прямыми, проходящими через ядра химически связанных атомов, называется углом связи или валентным углом. Его определяют с учетом гибридизации центрального атома в молекуле.
Пример 1. Вычислите длину связи в молекуле Н2О, используя справочные данные о межъядерных расстояниях в молекулах Н2 и О2.
Р е ш е н и е
Из табл. 1 приложения
выбираем значения длин связей в молекулах
водорода и кислорода
![]() =
0,074 нм;
=
0,074 нм;
![]() =
0,121 нм.
=
0,121 нм.
По формуле (3) вычисляем длину связи в молекуле Н2О:
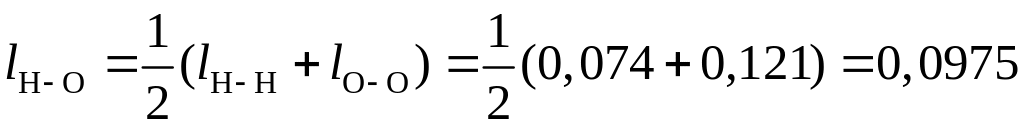 нм.
нм.
Пример 2. Константа
кристаллической решетки KCl
равна K = 0,316 нм.
Оцените эффективный радиус иона K+,
если радиус иона Cl–
![]() =
0,181 нм.
=
0,181 нм.
Р е ш е н и е
КСl является соединением ионного характера, поэтому эффективный радиус иона калия можно вычислить как разность между константой решетки и эффективным радиусом иона Cl–
![]() нм.
нм.
Пример 3. Средняя энергия связи N–Н в молекуле NH3 равна 385 кДж/моль. Какое количество энергии необходимо затратить, чтобы разложить на атомы: а) одну молекулу аммиака; б) 10 г аммиака?
Р е ш е н и е
Используя формулу (1), определяем энергию образования 1 моль молекул аммиака
![]() кДж/моль.
кДж/моль.
Тогда на разрушение 1 молекулы аммиака понадобится энергия
 Дж.
Дж.
Количество энергии, необходимой для разложения 10 г аммиака, равно
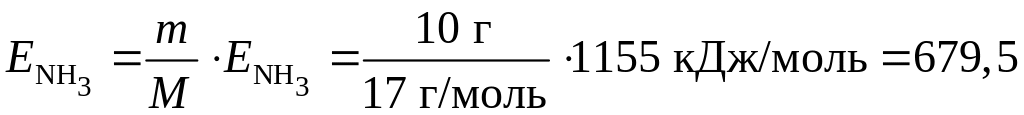 кДж.
кДж.
Пример 4. Вычислите эффективный радиус атома хрома, если плотность данного металла равна 7,16 г/см3.
Р е ш е н и е
Находим объем, занимаемый 1 атомом хрома в кристаллической решетке
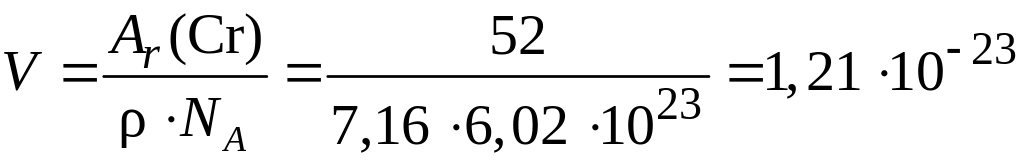 см3.
см3.
Считая условно форму атома кубической, вычисляем ребро куба, которое принимаем равным эффективному радиусу атома
![]() см
= 0,220 нм.
см
= 0,220 нм.
ЗАДАЧИ
1. Вычислите длину связи С–Cl в CCl4, используя длины связей
C–C и Cl–Cl. Расположите эти связи в порядке убывания их энергии. Ответ объясните.
2. Энергия связи в молекуле Н2 равна 436 кДж/моль, а в частице Н2+ – 256 кДж/моль. Сравните длину связи, ответ объясните. Определите, сколько молекул Н2 можно разложить на атомы, затратив 50 кДж энергии.
3. Ковалентный радиус атома брома равен 0,114 нм, а атома водорода – 0,030 нм. Рассчитайте межъядерные расстояния в молекулах Br2 и HBr. Сделайте вывод о том, какая из молекул является более прочной.
4. Длины связи в молекулах HF, HCl, HBr и HI соответственно равны (в нм): 0,092; 0,128; 0,142 и 0,162. Укажите характер изменения энергии связи в данном ряду молекул. Какая из кислот наиболее сильная и почему?
5. Энергия связи С–Н равна 445 кДж/моль. Определите энергию образования одной молекулы СН4. Какую энергию необходимо затратить, чтобы разложить до атомарного состояния 1 мг СН4?
6. Как изменяется длина и энергия связи в ряду соединений LiF, BeF2, BF3, CF4, F2? Ответ объясните, используя данные об ЭО элементов.
7. Ковалентный радиус атома водорода равен 0,030 нм. Вычислите ковалентные радиусы атомов F, Cl и I, используя данные о межъядерных расстояниях H–F, H–Cl и H–I. Сделайте вывод о прочности данных связей.
8. Укажите, как изменяется длина и энергия связи в ряду соединений: Li2O, Na2O, K2O. Ответ объясните.
9. Межъядерные расстояния в молекулах I2 и Cl2 равны 2,7 · 10-10 и 2,0 · 10-10 м соответственно. Рассчитайте длину связи в молекуле IСl.
10. Длина связи С–С равна 0,154 нм, а связи S–S равна 0,192 нм. Вычислите длины связей H–S в H2S и C–H в CH4.
11. Вычислите длины связей Н–S в Н2S и Н–N в NН3, используя справочные данные о межъядерных расстояниях в молекулах Н2, S2 и N2.
12. Рассчитайте эффективный радиус иона натрия в кристалле NaF, если константа решетки NaF равна 0,231 нм, а радиус иона F– равен 0,133 нм.
13. Эффективные радиусы ионов Zn2+ и S2- соответственно равны 0,831 и 0,182 нм. Определите константу решетки кристаллического сульфида цинка.
