
- •По дисциплине «химия»
- •Природа химической связи и ее характеристики
- •Разрыв связи в молекуле может быть осуществлен:
- •Находим объем, занимаемый 1 атомом хрома в кристаллической решетке
- •14. Произведите оценку длины связей в молекулах no и so, используя справочные данные о межъядерных расстояниях в простых веществах.
- •22. Оцените длины связей в молекулах ClO и co, используя справочные данные о межъядерных расстояниях в простых веществах.
- •Ковалентная связь. Гибридизация атомных орбиталей и геометрическая форма молекул
- •Из табл. 2 приложения находим эо атомов хлора и йода, которые равны 2,83 и 2,21 соответственно. Определяем разность эо атомов
- •По графику, приведенному на рис. 1, определяем си связи. Си 5 %. Тогда
- •Метод молекулярных орбиталей
- •Ионная связь и межмолекулярные взаимодействия
- •Многовариантное задание
- •Исходные данные
- •Список литературы
- •Приложение
- •Значения длины связи
- •Относительная электроотрицательность некоторых элементов
- •Виды гибридизаций ао и геометрические параметры частиц
- •Строение и ожидаемая полярность молекул
- •Ионные радиусы
- •Содержание
Из табл. 2 приложения находим эо атомов хлора и йода, которые равны 2,83 и 2,21 соответственно. Определяем разность эо атомов
ЭО(Cl – I) = 2,83 – 2,21 = 0,62.
По графику, приведенному на рис. 1, определяем си связи. Си 5 %. Тогда
СК = 100 – 5 = 95 %.
Из формулы (5) вычисляем эффективные заряды атомов
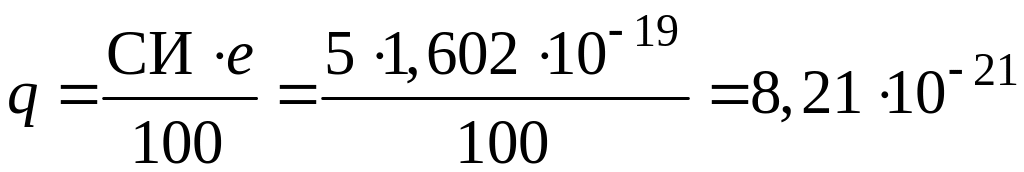 Кл.
Кл.
В молекуле IСl присутствует только одна связь I–Cl, поэтому ЭМД молекулы и ЭДМ связи совпадают. Используя формулу (4), вычисляем длину диполя:
 .
.
Пример
2. Укажите
механизм образования связей, направление
смещения общих электронных пар и способ
перекрывания АО в ионе SiF![]() .
Определите тип гибридизации центрального
атома, форму и полярность молекулы.
.
Определите тип гибридизации центрального
атома, форму и полярность молекулы.
Р е ш е н и е
Ион SiF может быть получен при взаимодействии двух ионов F– c молекулой SiF4. Запишем электронные формулы валентных подуровней взаимодействующих атомов и ионов:
Si: …3s2 3p2 3d0 F: …2s2 2p5 F–: …2s2 2p6
В основном состоянии атом кремния имеет два непарных электрона на 3p подуровне, атом фтора – один непарный электрон на 2р подуровне, а ион фтора не имеет непарных электронов. Для образования четырех связей с четырьмя атомами фтора по обменному механизму атому кремния необходимо иметь четыре одноэлектронных АО, поэтому он перейдет в возбужденное состояние:
Si + E Si*: …3s13p3.
Свободные АО 3d-подуровня со стороны Si участвуют в образовании двух связей с ионами F– по донорно-акцепторному механизму, в которых кремний выполняет роль акцептора, а ионы фтора являются донорами. Таким образом, в частице SiF четыре связи образованы по обменному механизму, а две – по донорно-акцепторному.
Из табл. 2 приложения находим ЭО(Si) = 1,74 и ЭО(F) = 4,00. Смещение общих электронных пар происходит к более ЭО атому F.
Так как все связи в ионе SiF являются одинарными, значит, по способу перекрывания АО они являются -связями.
Тип
гибридизации определяем по АО кремния,
которые участвовали в образовании
связей независимо от механизма их
возникновения. Со стороны атома Si
связи образованы с участием одной s-АО,
трех p-АО
и двух d-АО,
следовательно, тип гибридизации –
sp 3 d
2,
а геометрическая форма – октаэдр, так
как все гибридные АО являются связывающими,
то есть количество Ё = 0. По табл. 4
приложения определяем, что молекула
неполярная, то есть
![]() .
.
ЗАДАЧИ
1. Длины диполей молекул HCl и HI равны 2,23 · 10-9 и 8,68 10-10 cм соответственно. Проведя необходимые расчеты, определите, в какой молекуле связь менее полярная.
2. Каков характер ковалентной связи в молекулах NCl3, CS2, ICl5, NF3, OF2, ClF, CO? Укажите для каждой из них направление смещения общей электронной пары.
3. Какая из связей Са – Н, С – S или О – Cl является наиболее полярной? К какому из атомов смещено молекулярное электронное облако?
4. Дипольный момент связи Н – С равен 0,4D. Вычислите длину диполя.
5. Дипольные моменты связей в молекулах аммиака и воды равны соответственно 0,75 и 0,92 D. Вычислите длину диполя и определите, в какой молекуле связь наиболее полярная.
6.
Определите тип гибридизации АО атома
бора и геометрическую форму иона BF![]() . Опишите
механизм образования каждой связи.
. Опишите
механизм образования каждой связи.
7. Какую геометрическую форму имеют следующие молекулы; CuCl2, HgF2, ZrBr4?
8. Какую геометрическую форму имеют следующие молекулы и ионы: MoF6, FeF2, RuCl ?
9.
Какую геометрическую форму имеют
следующие молекулы и ионы: PtCl![]() ,
FeCl3,
NiCl2?
,
FeCl3,
NiCl2?
10. Перекрыванием каких АО образованы связи в молекулах AsH3, H2S, Cl2? Укажите геометрию и ЭМД (> 0 или = 0) данных молекул.
11. Какой из приведенных хлоридов имеет наиболее ионный характер связи: MgCl2, ZnCl2, HgCl2, BaCl2? Почему?
12. Укажите водородное соединение, имеющее наибольший электрический момент диполя молекулы: H2O, H2S, H2Se, H2Te. Ответ поясните.
13. Определите тип гибридизации центрального атома в молекулах: PH3 - тригональная пирамида; SO2 – угловая; BeCl2 – линейная; SeO3 – плоский треугольник.
14. Объясните с позиции МВС повышение энергии диссоциации молекул в ряду F2, O2, N2. Ответ поясните валентно-точечными схемами молекул.
15. Электрические моменты диполей молекул СО2 и РН3 соответственно равны 0 и 0,47 10 -29 Кл м. Укажите тип гибридизации центрального атома и полярность молекулы в каждом случае.
16. Определите, как изменяется характер связи в соединениях LiF, BeF2, BF3, CF4, F2. Ответ объясните, не используя данные об ЭО.
17. Какой тип перекрывания электронных облаков наблюдается в молекулах СОСl, Р2?
18. Расположите указанные вещества в порядке возрастания полярности связи: H2O, CH4, HF, NH3. Ответ объясните.
19. Какой тип перекрывания АО наблюдается в молекулах О2 и СаО?
20. Возможно ли образование связи между молекулами BF3 и NH3? Ответ объясните, используя МВС.
21. Приведите примеры молекул, в которых имеется: 1) одна -связь и одна -связь; 2) одна -связь и две -связи.
22. Энергия диссоциации равна 210 кДж/моль, длина связи О – О равна 0,15 нм. Энергия диссоциации и длина связи в молекуле кислорода соответственно равны 494 Дж/моль и 0,12 нм. Объясните этот факт с позиции МВС.
23. Какова валентность атомов в соединениях N2O3, HPO3, CO2? Ответ поясните валентно-точечными схемами.
24. Перекрыванием каких АО образуются связи в молекулах N2H4, C2H2?
25. Сколько связей по обменному механизму может образовать атом хлора и атом кремния? Приведите примеры.
