
- •Введение
- •Глава 1. Общая характеристика инициирующих взрывчатых веществ.
- •1.1. Классификация взрывчатых веществ.
- •1.2. Важнейшие представители ивв
- •1.3. Зависимость инициирующей способности ивв от различных факторов
- •1.4. Основные требования, предъявляемые к ивв
- •Глава 2. Соли гремучей кислоты (фульминаты)
- •2.1. Гремучая кислота и ее соли
- •2.2. Свойства гремучей ртути
- •2.3. Взрывчатые свойства гремучей ртути
- •2.4. Производство гремучей ртути
- •2.4.1. Производство гремучей ртути в стеклянной аппаратуре
- •В) Получение гремучей ртути.
- •2.4.2. Получение гремучей ртути в металлической аппаратуре
- •Глава 3.
- •3.1. Открытие азотистоводородной кислоты
- •Полученный азид бензойной кислоты обрабатывали едким натром.
- •3.2. Методы получения hn3 и ее солей
- •3.3. Строение азотистоводородной кислоты
- •3.4. Свойства азотистоводородной кислоты.
- •3.5. Азиды щелочных и щелочноземельных металлов
- •3.6. Промышленные способы получения азида натрия.
- •3.6.1. Производство азида натрия из семиоксида (закиси) азота и амида натрия.
- •3.6.1.1. Производство семиоксида (закиси) азота
- •3.6.1.2. Свойства и технология получения амида натрия
- •3.6.1.3. Получение азида натрия по методу Вислиценуса.
- •3.6.2. Получение азида натрия из гидразина и этилнитрита
- •3.6.2.1. Получение и свойства гидразина
- •3.6.2.2. Технология производства азида натрия
- •3.7. Азид свинца и его физико-химические свойства
- •3.8. Химические свойства азида свинца
- •3.9. Производство азида свинца
- •3.9.1. Декстриновый азид свинца
- •3.9.2. Получение кристаллического азида свинца
- •3.9.3. Карбоксиметилцеллюлозный азид свинца.
- •3.9.4. Поливинилспиртовый азид свинца.
- •3.9.5. Английский служебный азид свинца.
- •3.9.6. Достоинства и недостатки различных видов промышленного азида свинца.
- •3.10. Другие неорганические азиды.
- •3.11. Органические азиды
- •Глава 4. Стифниновая кислота и стифнаты
- •4.1. Получение стифниновой кислоты
- •4.2. Свойства тринитрорезорцината свинца
- •4.3. Технология получения тнрСа.
- •Глава 5.
- •5.1. Соли диазония
- •5.2. Оксидиазосоединения
- •5.3. Тетразен и тетразолы.
- •5.4. Органические пероксиды
- •5.5. Ацетилениды
- •Промышленные взрывчатые вещества Часть1. Инициирующие взрывчатые вещества
Глава 2. Соли гремучей кислоты (фульминаты)
2.1. Гремучая кислота и ее соли
Гремучая (фульминовая) кислота – нестойкое вещество плавится с разложением при минус 10 0С. Долгое время считалось, что она является карбонилоксимом (формоксимом) (C=NOH) с двухвалентным атомом углерода, и что в солях с катионом металла связан атом кислорода оксимной группы (M+n(ONC)n). Формоксимная структура гремучей кислоты стала общепринятой в литературе по ИВВ. Однако в 70-х годах 20-го века было строго установлено, что гремучая кислота в газообразном виде и в солях имеет нитрилоксидное строение (является формонитрилоксидом) и приблизительно описывается двумя предельными резонансными структурами:
![]()
Причем больший вклад вносит первая предельная структура. В солях гремучая кислота связана с катионами металлов исключительно атомом углерода. Ионную структуру имеют фульминаты щелочных металлов и таллия (I). Фульминаты тяжелых металлов, например, AgCNO, Hg(CNO)2 – преимущественно ковалентные соединения. Гремучая кислота является высокореакционноспособнным веществом.
При осторожном нагревании ионных и ковалентных солей возможна изомеризация фульминатов в цианаты.
KCNO KNCO
Гремучая кислота в свободном виде при температурах выше минус 15 0С склонна к полимеризации. В результате образуется вещество неопределенного строения с молекулярной массой около 1500. В растворах фульминовая кислота подвергается ди- и тримеризации. Состав конечных продуктов конденсации гремучей кислоты в кислой среде зависит от условий проведения синтеза.
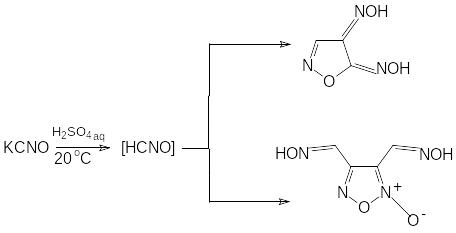
4,5-диоксиминоизоксазолин-2 (Метафульминуровая
кислота)
3,4-ди(метилоксимино)фуроксан (-изо-
цианиловая кислота)
-
3-гидроксо-4-карбоксамидофуразан (изофульминуровая кислота)
метилхлороксим (в эфире)
Оксицианглиосим
Из представленных схем видна сложность химических превращений гремучей кислоты. Поведение гремучей кислоты при полимеризации чрезвычайно чувствительно к условиям проведения синтеза. Существует ряд предположений о механизме образования конечных продуктов. Детали механизмов реакций постоянно уточняются. Наиболее доказанной в настоящее время является следующая схема превращений гремучей кислоты, приводящих к образованию смеси метафульминуровой (4,5-диоксиминоизоксазолина-2) и -изоцианиловой кислот (3,4-ди(метилоксимино)фуроксана).
Гремучая кислота первоначально димеризуется в незамещенный фуроксан, который, раскрывая цикл, дает реакционноспособный димер – оксиминоацетонитрилоксид. Последний реагирует по двум основным направлениям – или медленно димеризуется в -изоцианиловую кислоту или присоединяет одну молекулу гремучей кислоты. Образовавшийся тример в течение нескольких минут циклизуется в метафульминуровую кислоту. В оксиминоацетонитрилоксиде оксимная группа имеет Z-конфигурацию. Такое же строение первоначально имеет -изоцианиловая кислота. Z,Z-оксимные группы в составе -изоцианиловой кислоты медленно измеризуются в течение примерно суток в более термодинамически выгодные Е.Е-оксимы.
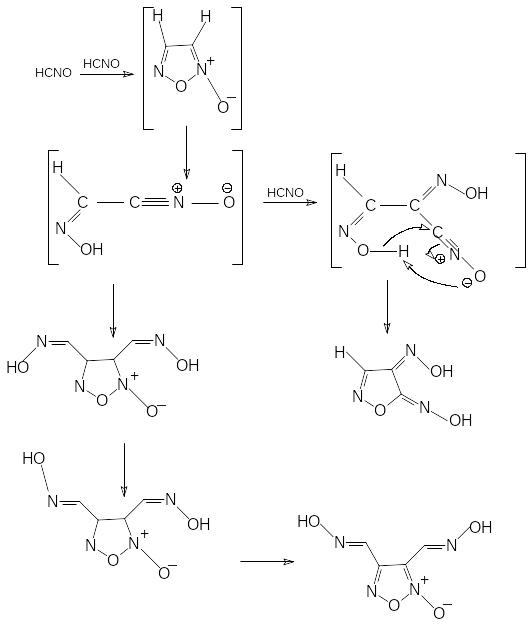
Фуроксан
оксиминоацетонитрилоксид
медленно быстро
(3-4 часа) (несколько минут)
Z,Z--изоцианиловая кислота
Метафульминуровая кислота
0,5=3 часа
0,5=24 часа
E,Z--изоцианиловая кислота
E,E- -изоцианиловая кислота
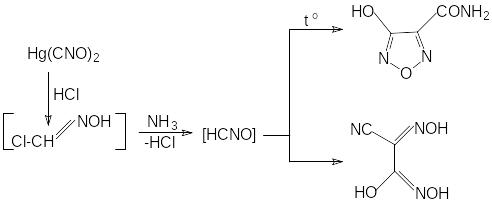
При нагревании в воде гремучая кислота полимеризуется до тримера – фульминуровой кислоты (нитроцианацетамида).
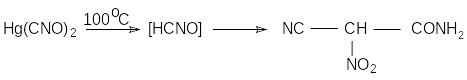
CaCl2
нитроцианацетамид
Доказано, что фульминуровая кислота – это вторичный продукт полимеризации, образующийся в результате цепи превращений первоначально получающегося тримера - метафульминуровой кислоты. Начинается реакция с раскрытия изоксазольного цикла метафульминуровой кислоты, последующего образования гидроксицианфуразана -
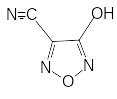
который гидролизуется с раскрытием цикла и затем превращается в нитроцианацетамид. Точный механизм этой сложной реакции не установлен.
Гремучая кислота в результате 1,3-диполярного присоединения к ацетиленам образует изоксазолы.
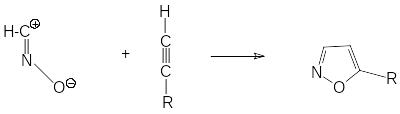
изоксазолы
Г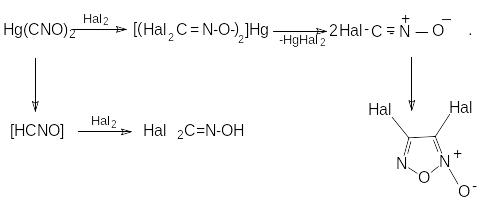 алогенирование
фульминатов приводит к получению
дигалогенформальдоксима и дигалогенфуроксана:
алогенирование
фульминатов приводит к получению
дигалогенформальдоксима и дигалогенфуроксана:
галогенформонитрилоксид
дигалогенформальдоксим
дигалогенфуроксан
Согласно приведенной схеме, дигалогенфуроксан получается в результате галогенирования соли (при димеризации галогенформонитрилоксида), а дигалогенформальдоксим образуется из гремучей кислоты. Скорость реакции определяется галогеном. Хлор реагирует очень быстро, бром – несколько медленнее, иод – значительно медленнее. При избытке галогена соль не успевает элиминировать галогенид металла и перейти в дигалогенфуроксан. Галоген присоединяется к атому углерода двойной связи C=N с вытеснением катиона металла и образованием тригалогеннитрозометана.
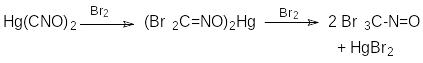
Это - побочная реакция.
Гремучая ртуть, а также гремучее серебро как энергетические соединения известны с начала XIX века. Они получаются из свободного металла, этилового спирта и азотной кислоты, оптимальные соотношения между которыми были установлены англичанином Говардом.
Механизм образования гремучей ртути из азотнокислого раствора ртути и этилового спирта был предложен Виландом:
CH3CH2OH + HNO3 CH3CHO + HNO2 + H2O.
CH3CHO + HNO2 ON-CH2-CHO + H2O
НON=CH-CHO
НON=CH-CHO + HNO3 НON=CH-COOH + HNO2
НON=CH-COOH + HNO3 НON=C(NO2)-COOH + H2O
80 0С
НON=CH-NO2 + СО2
НON=CH-NO2 HСNO + HNO2
2HСNO + Hg(NO3)2 (ONC)2Hg + 2HNO3
Согласно представленной схеме, этанол окисляется 60%-ной азотной кислотой до ацетальдегида, который нитрозируется до нитозоуксусного альдегида. Последний после изомеризации в изонитрозоацетальдегид окисляется азотной кислотой до изонитрозоуксусной кислоты. Изонитрозоуксусная кислота нитруется до нитроизонитрозоуксусной кислоты. Полученное соединение является нестойким и при повышенной температуре (~ 80 0C) подвергается декарбоксилированию. Образовавшаяся нестойкая метилнитроловая кислота в свою очередь распадается на гремучую и азотистую кислоты. Гремучая кислота реагирует с катионом ртути, давая гремучую ртуть.
Схема Виланда во многом спекулятивна. Так, нитроизонитрозуксусная кислота, взятая в отдельности, не приводит к получению гремучей ртути. Кроме того, реакция идет только в присутствии оксидов азота и только с катионами ртути и серебра. Следовательно, схема Виланда не полностью отражает механизм образования фульминатов.
В качестве побочных продуктов при получении гремучей ртути из отходящих газов выделяются и могут быть утилизированы этиловый спирт, азотная кислота, содержащая оксиды азота, этилнитрат (C2H5ONO2), этилнитрит (C2H5ONO). Кроме того, в отходящих газах присутствует вода, оксид углерода и другие продукты.
В 1820 году французские ученые занялись подробным изучением гремучей ртути. В результате они пришли к заключению, что данный продукт можно применять для снаряжения капсюлей-воспламенителей, после чего в европейских странах и США началось его производство. Первое упоминание о промышленном производстве гремучей ртути в России датируется 1843 годом. В 1854 году Давыдовым был предложен запал морской мины, где в качестве капсюля-детонатора использовалась гремучая ртуть. В 1867 году Альфред Нобель приобрел патент на производство капсюля-детонатора, снаряженного гремучей ртутью. В последующие годы гремучую ртуть стали повсеместно использовать в средствах инициирования.
Несмотря на то, что с 1929 в СССР началось производство азида свинца, успешно вытесняющего гремучую ртуть из капсюльных изделий, последняя применяется и сегодня.
