- •Введение
- •Глава 1. Общая характеристика инициирующих взрывчатых веществ.
- •1.1. Классификация взрывчатых веществ.
- •1.2. Важнейшие представители ивв
- •1.3. Зависимость инициирующей способности ивв от различных факторов
- •1.4. Основные требования, предъявляемые к ивв
- •Глава 2. Соли гремучей кислоты (фульминаты)
- •2.1. Гремучая кислота и ее соли
- •2.2. Свойства гремучей ртути
- •2.3. Взрывчатые свойства гремучей ртути
- •2.4. Производство гремучей ртути
- •2.4.1. Производство гремучей ртути в стеклянной аппаратуре
- •В) Получение гремучей ртути.
- •2.4.2. Получение гремучей ртути в металлической аппаратуре
- •Глава 3.
- •3.1. Открытие азотистоводородной кислоты
- •Полученный азид бензойной кислоты обрабатывали едким натром.
- •3.2. Методы получения hn3 и ее солей
- •3.3. Строение азотистоводородной кислоты
- •3.4. Свойства азотистоводородной кислоты.
- •3.5. Азиды щелочных и щелочноземельных металлов
- •3.6. Промышленные способы получения азида натрия.
- •3.6.1. Производство азида натрия из семиоксида (закиси) азота и амида натрия.
- •3.6.1.1. Производство семиоксида (закиси) азота
- •3.6.1.2. Свойства и технология получения амида натрия
- •3.6.1.3. Получение азида натрия по методу Вислиценуса.
- •3.6.2. Получение азида натрия из гидразина и этилнитрита
- •3.6.2.1. Получение и свойства гидразина
- •3.6.2.2. Технология производства азида натрия
- •3.7. Азид свинца и его физико-химические свойства
- •3.8. Химические свойства азида свинца
- •3.9. Производство азида свинца
- •3.9.1. Декстриновый азид свинца
- •3.9.2. Получение кристаллического азида свинца
- •3.9.3. Карбоксиметилцеллюлозный азид свинца.
- •3.9.4. Поливинилспиртовый азид свинца.
- •3.9.5. Английский служебный азид свинца.
- •3.9.6. Достоинства и недостатки различных видов промышленного азида свинца.
- •3.10. Другие неорганические азиды.
- •3.11. Органические азиды
- •Глава 4. Стифниновая кислота и стифнаты
- •4.1. Получение стифниновой кислоты
- •4.2. Свойства тринитрорезорцината свинца
- •4.3. Технология получения тнрСа.
- •Глава 5.
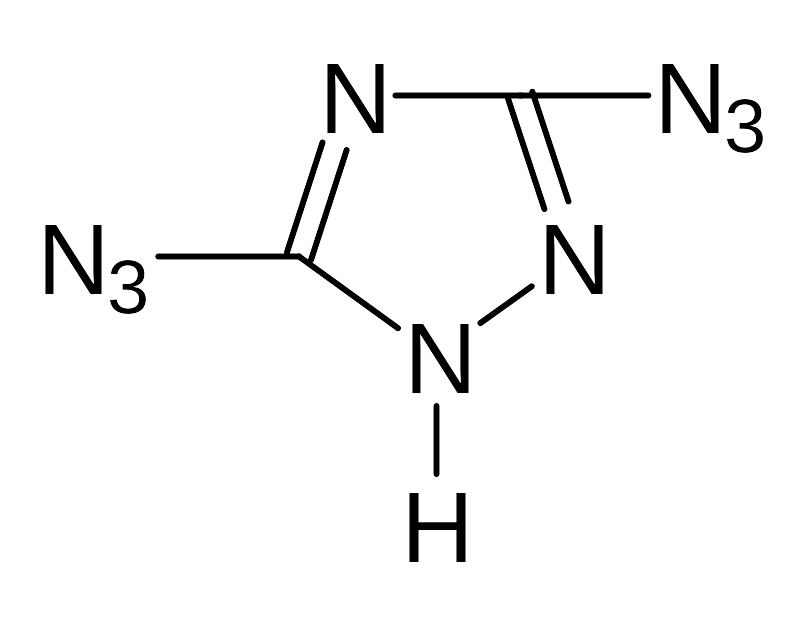
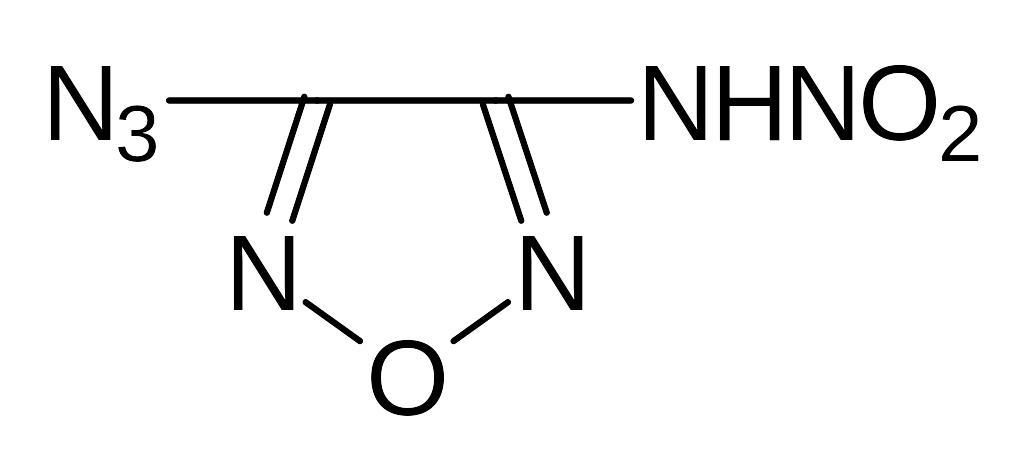
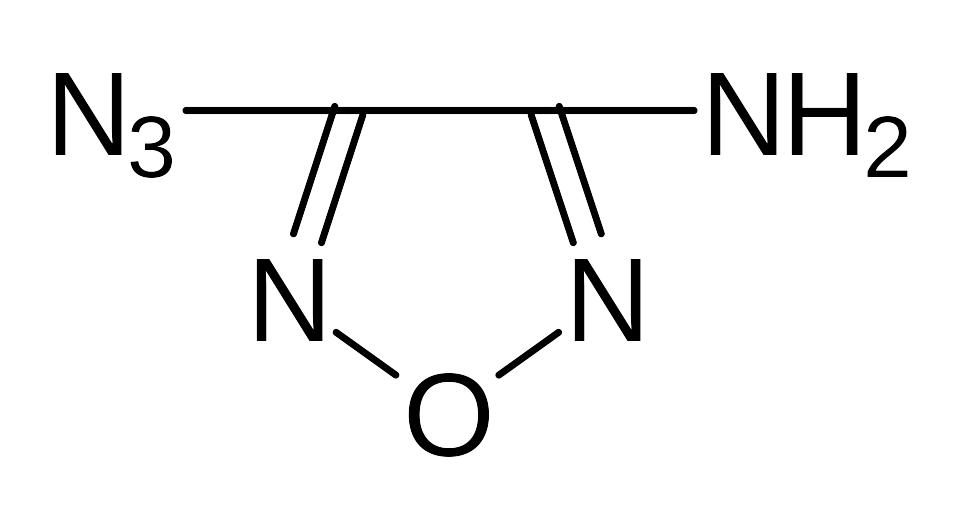
- •5.1. Соли диазония
- •5.2. Оксидиазосоединения
- •5.3. Тетразен и тетразолы.
- •5.4. Органические пероксиды
- •5.5. Ацетилениды
- •Промышленные взрывчатые вещества Часть1. Инициирующие взрывчатые вещества
1.3. Зависимость инициирующей способности ивв от различных факторов
Не нуждается в доказательствах тот факт, что химическая структура вещества определяет его взрывчатые свойства. Взрывчатое вещество должно быть способным к сильно экзотермической реакции разложения с выделением большого количества газообразных продуктов. На первой стадии разложения, являющейся общей для всех ВВ, происходит разрыв слабых связей в молекуле. Это стадия фрагментации. Она протекает с поглощением тепла.
Последующие экзотермические процессы, включающие окислительно-восстановительные реакции, рекомбинацию свободных радикалов и т.д., приводят к образованию стабильных конечных продуктов.
Установлением связи инициирующей способности инициирующих ВВ с их составом и строением занимались многие исследователи. Ими выбирались как различные критерии оценки параметров строения, влияющих на инициирующую способность, так и разные классы ИВВ, по которым проводилось сравнение. Рассмотрим некоторые из полученных зависимостей.
А). В качестве критерия оценки легкости возбуждения быстрого разложения ВВ, в том числе детонации, была выбрана полярность слабой связи (C-NO2, N-NO2, O-NO2, а также N-N-кольца для тетразолов). Изучение чувствительности к удару нитроароматических веществ, N-нитроаминов, нитроэфиров, пикрилазолов, тетразолов и традиционных ИВВ привело к выводу о едином для всех ВВ механизме ответа на внешнее воздействие на молекулярном уровне, заключающемся в изменении полярности слабой связи и последующем ее разрыве. Расчет изменения полярности () связи проводили полуэмпирическими квантово -химическими методами INDO и CNDO/S для основного состояния и CNDO/CI - для возбужденного. Считая, что для органических молекул первой стадией распада является изменение спина валентного электрона наиболее слабой связи с переходом на разрыхляющую орбиталь, что эквивалентно = 100%, была проведена классификация ВВ от менее чувствительных бризантных к более чувствительным инициирующим.
нитроароматика 15 <30%
нитроамины 25 55%
нитроэфиры 40 50%
пикрилазолы 10 65%
тетразолы 75 95%
Слабой связью, в частности, для 1,5- и 2,5-дизамещенных тетразолов является связь N-N в цикле между атомами N1-N2 и N2-N3, соответственно. В качестве индекса реакционной способности при гомолитическом термораспаде тетразолов было предложено использовать кулоновские компоненты энергии возбуждения (Ek)
Ek = q1·q2/r1,2
где q1,q2 - заряды атомов, образующих слабую связь N-N, r1,2 - расстояние между атомами, рассчитанное методом MNDO с полной оптимизацией геометрии молекул. Для 1,5-дизамещенных тетразолов:
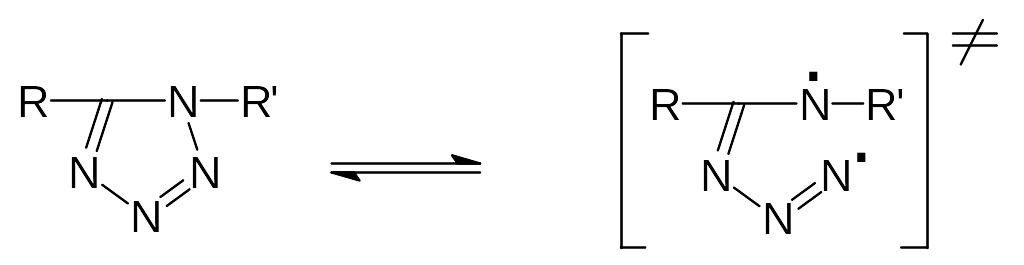
lgK200 = 2,406 EkN-N 103 - 20,701
где К200 – константа скорости реакции термораспада при 200 0С.
для 2,5-дизамещенных тетразолов
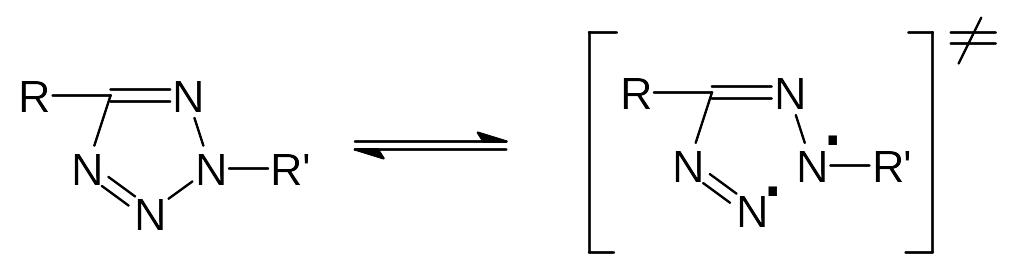
lgK200 = 0,984 EkN-N 103 - 1,422
Акцепторные заместители увеличивают величину заряда на атомах азота, образующих слабую связь. В результате возрастает скорость термораспада тетразолов, а также чувствительность к удару и склонность к быстрому переходу горения в детонацию. Расчеты показали, что на скорость термораспада больше влияет природа акцепторного заместителя у атома азота гетероцикла, чем у атома углерода.
Изучение свойств ряда тетразолов с акцепторными заместителями (2-пикрил-5-нитротетразола и 5-нитрометилтетразолов) показало, что эти соединения имеют короткий участок перехода горения в детонацию и являются ИВВ, а 2-пикрил-5-нитротетразол, кроме того, имеет высокую чувствительность к удару, сравнимую с тетразеном.

2-метил-5-нитротетразол 1-метил-5-нитротетразол
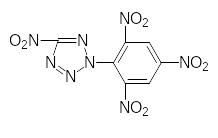
2-пикрил-5-нитротетразол
Следовательно, квантово-химические методы дают ценную информацию о состоянии электронных уровней молекул органических ВВ, в том числе ИВВ, позволяют предсказывать вероятные пути распада молекул и состав первичных продуктов разложения, оценивать их эксплуатационные, в том числе взрывчатые характеристики. Однако, поскольку не существует адекватной квантовой модели для солей тяжелых и переходных металлов и их комплексов с внешней сферой, составляющих большую часть классов ИВВ, то предсказательная сила таких расчетов весьма ограничена.
Для предварительной оценки инициирующей способности ИВВ обычно привлекают качественные представления или полуэмпирические и эмпирические модели.
Б). Среди взрывчатых солей металлов наиболее подробно изучены неорганические азиды (Mn+(N3)n-). Азид-ион может быть описан следующей структурной формулой
![]()
Расчет по методу молекулярных орбиталей дает для азидного иона, кроме двух –связей (между –N--N или –N--N), две связующие –орбитали, которые образуют –связи. Формальный заряд на крайних атомах азота составляет –0,8, а на среднем атоме +0,6. В азид-ионе N3- оба концевых атома азота имеют по две неподеленные электронные пары. В ионных кристаллах KN3 и NaN3 азид-ион представляет собой линейную и симметричную структуру. Расстояния -N--N и -N--N равны 1,150,02 Å, что несколько больше расстояния между атомами азота в тройной связи (так, для молекулы N2 r = 1,13 Å).
Принято считать, что взрывное разложение азидов является следствием реакции, включающей электронный перенос:
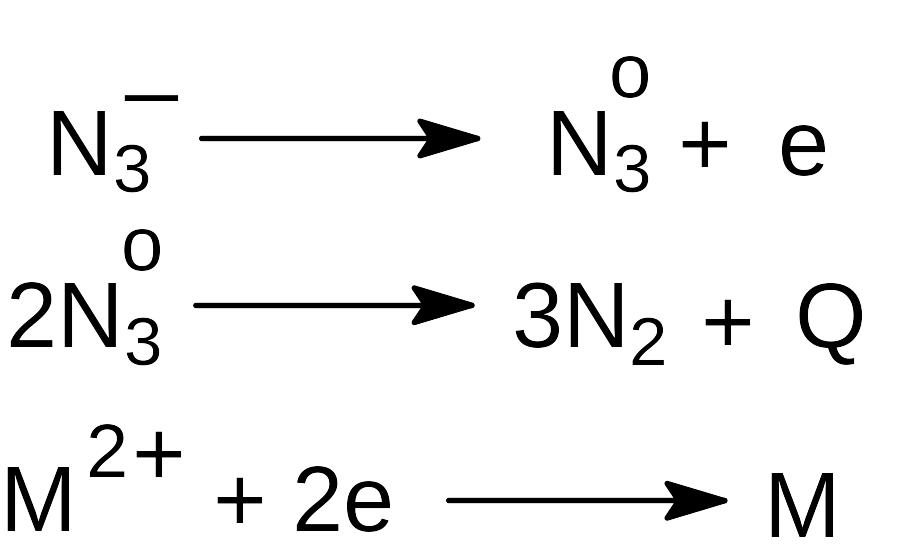
где М2+ - катион металла.
В результате выделяется энергия (Q), равная 9 - 12 эВ.
Теплота взрыва неорганических азидов приблизительно равна энтальпии их образования. Последняя может быть найдена из цикла Борна – Габера:
Hfo(MN3)тв = I(М) + HSo(M) - U(MN3) –2RT + Hfo(N3)г – E(N3-)
где, Hfo(MN3)тв. - энтальпия образования неорганического азида; I(М) - потенциал ионизации металла; HSo(M) - энтальпия сублимации металла; U(MN3) - энергия кристаллической решетки; Hfo(N3)г - энтальпия образования азидного радикала; E(N3-) - сродство к электрону азидного радикала. Первые три члена уравнения зависят от природы металла, остальные члены уравнения от металла не зависят. При изменении природы металла больше всего варьирует член I(М). Общепринято мнение, что кристаллическая структура азидов определяет как их поведение при медленном термораспаде, так и склонность к взрывчатым превращениям. Степень ковалентности связи металла в солях возрастает с ростом потенциала ионизации металла, что подтверждается образованием цепочек, как в азиде меди (см. рис. 4), или асимметрии азидных групп, как в азиде свинца.
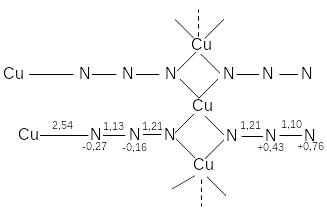
Рис. 4. Фрагмент цепи в структуре Cu(N3)2
Распад неорганических азидов начинается с разрыва связи M-N, энергия которой без учета эффекта поляризации равна
D(M-N3) = E(N3-) - I(М) + U(MN3) = Hfo(N3)г + HSo(M) - Hfo(MN3)тв.,
Энергия разрыва слабой связи в азиде уменьшается с увеличением потенциала ионизации металла. Причем она близка к значению энергии выхода электрона в зону проводимости. Таким образом, природа катиона определяет взрывчатые характеристики неорганических азидов, поскольку увеличение энтальпии образования катиона, в основном определяющейся потенциалом ионизации металла, приводит к увеличению энтальпии образования азида. При этом кристаллическая решетка все более отклоняется от ионной, что соответствует увеличению ковалентности связи M-N3 в кристалле ИВВ и уменьшению ее энергии. Указанные зависимости позволяют объяснить связь между энергией активации медленного термического разложения азидов и теплотой реакции быстрого термораспада.
Eакт. = с + Hoразл. ,
где Eакт. - энергия активации медленного термораспада; Hoразл. - теплота взрыва, с, - постоянные.
Энергия активации термораспада связана с тепловой энергией, которая необходима для возбуждения электрона азидного иона N3- до выхода его в зону проводимости и инициирования тем самым взрыва неорганического азида. Эта энергия уменьшается с повышением потенциала ионизации катиона.
Однако приведенная зависимость не является строгой, так как термическое разложение азидов - сложный процесс, зависящий во многом от предыстории образца, дисперсности, температурного диапазона исследования, степени распада и других факторов. Все же общая тенденция изменения устойчивости азидов с изменением потенциала ионизации катионов сохраняется, поэтому величина их минимального заряда связана корреляционной зависимостью с энтальпией образования солей:
lnW = d + b·ln Hfo;
где W - минимальный заряд; b, d, - коэффициенты; Hfo - энтальпия образования азида, равная теплоте взрыва по абсолютной величине.
Двухстадийная схема разложения азидов тяжелых металлов несовершенна и нуждается в уточнении. Причем это относится не только к медленному термораспаду, но и к режиму детонации, поскольку в продуктах взрыва азида свинца были найдены ионы N+3, N+6, N+4 и атомарный азот, концентрация которого сравнима с концентрацией молекулярного азота. Следовательно, низкая скорость процесса взрывчатого разложения на участке разгона детонации азидов обусловлена, очевидно, неполным энерговыделением при распаде молекул.
В). Исследование кинетики термического и фотохимического разложения фульминатов показало, что первая стадия разложения зависит от прочности связи металл-анион. Так, у ионных фульминатов натрия (NaCNO) и таллия (TlCNO) имеет место электронный перенос, а для фульминатов серебра (AgCNO) и ртути [Hg(CNO)2] с большей ковалентностью связи металл-углерод процесс диссоциации лимитируется гомолитическим разрывом связи металл-фульминат. Найдена корреляционная зависимость между энергией активации термолиза и фотолиза, с одной стороны, и теплотой взрыва, с другой:
Еакт. = с + d·Q
где Еакт. - энергия активации (кДж/моль) низкотемпературного термолиза или фотолиза; Q - теплота взрыва (кДж/г); с, d – коэффициенты.
Из найденных линейных соотношений делается вывод об общности механизмов начальных стадий распада фульминатов при фотолизе, низкотемпературном термолизе и взрыве, что не согласуется с экспериментальными данными. Так, известно, что, например, механизм разложения гремучей ртути зависит от вида и условий воздействия. При термолизе фульминат ртути разлагается в одну стадию с образованием металлической ртути и оксида ртути (II): Hg(CNO)2 тв. Hg + HgO тв. + газы
В то же время при термическом взрыве разложение протекает по схеме:
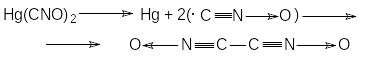
(CNO)2 C2N2O, O, N2O, C2N4 C2N2, N2O, CO2,
NO, N2,CN
Распад начинается с разрыва связи Hg-C и образования радикала карбонитрилоксида .CNO и его димеризации, затем происходит разложение димера (CNO)2 и дальнейшая фрагментация с образованием конечных продуктов. При лазерном инициировании взрыва гремучей ртути в продуктах ее первичного распада нашли ртуть, CN и C2 .
Сложность процессов на начальных стадиях разложения фульминатов и их зависимость от условий проведения эксперимента не позволили получить прямую зависимость величины участка перехода горения в детонацию от энергетических характеристик солей.
Г). В солях азотетразола, полученных замещением двух атомов водорода NH-групп катионом металла, наблюдается тенденция уменьшения минимального заряда при возрастании второго потенциала ионизации катиона (в ряду Ba2+, Pb2+, Hg2+).
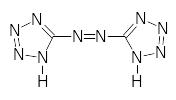
5,5’-азотетразол
Одновременно повышается чувствительность солей к механическим и тепловым воздействиям. Поскольку при одном и том же анионе изменение энтальпии образования солей определяется, в основном, изменением энергии катиона Hfo[M+г], которая равна I + HSo(M), где I - потенциал ионизации металла; HSo(M) - энтальпия сублимации металла; то с увеличением потенциала ионизации катионов возрастает молярная теплота взрыва солей. Таким образом, имеется связь энергетических характеристик молекул ИВВ с величиной участка перехода горения в детонацию, что подразумевает общие начальные стадии медленного и быстрого термического разложения этого класса соединений. Среди солей азотетразола наиболее подробно изучен [гидроксо-свинец (II) 5,5-азобистетразолил].
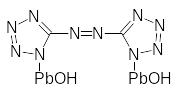
[Гидроксо-свинец (II) 5,5-азобистетразолил]
На первой стадии разложения происходит разрыв экзоциклической связи С-N. что подтверждается присутствием фрагмента CN4 в продуктах как термолиза, так и вспышки.
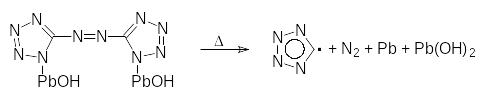
Масс-спектрометрическое изучение конечных продуктов распада [гидроксо-свинец (II) 5,5-азобистетразолила] в режимах медленного термолиза и вспышки показало, что они отличаются.
Основными газообразными продуктами при термолизе являются азот и изоциановая кислота (HN=С=O), получающаяся в результате вторичных реакций.
Разложение [гидроксо-свинец (II) 5,5-азобистетразолила] при вспышке происходит в два этапа. Наряду с фрагментом CN4 одним из начальных продуктов распада является группировка N4C-N, образующаяся в результате разрыва связи -N=N- азомостика, хотя она и более прочная, чем экзоциклическая связь С-N. При вспышке зарегистрированы вторичные продукты взаимодействия CN и (СN)2, которых не наблюдали в продуктах термолиза. Это - C3N4, C4N3, C2N4, C3N3, а также тетразол, образовавшийся из CN4.
Д). Для солей гидразотетразола, близкого по структуре к азотетразолу, отсутствует зависимость минимального заряда от потенциала ионизации тех же металлов (Ba2+, Pb2+, Hg2+).
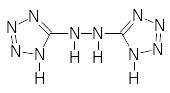
Гидразотетразол
Отсутствие связи между энергией активации термораспада и теплотой взрывчатого разложения тетразолатов указывает на различие механизмов распада в изученных условиях и в режиме перехода горения в детонацию.
Е). Повышенный интерес исследователей привлекли такие эффективные ИВВ, как серебряная и ртутная соли 5-нитротетразола.
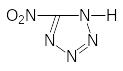
5-нитротетразол
Ртутная соль ниже температуры вспышки разлагается в одну макрокинетическую стадию по первому порядку с энергией активации 162.5 кДж/моль. Теплота разложения в режиме вспышки составляет 2590 кДж/кг. При разложении нитротетразолатный анион в одну стадию превращается в газообразные продукты, затем происходит медленное испарение металлической ртути. При вспышке в начале пиролиза энергия выделяется со скоростью 1,22 Дж/(г·с), затем процесс ускоряется, достигая максимального значения 320.1 Дж/(г·с). Для БВВ скорость энерговыделения при вспышке значительно ниже, например, для тротила она составляет всего 0,04 Дж/(г·с). Нитротетразолат серебра распадается в две стадии, причем около 80% вещества разлагается на первом этапе. Основной твердый продукт разложения - металлическое серебро. Возможно, что при пиролизе образуется некоторое количество оксида серебра. Энергия активации первой стадии разложения составляет 190 кДж/моль, второй - 240 кДж/моль. Теплота разложения нитротетразолата серебра равна 430 кДж/моль (1940 кДж/кг). Таким образом, природа катиона оказывает существенное воздействие на процесс разложения.
Нитротетразолат ртути (II) является одним из наиболее эффективных ИВВ. Скорость детонации нитротеразолата ртути превышает 6000 м/с. а время разгона детонации примерно в четыте раза меньше, чем у азида свинца. Минимальный заряд по гексогену у нитротетразолата ртути приблизительно в четыре раза меньше, у нитротетразолата серебра - примерно в 2,5 раза меньше, чем у азида свинца.
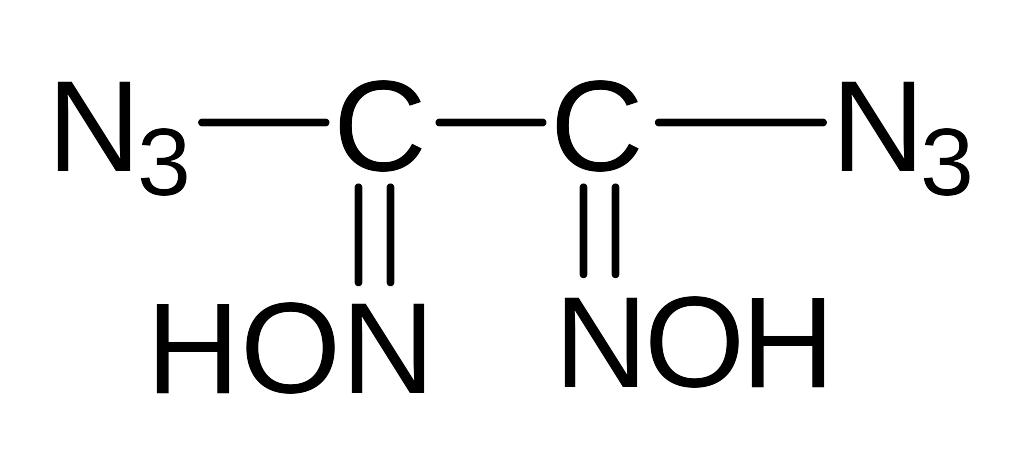
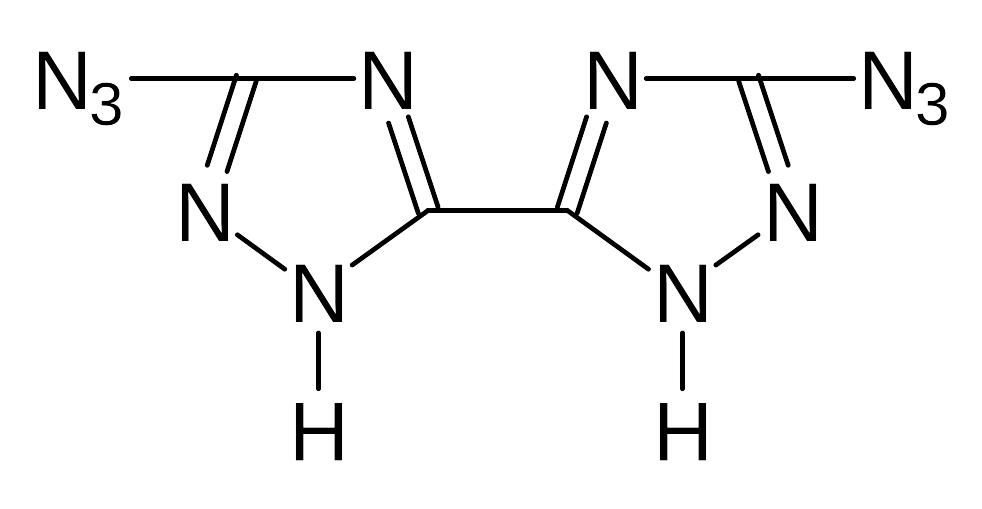
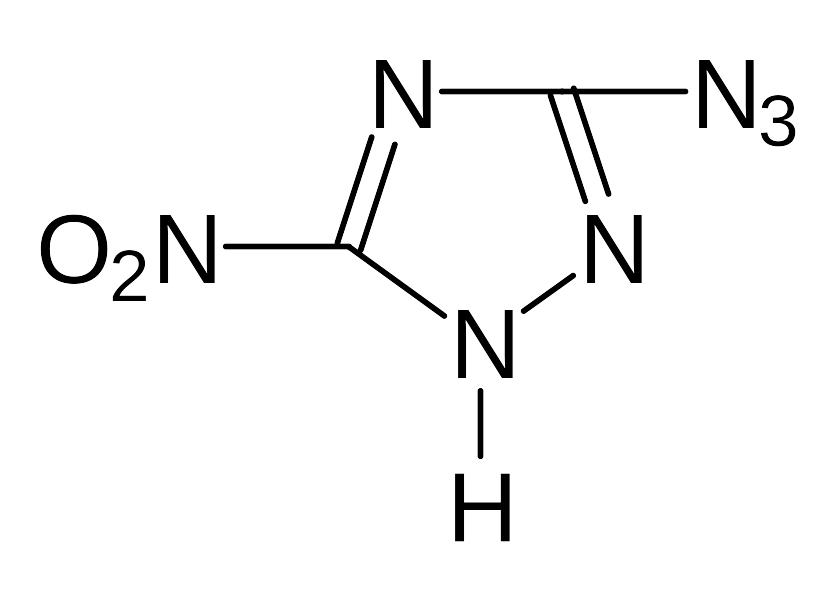
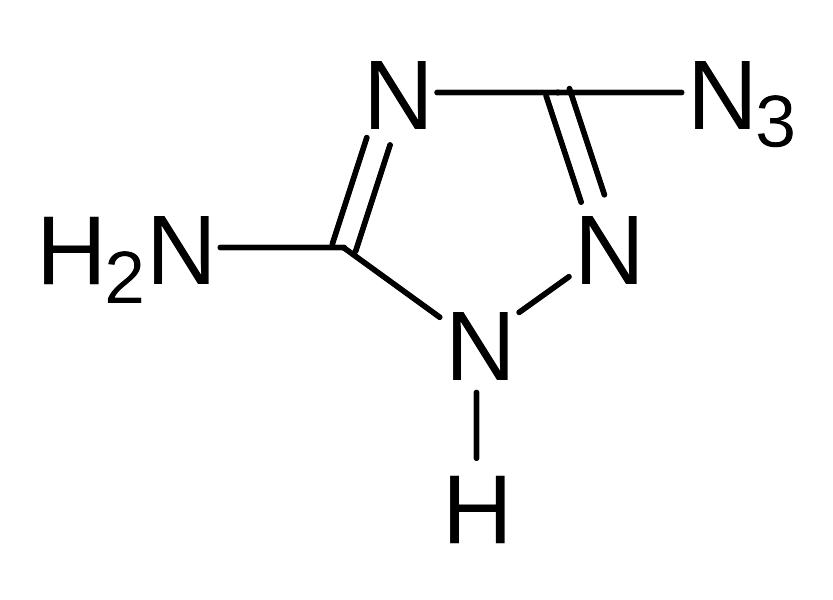
Ж). Изучение свойств медной, серебряной, свинцовой и ртутной солей 1,2-диазидоглиоксима, бис(3-азидо-1,2,4-триазолила-5), 3-азидо-5-нитро-1,2,4-триазола, 3-азидо-5-амино-1,2,4-триазола, 3,5-диазидо-1,2,4-триазола, 3-азидо-4-нитро-аминофуразана, 3-азидо-4-аминофуразана
|
|
|
|
||
1,2-диазидогли-оксим |
бис(3-азидо-1,2,4-триазолил-5) |
3-азидо-5-нитро-1,2,4-триазол |
3-азидо-5-амино-1,2,4-триазол |
||
|
|
|
|||
3,5-диазидо-1,2,4-триазол |
3-азидо-4-нитро-аминофуразан |
3-азидо-4-аминофуразан |
|||
показало, что природа катиона существенно сказывается на их инициирующей способности. Первой стадией разложения солей органических азидов является деградация азидогруппы с элиминированием молекулы азота. Если предположить, что интенсивность протекания как этой реакции, так и дальнейших превращений будет зависеть от теплоты термораспада, то, очевидно, ее значение должно сказываться на величине участка перехода горения в детонацию и, следовательно, минимального заряда. Действительно, в серии солей с одним металлом наблюдается устойчивая тенденция уменьшения минимального заряда солей с увеличением их энтальпии образования (в кДж/кг), аналогичная найденной для неорганических азидов. Таким образом, было получено еще одно экспериментальное подтверждение того факта, что на участке перехода горения в детонацию выделяется только часть потенциальной энергии, заложенной в ИВВ.
З). Еще одним предположением, связывающим структуру и свойства ИВВ, является принцип “минимальной перестройки”, предполагающий, что необходимым условием наличия инициирующей способности у ИВВ является перераспределение связей в результате термораспада и образование конечных продуктов, а не перегруппировка атомов, сопровождающая окислительно-восстановительные взаимодействия первичных продуктов разложения. Это предположение правильно по своей сути и иногда применимо на практике. Однако оно часто бывает бесполезно в случае ИВВ, для которых не выяснен механизм термораспада, например, солей нитрофенолов.
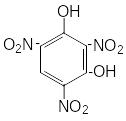
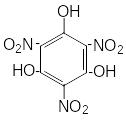
Систематическое изучение солей пикриновой, стифниновой кислот и тринитрофлороглюцина показало, что в солях двухвалентных металлов теплота взрыва уменьшается в стифнатах по сравнению с пикратами и возрастает в солях тринитрофлороглюцина.
|
|
|
2,4,6-тринитрофенол, пикриновая кислота |
2,4,6-тринитрорезорцин, стифниновая кислота |
Тринитрофлороглюцин |
По мере увеличения заряда аниона возрастает длина связей С-С и С-N, что приводит к снижению термостабильности соответствующих солей. В ряду пикрат свинца, стифнат свинца (ТНРС), тринитрофлороглюцинат свинца сокращается участок перехода горения в детонацию. Тринитрофлороглюцинат свинца способен инициировать детонацию БВВ в габаритах гильзы КД № 8, что объясняют снижением прочности связей в фенильном ядре, повышенной плотностью соли, более высокой теплотой взрыва и меньшим критическим давлением инициирования по сравнению с ТНРС’ом, который в этих условиях инициирующей способностью не обладает.
З). Существует концепция, связывающая число стадий медленного термораспада с инициирующей способностью солей. Считается, что чем меньше число стадий, следующих за первичной фрагментацией, и чем они экзотермичней, тем вероятнее, что горение легче перейдет в детонацию и инициирующая способность зарядов ИВВ станет выше. Изучение продуктов термораспада на участке разгона и в режиме детонации является сложной технической задачей, поэтому в литературе имеются лишь сведения о быстром распаде неорганических азидов, ТНРС’а, гремучей ртути. Кроме того, в ряде случаев удалось на основании рассмотрения продуктов медленного термического разложения определить поведение ВВ при детонации.
И). В органических азидах азидная группа асимметрична и иногда нелинейна. Согласно расчетам, ковалентные азиды имеют различные формальные заряды на атомах азота: -N –0,7; -N +0,9; -N –0,2, что изображается следующими граничными мезомерными структурами:
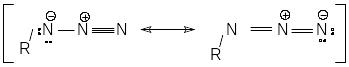
При ковалентном связывании в азидной группе присутствуют две различные –орбитали: одна делокализована между всеми атомами азота, другая – между –N- и –N-атомами. Длина связи -N--N, в среднем равная 1,25 Å, близка к длине связи –N=N- в азосоединениях, а длина связи -N--N (среднее значение 1,13 Å) - к расстоянию между атомами в молекуле азота. Значения валентных углов RNN в ковалентных азидах меняются в широком интервале от 109 0 в ClN3 до 128 0 в (CH3)3SiN3.

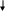 Разложение
органических азидов, включая такие ИВВ,
как циануртриазид, тринитротриазидобензол,
протекает в несколько стадий. Вначале
в результате гомолитического разрыва
связи N-N образуются нитрены в синглетном
( ) или триплетном состоянии ( ) и
молекулярный азот. Нитрены при распаде
дают конечные продукты реакции.
Разложение
органических азидов, включая такие ИВВ,
как циануртриазид, тринитротриазидобензол,
протекает в несколько стадий. Вначале
в результате гомолитического разрыва
связи N-N образуются нитрены в синглетном
( ) или триплетном состоянии ( ) и
молекулярный азот. Нитрены при распаде
дают конечные продукты реакции.
продукты реакции
Нитрены являются сильными электрофилами: они присоединяются по кратным связям С=С, C=N, СN, ароматическим связям, внедряются в простые связи C-H, N-H, O-H, димеризуются, взаимодействуют с группировками, имеющими атом с неподеленной электронной парой – нитро, карбоксильной, легко вступают в реакцию с кислородом. Результаты реакций триплетных и синглетных нитренов могут различаться, поскольку триплетные нитрены на первом этапе взаимодействия дают промежуточные радикальные частицы, рекомбинация которых приводит к стабильным продуктам. Например, окисление триплетных нитренов происходит следующим образом:
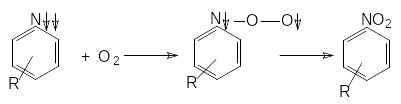
Легкость разрыва связи N-N в органических азидах в значительной степени зависит не только от электронных свойств заместителей в молекуле ИВВ, но и от стерического окружения группы N3. Объемные заместители, находящиеся в орто-положении к азидной группе, чаще всего облегчают разложение азидов. Прямой связи величины минимального заряда с теплотой взрыва или энтальпией образования органических азидов в литературе отмечено не было, что связано, возможно, с многоступенчатостью их термораспада.
К). Высокой инициирующей способностью обладают соли арилдиазония. При термораспаде они могут разлагаться как по ионному, так и по свободнорадикальному механизму. Разложение начинается с переноса электрона к диазониевой группе. При гетеролитическом распаде донором электрона является арильная часть молекулы. Строение арилкатиона, образовавшегося после элиминирования молекулы азота, отвечает частице с одним электроном на sp2-гибридной орбитали атома углерода С1 и одним электроном в -системе ядра. Арильный катион затем быстро взаимодействует с анионом окислителем, давая конечные продукты распада.
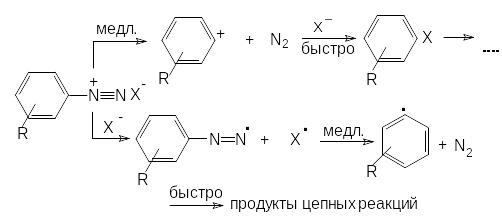
где Х = ClO4 , NO3
У солей арилдиазония с сильно акцепторными заместителями из-за выраженных окислительных свойств преобладает радикальный путь распада. Первой стадией процесса является перенос электрона с аниона кислоты к диазониевой группе. В результате образуются арилдиазенильный радикал и радикал кислотного остатка. Последний обладает значительно большей реакционной способностью по сравнению с исходным анионом. Арилдиазенильный радикал отщепляет молекулу азота и дает арильный радикал, который в результате взаимодействия с окислителем образует конечные продукты.
Считается, что реализация гетеролитического или гомолитического пути реакции зависит от окислительного потенциала донора электрона и восстановительного потенциала иона диазония. Электрон, необходимый для элиминирования азота, передается по пути, требующему наименьшей затраты энергии.
Природа аниона-окислителя влияет на величину участка перехода горения в детонацию и минимальный заряд солей диазония. Так, перхлораты обладают большей инициирующей способностью, чем соответствующие нитраты. Это связано, очевидно, с большим окислительным потенциалом перхлората по сравнению с нитратом и согласуется с точкой зрения, что лимитирующей стадией при горении является реакция окисления арильного радикала, а не распада соли диазония.
Зависимости минимального заряда от энергетических характеристик перхлоратов арилдиазония не прослеживается.
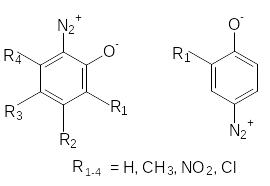
Л). Строение орто- и пара-диазофенолов (хинондиазидов) может быть описано следующими граничными формулами.
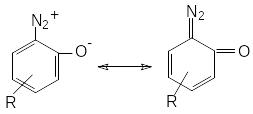
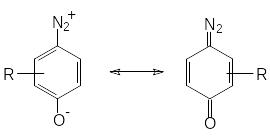
С уменьшением полярности соединения увеличивается вклад хиноидной формы в структуру хинондиазида. В ряде случаев для орто-изомеров было доказано циклическое строение оксодиазониевой группы.
При термолизе диазофенолов происходит элиминирование молекулы азота и образуются карбены.
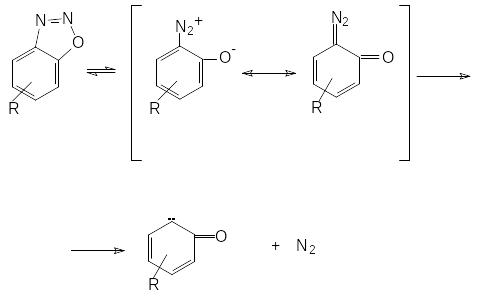
Строение карбенов может отвечать ряду триплетных и синглетных состояний, наиболее вероятен синглетный карбен. Не стабилизированные резонансом орто-диазокетоны при прочих равных условиях менее термически устойчивы, чем пара-изомеры. Диазофенолы разлагаются в одну макрокинетическую стадию. Измерение энергии термораспада методом дифференциальной сканирующей калориметрии (ДСК) показало, что при разложении орто- и пара-диазофенолов выделяется не вся энергия, заложенная в веществах, а только ее часть. Количество выделившегося тепла зависит от положения заместителей в молекуле диазофенола.
Оказалось, что результаты срабатывания этих ИВВ от механических и тепловых воздействий не коррелируют ни с теплотой разложения, найденной в условиях дифференциальной сканирующей калориметрии, ни с тепловой чувствительностью диазофенолов, оцененной по значениям температуры вспышки. Было найдено, что в веществах с меньшей реализованной в условиях ДСК теплотой разложения дефлаграция распространяется быстрее, чем в их изомерах с большим, но более медленным тепловыделением.
Поведение диазофенолов под влиянием механических или тепловых импульсов можно объяснить, предположив, что на инициирование вспышки влияют как начальная стадия термораспада, которая для всего ряда диазооксидов одинакова - это элиминирование азота, так и последующие превращения продуктов фрагментации, которые, безусловно, различаются. Следовательно, приступая к синтезу ИВВ, желательно иметь сведения о составе и реакционной способности продуктов первичной фрагментации ионов, свободных радикалов или молекул. Чаще всего таких данных в литературе нет.
Следует отметить, что существует ряд экспериментально подтвержденных предположений, связывающих характеристики ИВВ с длиной участка разгона детонации. Ни одно из них не является количественным и применимым к широкому классу ИВВ.
Для исследователей, работающих в области синтеза ИВВ, ряд наблюдений может оказать практическую помощь. Так, для синтеза ИВВ желательно, чтобы соединения имели положительную энтальпию образования, продукты первичного распада обладали высокой реакционной способностью, начальные стадии разложения были бы экзотермичными, причем количество элементарных стадий разложения должно быть минимальным. Высокий потенциал ионизации катиона металла также, очевидно, способствует сокращению длины участка перехода горения в детонацию. Эти и другие общие рекомендации, к сожалению, не являются достаточными для прогнозирования структуры ИВВ с минимальным участком разгона детонации. Они способны помочь лишь в ограничении перечня рассматриваемых соединений.
Инициирующая способность зависит от плотности заряда. Во всех изделиях и ИВВ, и БВВ применяются в запрессованном виде. Чем больше плотность заряда ИВВ, тем выше его инициирующая способность. Однако у ИВВ с выраженным участком горения существует явление «мертвой запрессовки». Например, гремучая ртуть перестает "работать" при запрессовке под давлением свыше 300 кг/см2. При соответствующей плотности заряда она воспламенится, но процесс горения в гильзе капсюля-детонатора в детонацию не перейдет, то есть детонатор не сработает. Если же взять другое штатное ИВВ - азид свинца, то предельных давлений прессования для него не существует.
Инициирующая способность зависит от степени чистоты ИВВ. Примеси увеличивают участок перехода горения в детонацию в заряде ИВВ. Следовательно, его инициирующая способность снижается, а минимальный заряд растет.
Зависимость инициирующей способности от размера кристаллов ИВВ. Было показано, что крупные кристаллы обладают лучшей инициирующей способностью, чем мелкие. Правда, они значительно чувствительнее к механическим воздействиям и поэтому опаснее.
Условия снаряжения также влияют на инициирующую способность заряда ИВВ: давление прессования, диаметр изделия, размеры гильзы, материал, из которого она изготовлена, толщина стенок гильзы и т.д. изменяют величину участка разгона детонации и, следовательно, величину минимального заряда.
В некоторых странах допускается перевозка ИВВ под слоем воды или водного этилового спирта. В нашей стране ИВВ перевозятся только в изделиях, а не в чистом виде. Заряд ИВВ для безопасности в капсюлях-детонаторах обычно помещен в чашечку с шелковой сеткой, через которую осуществляется инициирование. Сетка предупреждает высыпание ИВВ, и тем самым повышает безопасность средств инициирования при перевозке, хранении и применении. Кроме того, при несанкционированном срабатывании одного изделия тара препятствует распространению детонации на всю партию средств инициирования, что также повышает уровень безопасности перевозки.