
- •Введение
- •Глава 1. Общая характеристика инициирующих взрывчатых веществ.
- •1.1. Классификация взрывчатых веществ.
- •1.2. Важнейшие представители ивв
- •1.3. Зависимость инициирующей способности ивв от различных факторов
- •1.4. Основные требования, предъявляемые к ивв
- •Глава 2. Соли гремучей кислоты (фульминаты)
- •2.1. Гремучая кислота и ее соли
- •2.2. Свойства гремучей ртути
- •2.3. Взрывчатые свойства гремучей ртути
- •2.4. Производство гремучей ртути
- •2.4.1. Производство гремучей ртути в стеклянной аппаратуре
- •В) Получение гремучей ртути.
- •2.4.2. Получение гремучей ртути в металлической аппаратуре
- •Глава 3.
- •3.1. Открытие азотистоводородной кислоты
- •Полученный азид бензойной кислоты обрабатывали едким натром.
- •3.2. Методы получения hn3 и ее солей
- •3.3. Строение азотистоводородной кислоты
- •3.4. Свойства азотистоводородной кислоты.
- •3.5. Азиды щелочных и щелочноземельных металлов
- •3.6. Промышленные способы получения азида натрия.
- •3.6.1. Производство азида натрия из семиоксида (закиси) азота и амида натрия.
- •3.6.1.1. Производство семиоксида (закиси) азота
- •3.6.1.2. Свойства и технология получения амида натрия
- •3.6.1.3. Получение азида натрия по методу Вислиценуса.
- •3.6.2. Получение азида натрия из гидразина и этилнитрита
- •3.6.2.1. Получение и свойства гидразина
- •3.6.2.2. Технология производства азида натрия
- •3.7. Азид свинца и его физико-химические свойства
- •3.8. Химические свойства азида свинца
- •3.9. Производство азида свинца
- •3.9.1. Декстриновый азид свинца
- •3.9.2. Получение кристаллического азида свинца
- •3.9.3. Карбоксиметилцеллюлозный азид свинца.
- •3.9.4. Поливинилспиртовый азид свинца.
- •3.9.5. Английский служебный азид свинца.
- •3.9.6. Достоинства и недостатки различных видов промышленного азида свинца.
- •3.10. Другие неорганические азиды.
- •3.11. Органические азиды
- •Глава 4. Стифниновая кислота и стифнаты
- •4.1. Получение стифниновой кислоты
- •4.2. Свойства тринитрорезорцината свинца
- •4.3. Технология получения тнрСа.
- •Глава 5.
- •5.1. Соли диазония
- •5.2. Оксидиазосоединения
- •5.3. Тетразен и тетразолы.
- •5.4. Органические пероксиды
- •5.5. Ацетилениды
- •Промышленные взрывчатые вещества Часть1. Инициирующие взрывчатые вещества
3.6.1.2. Свойства и технология получения амида натрия
Амид натрия NH2 представляет собой твердое кристаллическое вещество белого цвета. Плотность монокристалла 1,39 г/см3. Температура плавления 210 оС. Температура начала возгонки 400 оС. Температура разложения 500 оС. Технический продукт имеет зеленовато-серый цвет, что объясняется наличием примеси металлического натрия. Амид натрия - очень реакционноспособный продукт. Реагирует с железом, стеклом, фарфором. Не вступает в реакцию с никелем, что используется в процессе производства.
Амид натрия используется для получения цианистого натрия, нашедшего применение в золотодобывающей промышленности, в органическом синтезе.
Амид натрия получают реакцией металлического натрия с аммиаком:
2Na + 2NH3 2NaNH2 + H2 + Q
Натрий представляет собой серебристо - белый металл, плавящийся при 97 0С. Он легко окисляется кислородом, энергично реагирует с водой. Металлический натрий должен быть высокой степени чистоты (99,9 %). Для предотвращения окисления кислородом воздуха и контакта с атмосферной влагой натрий перевозится и хранится в металлических баллонах, заполненных трансформаторным маслом.
Жидкий аммиак, содержащий не более 1% влаги, поступает на производство в металлических баллонах под давлением.
Аппарат синтеза амида натрия (2) (см. рис. 10) изготовляют из нержавеющей стали, внутреннюю поверхность тщательно полируют для уменьшения коррозии. После проведения 4 – 5 операций его заменяют.
Аппарат (2) предварительно продувают аммиаком, загружают очищенный от оксидов металлический натрий, закрывают люк и нагревают электрическим током. При температуре 340 – 350 0С начинают вводить аммиак из баллона (1). Контроль за ходом реакции осуществляют по полноте поглощения аммиака. Если содержание водорода в отходящем потоке газов снижается до 2 - 8 % и наблюдается проскок аммиака, значит процесс близок к окончанию. Время реакции на первой операции составляет 18 – 27 часов. Для сокращения времени реакции до 12 - 14 часов при последующих синтезах используют затравку в виде NaNH2, оставшегося после предыдущей реакции.
3.6.1.3. Получение азида натрия по методу Вислиценуса.
Получение азида натрия по методу Вислиценуса осуществляется, как сказано выше, путем взаимодействия амида натрия с закисью азота по схеме:
2NaNH2 + N2O NaN3 + NaOH + NH3
Синтез NaN3 проводится в аппаратуре периодического действия (см. рис. 9). Аппарат получения азида натрия (4) представляет собой цилиндр из нержавеющей стали, расположенный горизонтально. Он смонтирован на мощном перемешивающем устройстве, так как реакционная масса (NaNH2) контактирует с газовой фазой (N2O), и для прохождения реакции требуется интенсивное перемешивание. Перед началом реакции азидный аппарат промывают от продуктов, оставшихся от предыдущей реакции, просушивают, продувают аммиаком, чтобы убрать из аппарата воздух, нагревают электрическим током до 210 оС и загружают по обогреваемому трубопроводу жидкий амид натрия. Затем осуществляют подачу в аппарат (4) гемиоксида (закиси) азота из газгольдера (3). Реакцию проводят при температуре не ниже 220 оС. Контролируют температуру с помощью регулятора (5). Присутствие влаги в N2O недопустимо, поэтому его предварительно сушат в колонках с прокаленным CaCl2. Контроль за ходом реакции осуществляется по поглощению N2O и выделению NH3. В конце реакции содержание аммиака на выходе падает до 2 - 8 %. Продолжительность реакции составляет от 20 до 24 часов. По окончании процесса реакционная смесь содержит азид натрия, частично не вступивший в реакцию NaNH2, остатки закиси азота и щелочь. Для выделения целевого продукта пользуются малой растворимостью азида натрия в концентрированных растворах NaOH (52 - 58 %-ного).
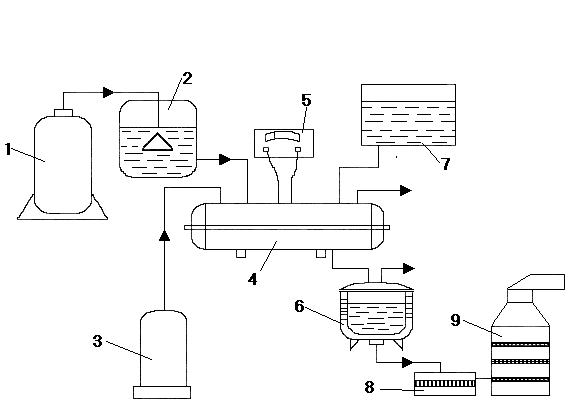
Рис.9. Схема получения азида натрия.
1 - аммиачный баллон, 2 – аппарат получения амида натря, 3 – газгольдер , 4 – реактор синтеза азида натрия, 5 – регулятор температуры, 6 – выпарной аппарат, 7 – мерник воды. 8 – вакуум-воронка, 9 – сушильный шкаф.
Операцию выделения азида натрия осуществляют следующим образом. Температуру в реакторе (4) понижают до 100 оС и из напорного бака (7) впрыскивают воду в таком количестве, чтобы вся реакционная масса растворилась. Полученный раствор сливают в выпарной аппарат (6), где удаляют избыток воды с таким расчетом, чтобы концентрация щелочи в кубе достигла 52 - 58 %. После охлаждения, суспензия азида натрия поступает на вакуум-воронку (8). Отфильтрованный азид натрия содержит щелочь, которую частично удаляют промывкой небольшим количеством холодной воды. Промытый NaN3 снимают с фильтра и отправляют на сушку в сушильный шкаф (9). Полученный таким образом товарный азид натрия содержит 92 - 98 % чистого вещества и примесь NaOH (2 - 8 %), NaHCO3, или Na2CO3, которые образуются при взаимодействии щелочи с диоксидом углерода на воздухе. Оставшуюся после реакции натриевую щелочь отправляют на стадию получения N2O для очистки ее от азотной кислоты и высших оксидов азота.
