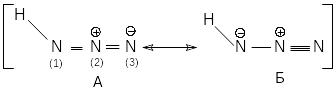- •Введение
- •Глава 1. Общая характеристика инициирующих взрывчатых веществ.
- •1.1. Классификация взрывчатых веществ.
- •1.2. Важнейшие представители ивв
- •1.3. Зависимость инициирующей способности ивв от различных факторов
- •1.4. Основные требования, предъявляемые к ивв
- •Глава 2. Соли гремучей кислоты (фульминаты)
- •2.1. Гремучая кислота и ее соли
- •2.2. Свойства гремучей ртути
- •2.3. Взрывчатые свойства гремучей ртути
- •2.4. Производство гремучей ртути
- •2.4.1. Производство гремучей ртути в стеклянной аппаратуре
- •В) Получение гремучей ртути.
- •2.4.2. Получение гремучей ртути в металлической аппаратуре
- •Глава 3.
- •3.1. Открытие азотистоводородной кислоты
- •Полученный азид бензойной кислоты обрабатывали едким натром.
- •3.2. Методы получения hn3 и ее солей
- •3.3. Строение азотистоводородной кислоты
- •3.4. Свойства азотистоводородной кислоты.
- •3.5. Азиды щелочных и щелочноземельных металлов
- •3.6. Промышленные способы получения азида натрия.
- •3.6.1. Производство азида натрия из семиоксида (закиси) азота и амида натрия.
- •3.6.1.1. Производство семиоксида (закиси) азота
- •3.6.1.2. Свойства и технология получения амида натрия
- •3.6.1.3. Получение азида натрия по методу Вислиценуса.
- •3.6.2. Получение азида натрия из гидразина и этилнитрита
- •3.6.2.1. Получение и свойства гидразина
- •3.6.2.2. Технология производства азида натрия
- •3.7. Азид свинца и его физико-химические свойства
- •3.8. Химические свойства азида свинца
- •3.9. Производство азида свинца
- •3.9.1. Декстриновый азид свинца
- •3.9.2. Получение кристаллического азида свинца
- •3.9.3. Карбоксиметилцеллюлозный азид свинца.
- •3.9.4. Поливинилспиртовый азид свинца.
- •3.9.5. Английский служебный азид свинца.
- •3.9.6. Достоинства и недостатки различных видов промышленного азида свинца.
- •3.10. Другие неорганические азиды.
- •3.11. Органические азиды
- •Глава 4. Стифниновая кислота и стифнаты
- •4.1. Получение стифниновой кислоты
- •4.2. Свойства тринитрорезорцината свинца
- •4.3. Технология получения тнрСа.
- •Глава 5.
- •5.1. Соли диазония
- •5.2. Оксидиазосоединения
- •5.3. Тетразен и тетразолы.
- •5.4. Органические пероксиды
- •5.5. Ацетилениды
- •Промышленные взрывчатые вещества Часть1. Инициирующие взрывчатые вещества
3.1. Открытие азотистоводородной кислоты
В 1890 Курциус получил азотистоводородную кислоту окисляя гидразин (NH2-NH2) азотистой кислотой по реакции, аналогичной окислению аммиака.
NH3 + HNO2 N2 + 2H2O
N2H4 + HNO2 НN3 + 2H2O
Синтез приводил к выделению НN3 с низким выходом, не превышающим 20%, поэтому в дальнейшем был разработан более удобный лабораторный метод, в котором вместо гидразина использовали гидразид бензойной кислоты.
C6H5CONHNH2 + HNO2 C6H5CON3 + 2H2O
Полученный азид бензойной кислоты обрабатывали едким натром.
C6H5CON3 + 2NaOH C6H5COONa + NaN3 + H2O
В результате щелочного гидролиза был синтезирован азид натрия, который при подкислении соляной кислотой давал азотистоводородную кислоту.
NaN3 + HCl NaCl + HN3
Выделяющаяся легколетучая азотистоводородная кислота при пропускании через раствор азотнокислого серебра образует осадок взрывчатого азида серебра:
HN3 + AgNO3 AgN3 + HNO3
Так было найдено, что HN3 является кислотой, а соли тажелых металлов азотистоводородной кислоты обладают взрывчатыми свойствами.
3.2. Методы получения hn3 и ее солей
Для получения азотистоводородной кислоты предложен ряд способов.
Во-первых, это синтезы, основанные на окислении гидразина (см. выше) или его смеси с гидроксиламином (NH2OH) различными неорганическими окислителями (HNO2, HNO3, H2O2, Cr2O72-, MnO4-)
N2H4 + NH2OH + 2O HN3 + 3H2O
Во-вторых, это окисление гидразина алкилнитритами в щелочной среде.
N2H4 + C2H5ONО + NaOH C2H5OН + NaN3 + 2H2O
В настоящее время эта реакция лежит в основе промышленного способа получения азида натрия.
Третий способ: получение азида натрия в результате щелочного гидролиза азидов органических кислот. Наиболее подробно изучена реакция с семикарбазидом профессором Л.И. Багалом. В свое время этот способ синтеза рассматривался как альтернатива существовавшим промышленным методам получения азида натрия. (Получил название метода ЛТИ).
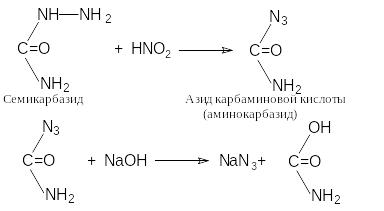
По четвертому способу азиды получаются при окислении амидов щелочных металлов. Так, амид натрия реагирует при нагревании с семиоксидом (закисью) азота, нитрат калия или аммония – с амидом калия в жидком аммиаке при нагревании в запаянной трубке:
2NaNH2 + N2O NaN3 + NaOH + NH3
(промышленный способ получения)
KNO3 + 3KNH2 KN3 + 3KOH + NH3
Выбор промышленного способа производства азида натрия в той или иной стране зависит от структуры химической промышленности и соотношения цен на сырье.
3.3. Строение азотистоводородной кислоты
Молекула азотистоводородной кислоты имеет угол связи H--N--N 114 0, расстояния -N--N и -N--N линейиой N-N-N-группы в противоположность азид-иону и азидному радикалу неодинаковы.
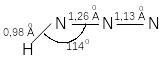
С удя
по приведенным данным, связь N(1)
– N(2)
близка к двойной (в азосоединениях длина
связи –N=N-
составляет 1,23 – 1,26 Å), а связь N(2)
– N(3)
близка к тройной связи N
= N
в молекулах N2
и N20
(1,13 Å).
удя
по приведенным данным, связь N(1)
– N(2)
близка к двойной (в азосоединениях длина
связи –N=N-
составляет 1,23 – 1,26 Å), а связь N(2)
– N(3)
близка к тройной связи N
= N
в молекулах N2
и N20
(1,13 Å).
Таким образом, строение азотистоводородной кислоты можно представить как резонансный гибрид структур А и Б.