- •И. В. Целинский, с.Ф.Мельникова теоретические основы электрофильного нитрования
- •1 Общие вопросы электрофильного нитрования
- •2 Электронное строение ароматических соединений
- •(Черным цветом обозначены отрицательные доли ао).
- •3 Эффекты заместителей в ряду ароматических углеводородов
- •4 Классификация заместителей
- •5 Стерические эффекты в электрофильном замещении
- •Нитровании толуола, близкое к структуре переходного состояния
- •6 Нитрующие системы. Минеральные кислоты
- •6.1 Нитрование в концентрированной и разбавленной водной азотной кислоте.
- •6.1.1 Состояние концентрированной hno3.
- •6.1.2 Состояние водных растворов hno3
- •6.1.3 Состояние азотной кислоты в растворах серной кислоты
- •6.2 Функции кислотности и развитие теории нитрования
- •7 Другие кислотные нитрующие смеси
- •7.1 Трансферное нитрование
- •7.2 Нитрование смесями hno3 с фторсульфоновой и трифторметансульфоновой кислотами
- •7.3 Нитрование на сульфированных полимерных смолах
- •7.4 Нитрование солями нитрония
- •7.4.1 Строение и реакционная способность нитроний-иона
- •8 Кинетика и механизм нитрования ароматических соединений
- •Ароматического замещения
- •8.1 Переходное состояние и селективность электрофильного ароматического замещения
- •8.2 Кинетика нитрования в гомогенных условиях
- •8.3 Кинетика нитрования в гетерогенных условиях
- •9 Ориентация электрофильного замещения и реакционная способность замещенных бензолов
- •9.1 Изомерные σ-комплексы. Ипсо-нитрование
- •Процесс носит название «деалкилирующего нитрования»
- •9.2 Ориентация как отражение свойств σ-комплекса
- •9.3 Факторы парциальных скоростей. Факторы селективности
- •9.4 Ориентация при наличии в кольце нескольких заместителей
- •9.5 Влияние сольватации и комплексообразования на региоселек- тивность нитрования
- •10 Нитрование через нитрозирование и побочные процессы при нитровании аренов
- •10.1 Нитрование через нитрозирование
- •Влияние азотистой кислоты на нитрование аренов нитроний-
- •10.3 Побочные процессы, сопровождающие нитрование
- •11 Нитрование оксидами азота
- •11.1 Нитрование азотным ангидридом
- •11.2 Нитрование тетраоксидом диазота, n2o4
- •Процессы одноэлектронного переноса в электрофильном ароматическом нитровании. Нитрование, катализируемое азотистой кислотой
- •Цеолитные и алюмосиликатные катализаторы.
- •12.2 Металлоксидные катализаторы
- •Катализаторы на основе твердых носителей, модифицирован- ных кислотами
- •Нитрование в ионных жидкостях
- •13 Особенности нитрования различных аренов
- •13.2 Динитронафталин и другие нитропроизводные нафталина
- •13.3 Нитропроизводные хлорбензола
- •13.5 Нитропроизводные ароматических аминов
- •Текст лекций Теоретические основы электрофильного нитрования
6.2 Функции кислотности и развитие теории нитрования
Для константы равновесия ионизации катионной кислоты ВН+ (связанной с константой основности сопряженного основания КВ уравнением
рКВ=14-рКВН+) в термодинамической шкале (т) справедливо ур-ние (6.2.1)

где αН+ - активность протонов, fB и fBH+ -соответственно, коэффициенты активности основания В и его протонированной формы ВН+, в квадратных скобках - концентрации компонентов.
Рассчитать коэффициенты активности ионов по уравнению Дебая-Хюккеля* можно до концентрации около 0.1 моль/л, что соответствует рН среды примерно 1.
Кислотность соединений ВН+, сопряженные основания которых в заметной степени не протонированы при таком значении рН, измерить обычными способами (потенциометрически или спектрофотометрически в буферных растворах) невозможно. Чтобы избежать трудностей, связанных с определением или расчетом переменных коэффициентов активности fB и fBH+, Гамметом в 1932 г было постулировано, что в серии сходных по структуре оснований отношение fB /fBH+ не зависит от их природы, а определяется только свойствами среды. Для характеристики протонирующей способности среды по отношению к определенному классу оснований Гамметом была предложена функция кислотности Но (ур-ние 6.2.2):
![]()
Эта функция является продолжением шкалы рН в сильно кислых средах.
______________________________________________________________
*И.В.Целинский, И.В.Шугалей. Кислотно-основные свойства органических соединений азота / Текст лекций. Санкт-Петербург, СПбГТИ (ТУ), ИК “Синтез”, 2006
И з
ур-ния (6.2.1), в логарифмической форме
имеющем вид (6.2.3)
з
ур-ния (6.2.1), в логарифмической форме
имеющем вид (6.2.3)
и ур-ния (6.2.2) следует, что

Это уравнение используется для определения констант основности слабых органических оснований.
Для вывода функции Но Гамметом была выбрана опорная серия замещенных нитроанилинов в качестве кислотно-основных индикаторов.
В зависимости от природы и количества заместителей в бензольном ядре (в основном это атомы галогенов и нитрогруппы) эти основания с постоянным реакционным центром – первичной аминогруппой – позволили оценить кислотность минеральных кислот в очень широкой области Но (10-11 лог.ед). Так, значение рКВН+ 4-нитроанилина (рис.10, прямая 1) измерили спектрофотометрическим способом в разбавленных растворах кислот, где действует шкала рН, это значение составляет 0.99. Затем было измерено ионизационное отношение [BH+]/[B]=I этого индикатора в более концентрированной серной кислоте.
Поскольку величина I может быть достаточно точно измерена спектрофотометрически лишь в области от 10-2 до 102, при помощи 4-нитроанилина как индикатора функция кислотности Но была выведена для концентраций H2SO4 вплоть до 24%. В этой же области концентраций (9-24% H2SO4) удалось измерить ионизационное отношение для следующего по основности индикатора – 2-нитроанилина (см. табл.5).
Таблица 5 - Значения рКВН+ нитроанилинов RNH2 в водных растворах
серной кислоты
№ п/п |
R
|
рКВН+ |
№ п/п |
R
|
рКВН+ |
1 |
4-NO2С6Н4 |
0.99 |
7 |
2,4-(NO2)2 С6Н3 |
-4.53 |
2 |
2- NO2 С6Н4 |
-0.29 |
8 |
2,6-(NO2)2 С6Н3 |
-5.54 |
3 |
4-Cl-2-NO2 С6Н3 |
-1.03 |
9 |
2-Br-4,6-(NO2)2 С6Н2 |
-6.68 |
4 |
2,5-Cl2-4-NO2 С6Н2 |
-1.78 |
10 |
3-CH3-2,4,6-(NO2)3 С6Н |
-8.22 |
5 |
2-Cl-6-NO2 С6Н3 |
-2.43 |
11 |
3-Br-2,4,6-(NO2)3 С6Н |
-9.46 |
6 |
2,6-Cl2-4-NO2 С6Н2 |
-3.27 |
12 |
2,4,6-(NO2)3 С6Н2 |
-10.10 |
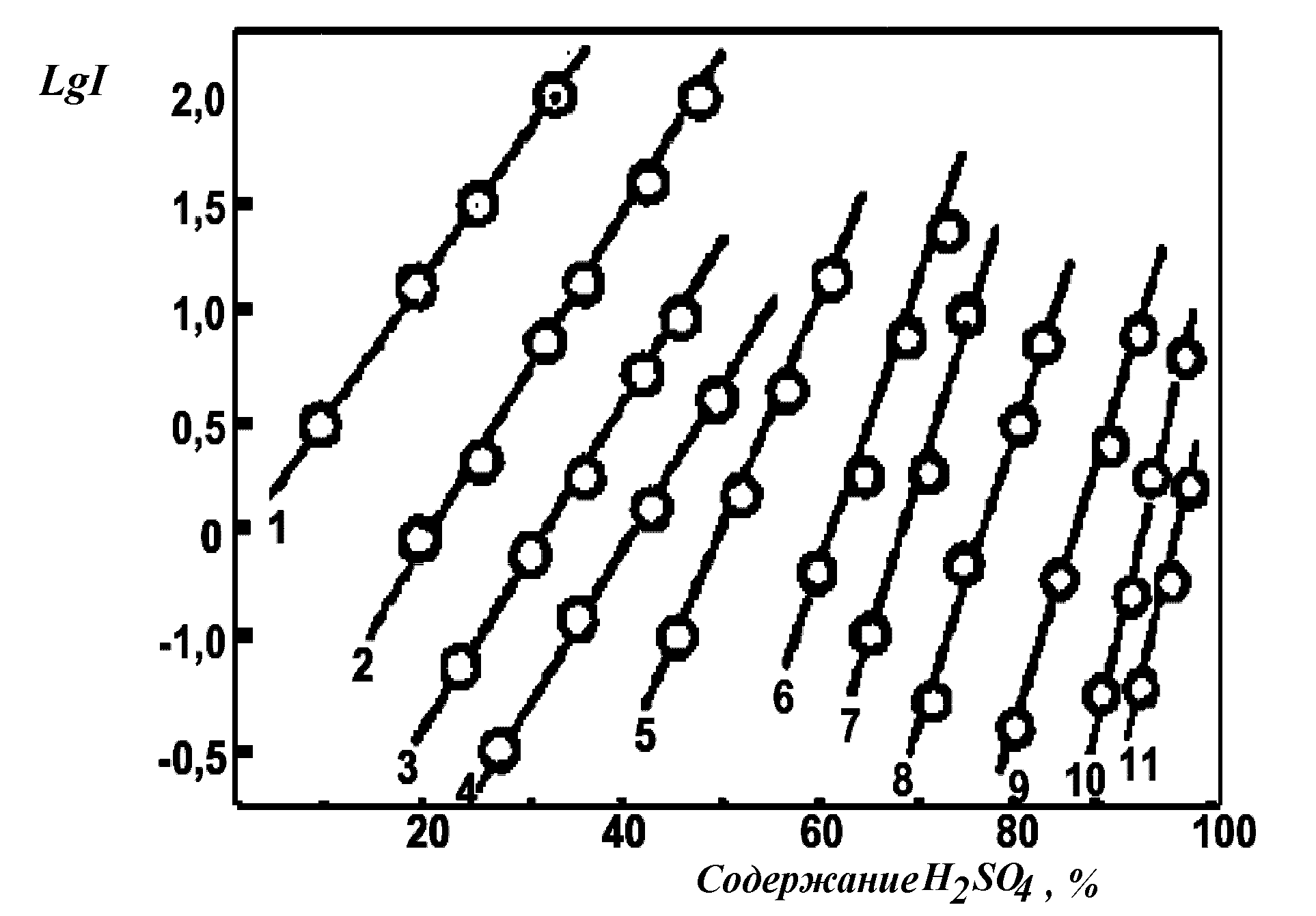
Риунок 10. Значения логарифмов ионизационного отношения
нитроанилинов в водной серной кислоте.
(Нумерация как в табл.5).
Если постулат Гаммета выполняется, то

Проверка показала, что эта разность для соединений 1 и 2 сохраняется примерно постоянной (1.24-1.31) во всей области перекрывания величин lg I (рис.10), что позволило установить величину рКВН+ 2-нитроанилина (-0.29).
Далее на основании этой величины были определены таким же методом значения Но для области 24-35% H2SO4 и найдено значение рКВН+ следующего по основности индикатора – 2-нитро-4-хлоранилина (-1.03).
Подобная операция перекрывания повторялась для широкого ряда индикаторов - нитро- и галогеннитроанилинов, значения рКВН+ которых приведены в табл. 5.
Согласно ур-нию (6.2.4) зависимость логарифма ионизационного отношения от функции Но является линейной, с угловым коэффициентом, равным единице. Однако некоторые слабые основания (триарилкарбинолы, амиды карбоновых кислот и т.д.) не подчиняются этому уравнению. Это обусловлено различиями в эффектах сольватации протонированных форм и сопряженных оснований по сравнению с Гамметовскими индикаторами, что влияет на их коэффициенты активности. Для таких оснований были выведены другие функции кислотности. Например, функция HR применима для измерения основности триарилкарбинолов (RC6H4)3C-OH, которые являются вторичными основаниями, т.к. их протонированная форма (RC6H4)3C-OH2+ отщепляет молекулу воды, превращаясь в триарилкарбониевый ион (RC6H4)3C+. Равновесие протонизации триарилкарбинолов описывается уравнением (6.2.6):
![]() (RC6H4)3C-OH
+ H+
(RC6H4)3C+
+ H2O
(6.2.6)
(RC6H4)3C-OH
+ H+
(RC6H4)3C+
+ H2O
(6.2.6)
Д ля
этого равновесия по аналогии с ур.
(6.2.2) получаем:
ля
этого равновесия по аналогии с ур.
(6.2.2) получаем:
Значение функции кислотности
|
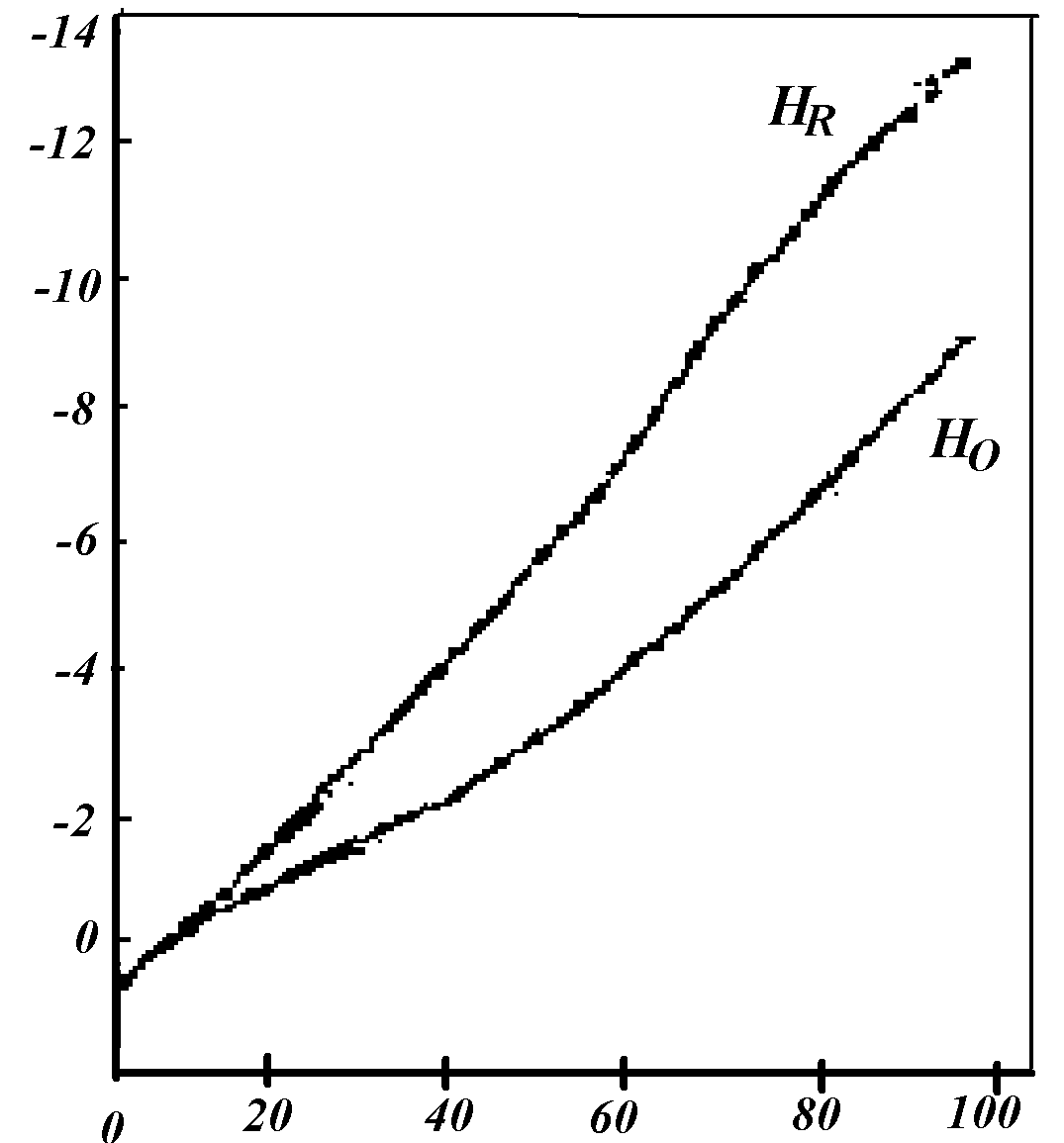
Рисунок 11. Значения функций кислотности Hо и НR растворов серной кислоты
Содержание H2SO4, %
|
Азотная кислота в среде H2SO4 тоже представляет собой вторичное основание; протонирование ее сопровождается отщеплением молекулы воды (ур-ние 6.2.9):
![]() (6.2.9)
(6.2.9)
Поэтому для описания ее основности должна быть применима функция HR. Так, в шкале Ho величина рК NO2+ = -8.74±0.25, а в шкале HR -17.1±0.1, что соответствует полупревращению HNO3 в NO2+ в 88%-ной H2SO4. Эффективная бимолекулярная константа скорости нитрования аренов в смесях HNO3/H2SO4 (ур-ние 6.2.10)
RC6H5
+ HNO3
![]() RC6H4NO2
+ H2O
(6.2.10)
RC6H4NO2
+ H2O
(6.2.10)
подчиняется функции HR, а не Ho, о чем свидетельствует линейная зависимость dlgk2/d[H2SO4] от функции –dHR/d[H2SO4] с угловым коэффициентом, равным единице.
Это говорит о том, что нитрующим агентом является нитроний-ион, а не H2NO3+, и позволяет из ур-ния (6.2.8) определить его значение pKNO2+. В этих кислотных смесях эффективная константа скорости нитрования второго порядка уменьшается в 104 раз при уменьшении концентрации серной кислоты на 10%.