
- •И. В. Целинский, с.Ф.Мельникова теоретические основы электрофильного нитрования
- •1 Общие вопросы электрофильного нитрования
- •2 Электронное строение ароматических соединений
- •(Черным цветом обозначены отрицательные доли ао).
- •3 Эффекты заместителей в ряду ароматических углеводородов
- •4 Классификация заместителей
- •5 Стерические эффекты в электрофильном замещении
- •Нитровании толуола, близкое к структуре переходного состояния
- •6 Нитрующие системы. Минеральные кислоты
- •6.1 Нитрование в концентрированной и разбавленной водной азотной кислоте.
- •6.1.1 Состояние концентрированной hno3.
- •6.1.2 Состояние водных растворов hno3
- •6.1.3 Состояние азотной кислоты в растворах серной кислоты
- •6.2 Функции кислотности и развитие теории нитрования
- •7 Другие кислотные нитрующие смеси
- •7.1 Трансферное нитрование
- •7.2 Нитрование смесями hno3 с фторсульфоновой и трифторметансульфоновой кислотами
- •7.3 Нитрование на сульфированных полимерных смолах
- •7.4 Нитрование солями нитрония
- •7.4.1 Строение и реакционная способность нитроний-иона
- •8 Кинетика и механизм нитрования ароматических соединений
- •Ароматического замещения
- •8.1 Переходное состояние и селективность электрофильного ароматического замещения
- •8.2 Кинетика нитрования в гомогенных условиях
- •8.3 Кинетика нитрования в гетерогенных условиях
- •9 Ориентация электрофильного замещения и реакционная способность замещенных бензолов
- •9.1 Изомерные σ-комплексы. Ипсо-нитрование
- •Процесс носит название «деалкилирующего нитрования»
- •9.2 Ориентация как отражение свойств σ-комплекса
- •9.3 Факторы парциальных скоростей. Факторы селективности
- •9.4 Ориентация при наличии в кольце нескольких заместителей
- •9.5 Влияние сольватации и комплексообразования на региоселек- тивность нитрования
- •10 Нитрование через нитрозирование и побочные процессы при нитровании аренов
- •10.1 Нитрование через нитрозирование
- •Влияние азотистой кислоты на нитрование аренов нитроний-
- •10.3 Побочные процессы, сопровождающие нитрование
- •11 Нитрование оксидами азота
- •11.1 Нитрование азотным ангидридом
- •11.2 Нитрование тетраоксидом диазота, n2o4
- •Процессы одноэлектронного переноса в электрофильном ароматическом нитровании. Нитрование, катализируемое азотистой кислотой
- •Цеолитные и алюмосиликатные катализаторы.
- •12.2 Металлоксидные катализаторы
- •Катализаторы на основе твердых носителей, модифицирован- ных кислотами
- •Нитрование в ионных жидкостях
- •13 Особенности нитрования различных аренов
- •13.2 Динитронафталин и другие нитропроизводные нафталина
- •13.3 Нитропроизводные хлорбензола
- •13.5 Нитропроизводные ароматических аминов
- •Текст лекций Теоретические основы электрофильного нитрования
2 Электронное строение ароматических соединений
П ервый
ароматический углеводород – бензол
был выделен Майклом Фарадеем в 1825 г из
конденсата осветительного газа. В 1833 г
Митчерлих впервые синтезировал чистый
бензол и установил его брутто-формулу
С6Н6. Термин «ароматический»
возник потому, что многие производные
бензола – спирты, альдегиды, простые и
сложные эфиры, содержащие
радикал фенил (С6Н5), были
выделены из ладана, ароматических масел
и бальзамов (затвердевшей смолы хвойных
деревьев). Немецкий химик Кекуле предложил
для бензола формулу гексагонального
1,3,5-циклогексатриена:
ервый
ароматический углеводород – бензол
был выделен Майклом Фарадеем в 1825 г из
конденсата осветительного газа. В 1833 г
Митчерлих впервые синтезировал чистый
бензол и установил его брутто-формулу
С6Н6. Термин «ароматический»
возник потому, что многие производные
бензола – спирты, альдегиды, простые и
сложные эфиры, содержащие
радикал фенил (С6Н5), были
выделены из ладана, ароматических масел
и бальзамов (затвердевшей смолы хвойных
деревьев). Немецкий химик Кекуле предложил
для бензола формулу гексагонального
1,3,5-циклогексатриена:
В этой формуле все атомы углерода и водорода эквивалентны.
Эта формула объясняет существование трех дизамещенных производных толуола орто-(1,2-), мета- (1,3-) и пара- (1,4-) (схема 1.6):

Схема 1.6
Однако химические свойства бензола
(трудность присоединения по кратным
связям, окисления и т.д.) кардинально
отличают его от гипотетического
1,3,5-циклогексатриена. Поэтому
формула Кекуле, хотя и удобна для
написания, не отражает истинную
структуру бензола, в которой все
связи С-С и С-Н одинаковы и отсутствует
альтернирование (чередование) простых
и двойных связей. Молекула бензола
представляет собой плоский
правильный шестиугольник с длиной
связей С![]() С
1.397Å и валентными углами 1200С.
С
1.397Å и валентными углами 1200С.
Все атомы углерода находятся в плоском
тригональном (sp2)
состоянии гибридизации, где
σ-связи С-С , формирующие каркас молекулы,
образованы гибридными sp2
орбиталями с аксиальным (осевым)
перекрыванием ( рис.1).
рис.1).

Рисунок 1. Остов молекулы бензола. Рисунок 2. Боковое перекрывание
Заштрихованы области аксиального р-орбиталей бензола
перекрывания гибридных sp2 –орбиталей
Такие же гибридные sp2-орбитали образуют σ-связи с атомами водорода, которые используют для связи сферически симметричные орбитали 1s. Этот низколежащий по уровню энергии каркас обычно не затрагивается в реакциях ароматических соединений и служит лишь проводником электронных эффектов заместителей, например, индукционного эффекта (см. ниже). На более высоких уровнях энергии располагается сопряженная π-электронная система, образованная чистыми р-орбиталями с боковым (латеральным) перекрыванием (рис.2).
 Оси этих орбиталей перпендикулярны
плоскости цикла и образуют замкнутое
(кольцевое) электронное облако,
подобное ореолу (нимбу) над и под
плоскостью остова молекулы.
Образующийся при этом секстет
Оси этих орбиталей перпендикулярны
плоскости цикла и образуют замкнутое
(кольцевое) электронное облако,
подобное ореолу (нимбу) над и под
плоскостью остова молекулы.
Образующийся при этом секстет
π-электронов обуславливает особые свойства и стабильность бензола
(рис.2а). Поскольку энергия π-связей С-С (обычно
250 кДж/моль) существенно меньше, чем σ-связей
(~350 кДж/моль), именно эти связи обычно затраги-
Рисунок 2а ваются в реакциях ароматических соединений.
Электронное строение ароматических соединений и их реакционная способность адекватно описываются в рамках теории молекулярных орбиталей (МО), которую в простейшем приближении (метод молекулярных орбиталей Хюккеля, МОХ) можно представить следующим образом: электрон помещается в многоцентровое поле положительного заряда всех ядер данной молекулы и рассматриваются различные квантовые энергетические уровни для такой системы, которую по аналогии с атомными орбиталями (АО) называют молекулярными орбиталями (МО). Каждая МО способна принять до 2 электронов (с антипараллельными спинами).
Сначала заполняются более низкие по энергии МО, а затем – более высокие. В конкретных приложениях теории МО эти орбитали (или соответствующие волновые функции) рассматриваются в качестве линейных комбинаций атомных орбиталей (метод МО-ЛКАО).
В образовании одной МО могут участвовать несколько АО. Существуют одноцентровые, двухцентровые и т.д. МО. МО подразделяются на связыва-
ющие, несвязывающие и разрыхляющие. Помещение электронов (одного или двух) на связывающую МО приводит к энергетической стабилизации системы, на несвязывающую – к неизменности энергетического состояния, а на разрыхляющую - к энергетической дестабилизации системы, если за нулевой уровень принять энергию совокупности изолированных АО.
Одноцентровая МО называется несвязывающей. Двухцентровые МО соответствуют перекрыванию двух соседних АО, что приводит к появлению двух новых МО, одна из которых расположена ниже уровня для изолированных атомов, а другая – выше. Первая МО называется связывающей, а вторая – разрыхляющей. Подводя к связывающей двуцентровой МО новую валентную АО (или МО), получают опять две новые многоцентровые МО и т.д. В частности, для бензола, согласно теории МО-ЛКАО, шесть атомных р-орбиталей атомов углерода комбинируются с образованием шести молекулярных π-орбиталей, из которых три являются связывающими, а три – разрыхляющими.
В методе МО-ЛКАО в простейшем случае двухэлектронной связи между одинаковыми атомами молекулярная волновая функция Ψ запишется как
Ψ= с1χ1 ± с2 χ2 ,
где χ1 и χ2 –атомные волновые функции (атомные орбитали), с1 и с2 –нормировочные коэффициенты (в данном случае из условий симметрии молекулы следует, что с1 = с2, и по условиям нормировки 2сi2 =1.
![]() Квадрат коэффициента сi
характеризует вероятность
нахождения электрона в поле
i-го атома, а
суммарная вероятность нахождения двух
электронов в поле двух ядер равна
единице.
Квадрат коэффициента сi
характеризует вероятность
нахождения электрона в поле
i-го атома, а
суммарная вероятность нахождения двух
электронов в поле двух ядер равна
единице.
Отсюда с1 = с2 =
и две МО как симметричная и антисимметричная
комбинации АО (ΨS и
ΨА ) будут иметь вид:
две МО как симметричная и антисимметричная
комбинации АО (ΨS и
ΨА ) будут иметь вид:
Энергии этих состояний молекулы обозначаются, соответственно, как ЕS и ЕA.
Энергии МО включают т.н. матричные элементы Н11=Н22=α; Н12=Н21=β и S12=S21=S, величина которых зависит от межъядерного расстояния.
α носит название кулоновского интеграла, т.к. в терминах квантовой механики он выражает классическое кулоновское взаимодействие частиц. Он включает энергию электрона в изолированном атоме (в простейшем случае – атоме водорода), кулоновское отталкивание ядер и энергию кулоновского взаимодействия второго ядра с электронным облаком, окружающем первое ядро. На расстояниях вблизи равновесных этот интеграл отрицателен и в нулевом приближении принимается равным энергии электрона в атоме.
β называется резонансным (или обменным) интегралом, который описывает то добавочное понижение энергии, которое возникает из-за возможности перехода электрона от ядра А к ядру В молекулы АВ, возможности движения в поле двух ядер, как бы «обменивая» при этом ядра, обменивая χ1 и χ2. Энергия, выражаемая интегралом β, не имеет аналога в классической физике. Его вклад определяет энергию химической связи А-В; чем он больше по абсолютной величине, тем прочнее связь. На равновесном межъядерном расстоянии энергия диссоциации связи приближенно равна – β.
S –интеграл перекрывания, он служит мерой перекрывания атомных орбиталей (АО), образующих МО. Он равен единице при RАВ =0 (где R –расстояние между ядрами) и спадает до нуля при увеличении R. На обычных межъядерных расстояниях в молекуле β тем больше по абсолютной величине, чем больше S. Поэтому принято считать, что чем больше перекрываются АО, образующие МО, тем прочнее связь. Приближенное решение уравнения Шредингера для двухатомной молекулы дает следующие величины энергии двух МО: ES=(α +β)/(1+s) и EА=(α -β)/(1-s).
В нулевом приближении величиной S можно пренебречь по сравнению с единицей, и тогда энергия ковалентной связи (в которой оба ядра владеют электронами в равной мере) будет включать вклады только кулоновского и резонансного интегралов: ES = α +β и EА= α –β.
В соответствии с уравнениями квантовой механики и вышеприведенным изложением атомные волновые функции (выражаемые через радиусы атомных орбит Бора и расстояния электронов от обоих ядер) должны иметь одинаковый знак в области перекрывания, т.е. для π-связи этилена это можно выразить следующим образом:

Рисунок 3. π-МО молекулы этилена
Если соединить пунктирной линией доли АО с одинаковым знаком, функция ΨА обращается в нуль посредине σ-связи С-С молекулы этилена, т.е. π-связь отсутствует. Эта точка называется узловой. Нижняя связывающая МО, как правило, не имеет узловых точек (т.е. является полносвязывающей МО).
При изучении молекул, содержащих более одной кратной связи, например диенов с двумя соседними связями С=С (I), было показано, что они более стабильны, чем соединения, в которых эти связи изолированы, например 1,4-пентадиен (II):
СН2=СН-СН=СН2 СН2=СН-СН2-СН=СН2
1,3-бутандиен (I) 1,4-пентандиен (II)
В соединениях I и II боковое перекрывание р-орбиталей соседних атомов углерода могло бы привести к образованию двух локализованных π-связей, таких же, как у этилена, только удвоенных. Действительно, соединение II обнаруживает сходство с этиленом по химическим свойствам, однако соединение I отличается от него. Это происходит потому, что здесь боковое перекрывание может осуществляться между всеми четырьмя р-орбиталями соседних атомов углерода. Такое перекрывание приводит к образованию четырех МО - двух связывающих (Ψ1 и Ψ2) и двух разрыхляющих (Ψ3 и Ψ4) (схема 2.1):

Схема 2.1
В олновые
функции четырех МО бутадиена описываются
уравнениями:
олновые
функции четырех МО бутадиена описываются
уравнениями:

Рисунок 4. Энергии МО этилена и бутадиена
Как видно из рис. 4, при расположении 4 электронов на двух связывающих МО суммарная энергия бутадиена ниже, чем удвоенная π-электронная энергия этилена (соответственно, 4α +4.48β и 4α +4β). Электроны в бутадиене становятся делокализованными и принадлежат всей сопряженной системе. При этом существенная плотность π-электронного облака находится между 2-ым и 3-им атомами углерода, формально на простой
σ-связи, что придает ей характер частично двойной (порядок связей С1-С2 и С3-С4 равен 1.894, а С2-С3 – 1.447). Длина связи С2-С3 составляет 1.46 Å вместо 1.54Å для ординарной связи.
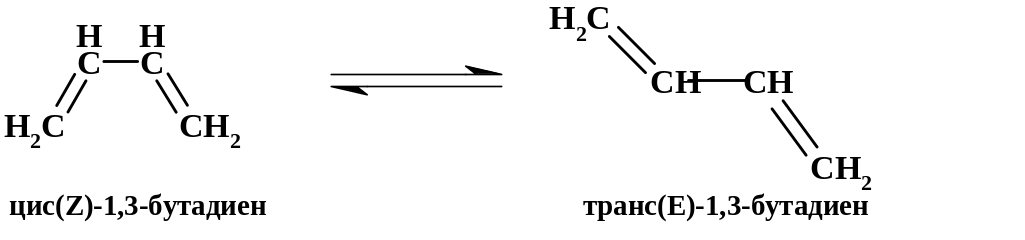
Энергия стабилизации сопряженного диена относительно невелика (0.48 β, или 8.6 ккал/моль), но все же существенно влияет на его свойства, например, существует определенный энергетический барьер цис-транс-изомеризации: ΔНвр = 42 ккал/моль.
Переходя к рассмотрению электронного строения молекулы бензола, в соответствии с методом МО-ЛКАО можно полагать, что шесть атомных р-орбиталей атомов углерода комбинируются с образованием 6 молекулярных π-орбиталей, из которых 3 являются связывающими, а 3 – разрыхляющими.
Связывающая МО π1 с самой низкой энергией (НЗМО) не имеет узлов и охватывает все 6 атомов углерода (кольцевой нимб над и под плоскостью цикла). За ней следуют 2 вырожденные (т.е. имеющие одинаковую энергию) МО π2 и π3, каждая из которых имеет по одному узлу.
Т.к. в бензоле имеется 6 р-электронов, то каждая из 3-х связывающих МО занята двумя электронами с антипараллельными спинами. Остальные три МО бензола π4, π5 и π6 –разрыхляющие орбитали, вакантные в основном состоянии бензола.
Суммарная π-электронная энергия бензола равна 2(α +2β)+ 4(α +β) =
6α + 8β. Для 1,3,5-циклогексатриена с локализованными, не взаимодействующими между собой π-связями общая энергия 6 π-электронов должна быть (6α +6β). Разность этих энергий (2β или 36 ккал/моль) отражает эффект делокализации π-электронов в бензоле и поэтому называется энергией делокализации. Длина связей в бензоле 1.397Å - средняя между простой (1.54 Å) и двойной (1.33 Å) связями.

Рисунок 5. Молекулярные орбитали молекулы бензола.
