
- •И. В. Целинский, с.Ф.Мельникова теоретические основы электрофильного нитрования
- •1 Общие вопросы электрофильного нитрования
- •2 Электронное строение ароматических соединений
- •(Черным цветом обозначены отрицательные доли ао).
- •3 Эффекты заместителей в ряду ароматических углеводородов
- •4 Классификация заместителей
- •5 Стерические эффекты в электрофильном замещении
- •Нитровании толуола, близкое к структуре переходного состояния
- •6 Нитрующие системы. Минеральные кислоты
- •6.1 Нитрование в концентрированной и разбавленной водной азотной кислоте.
- •6.1.1 Состояние концентрированной hno3.
- •6.1.2 Состояние водных растворов hno3
- •6.1.3 Состояние азотной кислоты в растворах серной кислоты
- •6.2 Функции кислотности и развитие теории нитрования
- •7 Другие кислотные нитрующие смеси
- •7.1 Трансферное нитрование
- •7.2 Нитрование смесями hno3 с фторсульфоновой и трифторметансульфоновой кислотами
- •7.3 Нитрование на сульфированных полимерных смолах
- •7.4 Нитрование солями нитрония
- •7.4.1 Строение и реакционная способность нитроний-иона
- •8 Кинетика и механизм нитрования ароматических соединений
- •Ароматического замещения
- •8.1 Переходное состояние и селективность электрофильного ароматического замещения
- •8.2 Кинетика нитрования в гомогенных условиях
- •8.3 Кинетика нитрования в гетерогенных условиях
- •9 Ориентация электрофильного замещения и реакционная способность замещенных бензолов
- •9.1 Изомерные σ-комплексы. Ипсо-нитрование
- •Процесс носит название «деалкилирующего нитрования»
- •9.2 Ориентация как отражение свойств σ-комплекса
- •9.3 Факторы парциальных скоростей. Факторы селективности
- •9.4 Ориентация при наличии в кольце нескольких заместителей
- •9.5 Влияние сольватации и комплексообразования на региоселек- тивность нитрования
- •10 Нитрование через нитрозирование и побочные процессы при нитровании аренов
- •10.1 Нитрование через нитрозирование
- •Влияние азотистой кислоты на нитрование аренов нитроний-
- •10.3 Побочные процессы, сопровождающие нитрование
- •11 Нитрование оксидами азота
- •11.1 Нитрование азотным ангидридом
- •11.2 Нитрование тетраоксидом диазота, n2o4
- •Процессы одноэлектронного переноса в электрофильном ароматическом нитровании. Нитрование, катализируемое азотистой кислотой
- •Цеолитные и алюмосиликатные катализаторы.
- •12.2 Металлоксидные катализаторы
- •Катализаторы на основе твердых носителей, модифицирован- ных кислотами
- •Нитрование в ионных жидкостях
- •13 Особенности нитрования различных аренов
- •13.2 Динитронафталин и другие нитропроизводные нафталина
- •13.3 Нитропроизводные хлорбензола
- •13.5 Нитропроизводные ароматических аминов
- •Текст лекций Теоретические основы электрофильного нитрования
11.2 Нитрование тетраоксидом диазота, n2o4
N2O4 является смешанным ангидридом азотной и азотистой кислот и способен диссоциировать как гомолитически при нагревании в неполярных средах (см. схему 10.3.4), так и гетеролитически в ионизирующих растворителях и сильных минеральных кислотах (схема 11.2.1):
O2N-NO2 NO+ + NO3¯
N2O4 + 3H2SO4 NO2+ + NO+ + H3O+ + 3HSO4¯
Схема 11.2.1
Нитрозоний-ион как слабый электрофильный агент способен взаимодействовать лишь с сильно активированными аренами (фенолами, анизолом, анилинами, мезитиленом, нафталином и т.д.) давая нитрозосоединения, способные окисляться далее до нитросоединений (см. раздел 10.1- нитрование через нитрозирование, стр. 77).
 Однако добавление сильных кислот, таких
как H2SO4
или BF3, превращает
нитрат-ион в NO2+,
способный нитровать и дезактивированные
арены (схема 11.2.2):
Однако добавление сильных кислот, таких
как H2SO4
или BF3, превращает
нитрат-ион в NO2+,
способный нитровать и дезактивированные
арены (схема 11.2.2):
Схема 11.2.2
При гомолитической диссоциации N2O4 путем термического или фотохимического (облучение УФ-светом) инициирования возможно протекание радикального замещения (см. раздел 10.3, стр. 80). Предпринимались попытки повысить нитрующую активность оксидов азота в среде органических растворителей введением кислорода или озона в нитрующую систему. При этом диоксид азота окисляется до радикала NO3•, обладающего высокой электрофильностью (т.н. Киодай-нитрование, детально изученное японскими авторами под руководством Сузуки (схема 11.2.3):
NO2• + O3→ NO3• +O2
Схема 11.2.3
При этом в мягких условиях (-10оС, 3 ч) достигается мононитрование алкилбензолов с высокими выходами (65-99%). Распределение изомеров алкилнитробензолов здесь примерно такое же, как при нитровании нитроний-ионом (для R-CH3 орто- : мета-: пара- = 57:2:41). В противоположность этому, свободнорадикальное нитрование толуола диоксидом азота дает смесь фенилнитрометана, бензальдегида и изомерных нитротолуолов в соотношении о-:м-:п- =37:38:25, т.е. региоселективность нитрования весьма низка. Предполагается, что нитрование радикалом триоксида азота, NO3•, протекает как окислительно-восстановительный процесс (SET) (схема 11.2.4):

Схема 11.2.4
При этом орто- и пара-нитропроизводные образуются с участием промежуточных σ-комплексов Уэланда, что объясняет региоселективность реакции. В случае трудноокисляемых аренов реакция может протекать через промежуточный азотный ангидрид (схема 11.2.5)
![]() NO3•+NO2•
N2O5
NO3•+NO2•
N2O5
![]() NO2+
+ HNO3
NO2+
+ HNO3
Схема 11.2.5
Свободнорадикальной процесс начинается, по-видимому, с отщепления атома водорода от алкильной группы (схема 11.2.6):
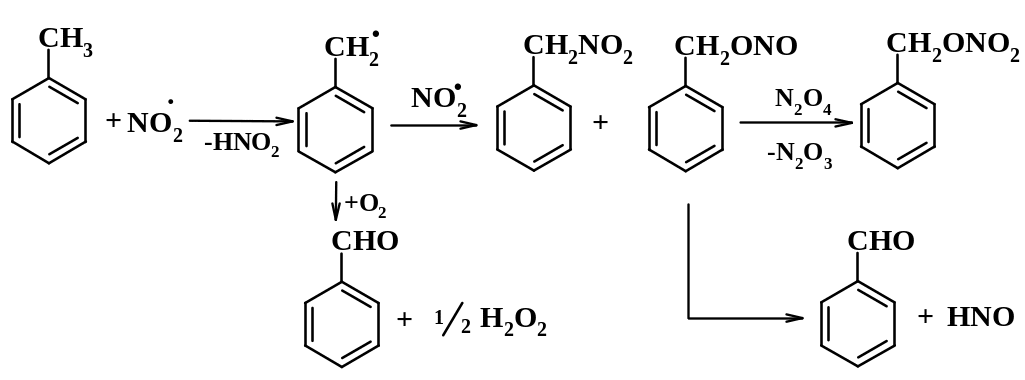
Схема 11.2.6
Параллельно протекает свободнорадикальное замещение в ароматическом ядре (см. схему 10.3.4, стр. 81).
Процессы одноэлектронного переноса в электрофильном ароматическом нитровании. Нитрование, катализируемое азотистой кислотой
Классический механизм электрофильного нитрования по Ингольду предусматривает наличие переходного состояния на координате реакции между π- и σ- комплексами (ПС-2 на рис.13, стр.50) (схема 12.1):

Схема 12.1
Возникает вопрос о возможности переноса электрона в π-комплексе или переходном состоянии с образованием ион-радикальной пары
[ArH![]() NO2•] и
дальнейшего образования продукта
нитрования.
NO2•] и
дальнейшего образования продукта
нитрования.
Действительно, в случае активных аренов (фенолы, анизол, анилины, мезитилен, нафталин и алкилнафталины) удалось зафиксировать образование свободных радикалов, но остается неясным, является ли это стадией основного или побочного процесса. Для проверки этой гипотезы электрохимическим окислением был получен катион-радикал 1,4-диметилнафталина и введен в реакцию с диоксидом азота. Если процесс протекает по радикальному механизму, то соотношение изомеров 1,4-диметилнитронафталинов должно быть близким к таковому в радикальном нитровании 1,4-диметилнафталина (92% нитрования по метильной группе).
Однако при электрохимически генерированном катион-радикале 1,4-динитронафталина основным продуктом был 2-нитроизомер, тогда как в классическом электрофильном нитровании 1,4-диметилнафталина основным продуктом является 5-нитроизомер. Следовательно, одноэлектронный перенос не реализуется в классическом нитровании нафталина и, вероятно, большинства других аренов.
 В последние десятилетия опубликовано
много работ по каталитическому нитрованию
аренов, в частности, толуола. В конце
30-х годов XX века А.И.Титов
изучал катализируемое оксидами
азота нитрование активированных
аренов (фенолы, анилины). Титов
считал, что промежуточными продуктами
являются нитрозосоединения, которые
окисляются азотной кислотой до
нитросоединений. Однако позднее было
показано, что реакция каталитического
нитрования часто протекает в условиях,
где нитрозосоединения
не образуются, либо когда нитрозосоединение
не может быть окислено до нитросоединения.
Исследование методами ЭПР и ХПЯ 15N
позволило зафиксировать появление
в процессе радикальных частиц и предложить
схему нитрования с участием катион-радикалов
(схема 12.2):
В последние десятилетия опубликовано
много работ по каталитическому нитрованию
аренов, в частности, толуола. В конце
30-х годов XX века А.И.Титов
изучал катализируемое оксидами
азота нитрование активированных
аренов (фенолы, анилины). Титов
считал, что промежуточными продуктами
являются нитрозосоединения, которые
окисляются азотной кислотой до
нитросоединений. Однако позднее было
показано, что реакция каталитического
нитрования часто протекает в условиях,
где нитрозосоединения
не образуются, либо когда нитрозосоединение
не может быть окислено до нитросоединения.
Исследование методами ЭПР и ХПЯ 15N
позволило зафиксировать появление
в процессе радикальных частиц и предложить
схему нитрования с участием катион-радикалов
(схема 12.2):
Схема 12.2
Однако ввиду высокого окислительно-восстановительного потенциала толуола (2.25-2.61 В) можно полагать, что образование катион-радикалов наблюдается в побочных, а не в основном процессе. В то же время в случае более активного мезитилена возможно нитрование через катион-радикал.
Широко исследовалось в последние десятилетия газофазное нитрование аренов оксидами азота, разбавленной азотной кислотой и алкилнитратами на твердофазных катализаторах. Мак-Ки установил, что силикагель катализирует нитрование бензола оксидами азота до нитробензола при высокой температуре (310оС). Катализ обусловлен наличием кислотных центров на поверхности катализатора, которые превращают оксиды азота в нитроний-ион.
Нитрование над катализатором может резко изменить позиционную селективность вследствие закрепления нитрующего агента и нитруемого субстрата в определенном положении на поверхности или в порах катализатора. Скорость нитрования увеличивается с повышением кислотности среды, поэтому нужно использовать катализаторы с максимальной кислотностью. Их можно разделить на три группы:
1.синтетические и природные цеолиты и алюмосиликаты
2.оксиды переходных металлов IV и VI групп таблицы Менделеева
3. пористые твердые носители, пропитанные сильными неорганическими кислотами (чаще всего H2SO4).
