
- •И. В. Целинский, с.Ф.Мельникова теоретические основы электрофильного нитрования
- •1 Общие вопросы электрофильного нитрования
- •2 Электронное строение ароматических соединений
- •(Черным цветом обозначены отрицательные доли ао).
- •3 Эффекты заместителей в ряду ароматических углеводородов
- •4 Классификация заместителей
- •5 Стерические эффекты в электрофильном замещении
- •Нитровании толуола, близкое к структуре переходного состояния
- •6 Нитрующие системы. Минеральные кислоты
- •6.1 Нитрование в концентрированной и разбавленной водной азотной кислоте.
- •6.1.1 Состояние концентрированной hno3.
- •6.1.2 Состояние водных растворов hno3
- •6.1.3 Состояние азотной кислоты в растворах серной кислоты
- •6.2 Функции кислотности и развитие теории нитрования
- •7 Другие кислотные нитрующие смеси
- •7.1 Трансферное нитрование
- •7.2 Нитрование смесями hno3 с фторсульфоновой и трифторметансульфоновой кислотами
- •7.3 Нитрование на сульфированных полимерных смолах
- •7.4 Нитрование солями нитрония
- •7.4.1 Строение и реакционная способность нитроний-иона
- •8 Кинетика и механизм нитрования ароматических соединений
- •Ароматического замещения
- •8.1 Переходное состояние и селективность электрофильного ароматического замещения
- •8.2 Кинетика нитрования в гомогенных условиях
- •8.3 Кинетика нитрования в гетерогенных условиях
- •9 Ориентация электрофильного замещения и реакционная способность замещенных бензолов
- •9.1 Изомерные σ-комплексы. Ипсо-нитрование
- •Процесс носит название «деалкилирующего нитрования»
- •9.2 Ориентация как отражение свойств σ-комплекса
- •9.3 Факторы парциальных скоростей. Факторы селективности
- •9.4 Ориентация при наличии в кольце нескольких заместителей
- •9.5 Влияние сольватации и комплексообразования на региоселек- тивность нитрования
- •10 Нитрование через нитрозирование и побочные процессы при нитровании аренов
- •10.1 Нитрование через нитрозирование
- •Влияние азотистой кислоты на нитрование аренов нитроний-
- •10.3 Побочные процессы, сопровождающие нитрование
- •11 Нитрование оксидами азота
- •11.1 Нитрование азотным ангидридом
- •11.2 Нитрование тетраоксидом диазота, n2o4
- •Процессы одноэлектронного переноса в электрофильном ароматическом нитровании. Нитрование, катализируемое азотистой кислотой
- •Цеолитные и алюмосиликатные катализаторы.
- •12.2 Металлоксидные катализаторы
- •Катализаторы на основе твердых носителей, модифицирован- ных кислотами
- •Нитрование в ионных жидкостях
- •13 Особенности нитрования различных аренов
- •13.2 Динитронафталин и другие нитропроизводные нафталина
- •13.3 Нитропроизводные хлорбензола
- •13.5 Нитропроизводные ароматических аминов
- •Текст лекций Теоретические основы электрофильного нитрования
7.4.1 Строение и реакционная способность нитроний-иона
![]() В статическом состоянии нитроний-ион
имеет линейную структуру
В статическом состоянии нитроний-ион
имеет линейную структуру
с длиной связи N=O 1.10-1.15Å и является аналогом диоксида углерода, кетена и других молекул с кумулированными кратными связями.
Центральный атом азота находится в линейном состоянии гибридизации (sp) и не имеет вакантной орбитали (в отличие от иона аммония). Следовательно, нитроний-ион сам по себе может фигурировать только как поляризуемый электрофильный реагент. «Реакционноспособный» нитроний-ион должен быть несколько изогнут (т.е. атом азота, по крайней мере частично, регибридизирован от sp до sp2 состояния, что приводит к образованию вакантной орбитали на азоте.
П оложительный
заряд нитроний-иона помогает ему
приблизиться к нуклеофильному субстрату
(ароматическому углеводороду, Nu),
который затем путем взаимодействия
своей ВЗМО с катионом NO2+
будет поляризовать π-связь N=O,
что делает возможным протекание реакции
:
оложительный
заряд нитроний-иона помогает ему
приблизиться к нуклеофильному субстрату
(ароматическому углеводороду, Nu),
который затем путем взаимодействия
своей ВЗМО с катионом NO2+
будет поляризовать π-связь N=O,
что делает возможным протекание реакции
:
8 Кинетика и механизм нитрования ароматических соединений
К настоящему времени в результате
многочисленных исследований однозначно
установлено, что электрофильное замещение
в ароматических соединениях начинается
с образования т.н. π-комплекса, в котором
электрофильный реагент связывается
со всем π-электронным секстетом
ароматического ядра. π-Комплексы
с нитроний-ионом экспериментально
не были зафиксированы, но аналогичные
комплексы с другими электрофильными
реагентами, такими как DCl
или Br2, изучены
достаточно хорошо. Эти комплексы
не проводят электрический ток, т.к. не
являются ионными частицами. В
комплексах с DCl не
происходит обмена водорода на дейтерий.
Как известно, арены являются π-основаниями,
способными образовывать
донорно-акцепторные комплексы с любыми
электрофильными реагентами, в том числе
с кислотами Льюиса. Кристаллы комплексов
бензола с Cl2 или
Br2, согласно
рентгеноструктурным данным, состоят
из цепочек чередующихся
молекул π-донора (C6H6) и
акцептора (Cl2, Br2),
в которых молекулы галогена
расположены перпендикулярно плоскости
кольца вдоль оси, проходящей через
его центр симметрии (схема 8.1):
настоящему времени в результате
многочисленных исследований однозначно
установлено, что электрофильное замещение
в ароматических соединениях начинается
с образования т.н. π-комплекса, в котором
электрофильный реагент связывается
со всем π-электронным секстетом
ароматического ядра. π-Комплексы
с нитроний-ионом экспериментально
не были зафиксированы, но аналогичные
комплексы с другими электрофильными
реагентами, такими как DCl
или Br2, изучены
достаточно хорошо. Эти комплексы
не проводят электрический ток, т.к. не
являются ионными частицами. В
комплексах с DCl не
происходит обмена водорода на дейтерий.
Как известно, арены являются π-основаниями,
способными образовывать
донорно-акцепторные комплексы с любыми
электрофильными реагентами, в том числе
с кислотами Льюиса. Кристаллы комплексов
бензола с Cl2 или
Br2, согласно
рентгеноструктурным данным, состоят
из цепочек чередующихся
молекул π-донора (C6H6) и
акцептора (Cl2, Br2),
в которых молекулы галогена
расположены перпендикулярно плоскости
кольца вдоль оси, проходящей через
его центр симметрии (схема 8.1):
Схема 8.1
Возможно, так же построен и π-комплекс с NO2+. Константы устойчивости π-комплексов слабо зависят от природы ароматического субстрата. При добавлении кислоты Льюиса (например, AlCl3) в раствор DCl в бензоле или алкилбензолах он окрашивается в желтый или оранжево-красный цвет и начинает проводить электрический ток, что указывает на образование ионов. В них происходит дейтерообмен. Строение этих комплексов было доказано с помощью спектроскопии ЯМР и соответствует структуре аренониевого иона (или σ-комплекса).
Устойчивость σ-комплексов сильно зависит от числа и природы заместителей в бензольном ядре. Она увеличивается при усилении +I и +M-эффектов заместителей. В таких комплексах электрофильный реагент связан ковалентной связью с определенным атомом цикла, который переходит из плоского тригонального состояния гибридизации (sp2) в тетраэдрическое (sp3) (схема 8.2):

Схема 8.2
Вместо трех предельных резонансных структур σ-комплексы часто изображают в виде одной структуры с делокализованными по 5 атомам углерода π-связями, обозначенными пунктиром (см. ниже).
Таким образом, обобщенную схему электрофильного ароматического нитрования можно представить следующим образом (схема 8.3):
 где
Х-
противоион
нитрония; B:
-присутствующее в нитрующей среде
основание, которое отщепляет протон от
π2-комплекса
(H2O,
O2NO-,
HSO4-
).
где
Х-
противоион
нитрония; B:
-присутствующее в нитрующей среде
основание, которое отщепляет протон от
π2-комплекса
(H2O,
O2NO-,
HSO4-
).
Схема 8.3
На диаграмме изображены два π-комплекса - один (π1) на координате реакции располагается до σ-комплекса, а второй (π2)- после σ-комплекса. Обычно комплекс π2 весьма слабый и не учитывается при анализе меха- низма процесса.
Как показывает изучение кинетики нитрования, наиболее медленной стадией является образование σ -комплекса и лишь в случае очень активных нитрующих агентов (таких, как соли нитрония) и ароматических соединений с донорными заместителями лимитирующей (т.е. наиболее медленной) стадией может быть образование π1-комплекса.
Последняя стадия – отрыв протона от σ -комплекса – обычно является быстрой и необратимой, на что указывает отсутствие кинетического изотопного эффекта (КИЭ).
Однако введение очень объемистых групп с обеих сторон от отщепляемого протона может сильно замедлить эту стадию и привести в появлению КИЭ, например, в случае 1,3,5-три(трет-бутил)бензола и 3,5-ди(трет-бутил )-
толуола (KH/KD=3.7-3.8).*
____________________________________________________________
*Природа и проявления кинетического изотопного эффекта описаны в тексте лекций И.В.Целинского, И.В.Шугалей, С.Ф.Мельниковой «Кинетика реакций нитросоединений», СПбГТИ(ТУ), 2010, С.43
Идеализированный профиль кривой потенциальной энергии реакций
ароматического электрофильного замещения выглядит следующим образом (рис.13)
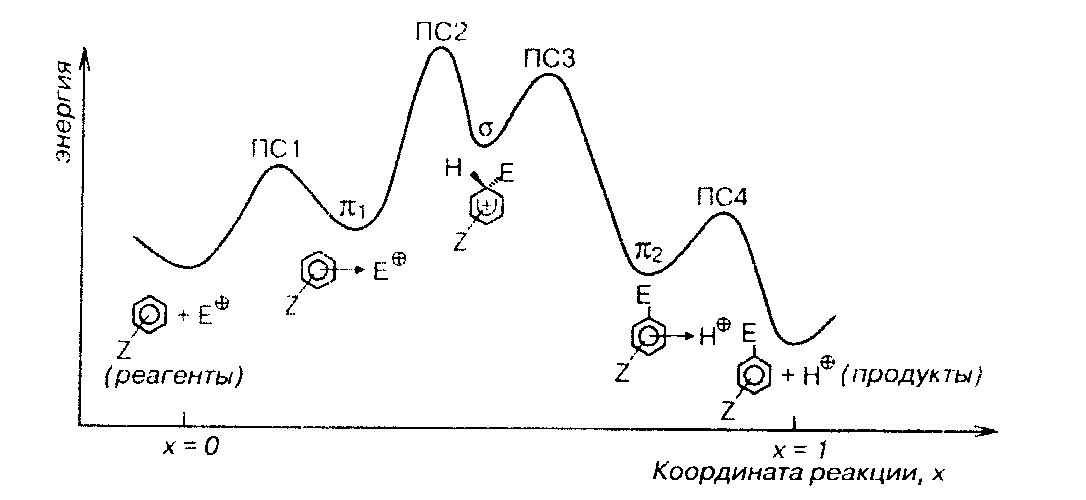
Рисунок 13.Профиль кривой потенциальной энергии электрофильного нитрования
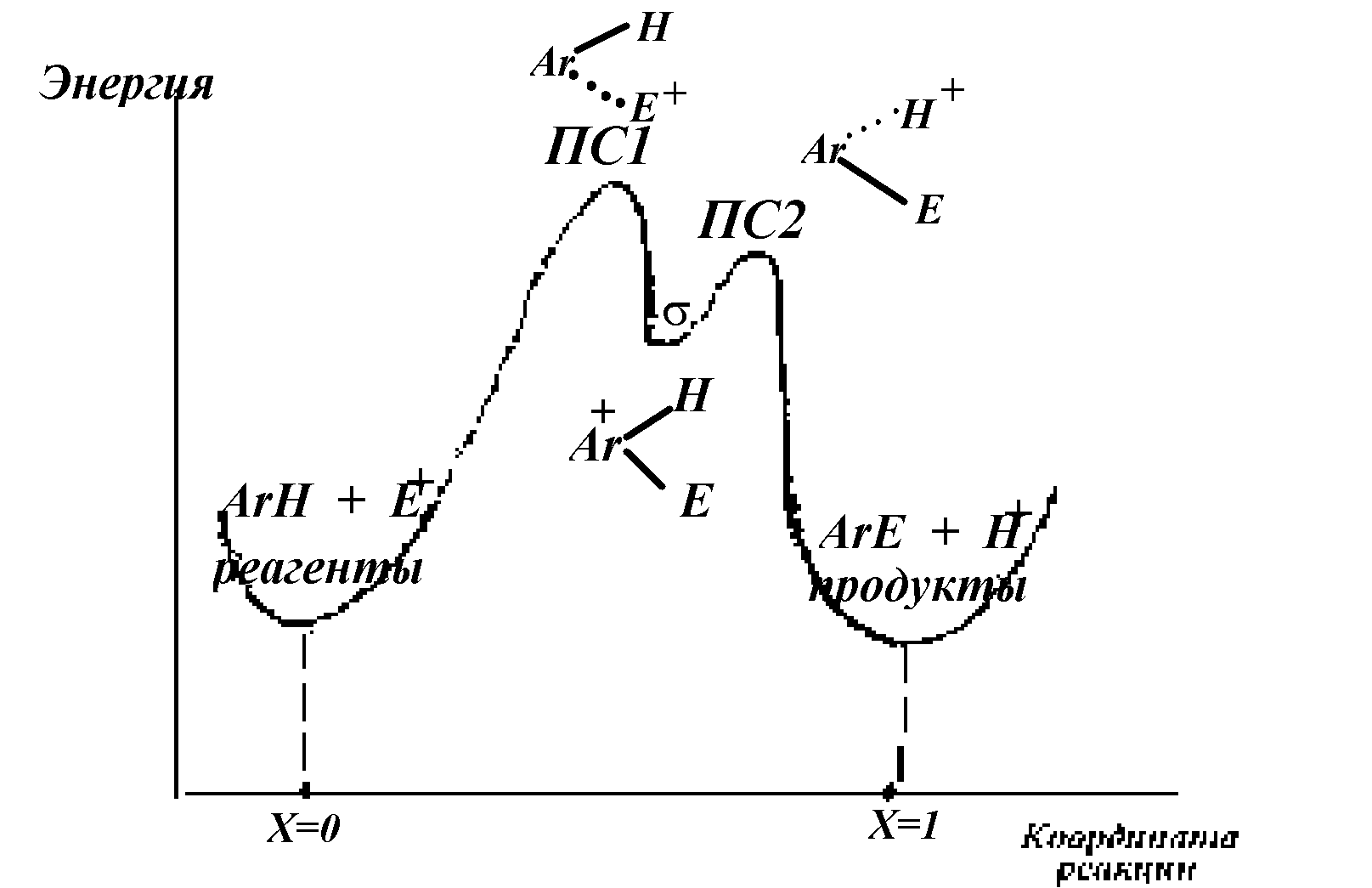
Рисунок 14. Упрощенный
профиль кривой потенци-
альной энергии реакции электрофильного нитрования
В принципе можно адекватно описать реакцию, если из этой диаграммы исключить π-комплексы и рассматривать лишь положение σ-комплексов на координате реакции (рис.14).
Согласно постулату Хэммонда переходное состояние может быть «ранним» или «поздним», т.е. находиться на координате реакции вблизи Х=0 или Х=1, соответственно.
Экзотермические реакции (т.е. идущие «с горы») характеризуются ранним ПС, а эндотермические (идущие «в гору») - поздним. Раннее ПС по структуре и энергии напоминает реагенты, а позднее – σ-комплекс. Таким образом, для реакции с ранним ПС влияние заместителей на скорость должно быть гораздо более слабым, чем с поздним, т.к. σ-комплекс несет максимальный положительный заряд, а исходный арен электрически нейтрален. Раннее и позднее ПС можно изобразить так (рис.15):

Рисунок 15 Раннее и позднее переходные состояния в реакции электрофильного
