
- •Кафедра «Биотехнологии»
- •Методические указания по самостоятельной работе студентов
- •Содержание
- •Введение
- •Раздел №1. Цитология тема 1. Микропрепараты. Красители
- •Тема 2. Общий план строения клеток эукариот
- •Клетка - наименьшая единица живого
- •Сходство клеток разных организмов по строению
- •Размножение клеток путем деления исходной клетки
- •Клетки как части целостного организма
- •Тема 3. Мембранная система клетки
- •Тема 4. Митоз
- •Профаза
- •Метафаза
- •Анафаза
- •Телофаза
- •Цитокинез
- •Раздел №2. Общая гистология тема 5. Гистогенез. Осевые зачатки органов
- •Гистогенез. Понятия детерминации, коммитирования и дифференцировки
- •Тема 6. Эпителиальные ткани. Классификация желез
- •Железистые эпителии
- •Позвоночных животных и человека
- •Тема 7. Кровь
- •Тема 8. Гемоцитопоэз
- •Тема 9. Ткани внутренней среды
- •Тема 10. Мышечная ткань
- •Поперечнополосатые (исчерченные) мышечные ткани
- •Гладкие (неисчерченные) мышечные ткани
- •Тема 11. Нервная ткань
- •Методическая литература для самостоятельной работы
Раздел №1. Цитология тема 1. Микропрепараты. Красители
Гистологию, как науку о развитии, строении и жизнедеятельности тканей живых организмов, делят на три основных раздела:
цитологию, или учение о клетке;
общую гистологию, или собственно учение о тканях;
частную гистологию, или учение о микроскопическом строении органов, их клеточном и тканевом составе.
Такое разделение является условным и искусственным и проводится для облегчения изучения гистологических структур сложных организмов. В действительности, организм представляет собой единое целое, в котором все взаимосвязано и взаимообусловлено. Клетки существуют в составе тканей, изучение тканей трудно отделить от органов, т.к. структура последних в значительной степени определяется взаимосвязью тканей в том или ином органе.
Гистология как наука о тканях зародилась задолго до создания микроскопа. Микроскопический период начинается с середины XVII в., когда английским физиком Р.Гуком был усовершенствован микроскоп, что позволило ему увидеть впервые в растениях ячейки, названные им клетками.
Во второй половине XVII в. многим ученым удалось с помощью микроскопа увидеть мельчайшие живые существа и впервые описать структуры организма, до той поры неизвестные. Например, Марчелло Мальпиги описал строение кожи, селезенки, почки и некоторых других органов. Антоний Левенгук создал микроскоп, позволяющий увеличить изображение объекта до 300 раз, описал красные кровяные тельца и их движение в капиллярах, спермии, поперечнополосатые мышцы, нервные, сухожильные волокна.
Этап успешного развития гистологии (конец XVIII - начало XIX вв.) связан со значительным усовершенствованием микроскопа, особенно русскими учеными - М.В.Ломоносовым, Л.Эйлером, Ф.Эпинус. Это этап систематического изучения самых разнообразных объектов растительного и животного мира. В этот период чешский ученый Я.Пуркинье описал ядро в яйцеклетке курицы, а затем ядра в клетках различных тканей животных. Броун описал ядра в растительных организмах. Накапливался материал о тонком строении органов и тканей, что побуждало к обобщениям, вскрытию закономерностей в их строении и развитии. Теодор Шванн в 1839г. обобщил весь накопленный материал и создал клеточную теорию, явившуюся величайшим открытием в биологии, которое показало, что все растения и животные имеют единый план строения и развития.
С середины XIX в. начался период описательной гистологии. Изучался состав различных органов и тканей, их гистогенез, что позволило уже тогда создать в основных чертах современную микроскопическую анатомию животных. Лейдт и Келликер создали классификацию тканей (4 типа) и показали, что все органы построены из сочетания этого ограниченного количества тканей. Происходит совершенствование гистологических методов исследования (подбор фиксаторов, создание микротома) и выделение цитологии как науки. Но, несмотря на усовершенствование цитологических и гистологических методик, объектом исследования по-прежнему является фиксированный и окрашенный гистологический препарат.
Необходимое условие для микропрепаратов – они должны быть прозрачны и контрастны. Классификация микропрепаратов и основные этапы их изготовления приведены на рисунке 1.
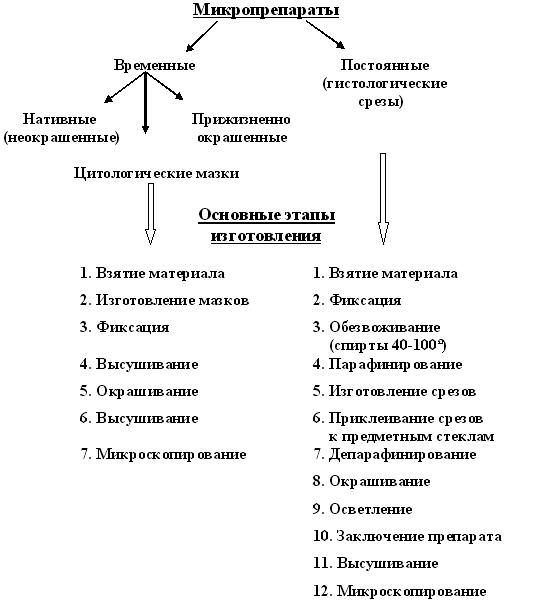
Рис. 1. Классификация микропрепаратов и основные этапы их изготовления
Нативные микропрепараты недостаточно контрастны и недолговечны. Постоянные микропрепараты лишены этих недостатков и представляют собой срез ткани, заключенный между двумя стеклами – предметным и покровным. Гистологические срезы могут использоваться длительное время, подвергаются исследованию многократно, не изменяются при длительном хранении.
Цитологические мазки состоят из биологического материала, нанесенного на предметное стекло. Несмотря на то, что все временные микропрепараты, как неокрашенные, так и прижизненно окрашенные, быстро приходят в негодность, они широко используются для изучения живых клеток, органов, тканей.
Прижизненное окрашивание – окрашивание живых клеток витальными красителями в диапазоне концентраций, не вызывающих токсического эффекта, широко используется в цитологии и гистологии. По своему химическому строению витальные красители относятся к органическим соединениям ароматического ряда. Они представляют собой электролиты, которые могут быть разделены на кислотные и основные. Большинство из них являются индикаторными, что позволяет их применять для определения концентрации водородных ионов.
Многие витальные красители могут легко переходить из окисленной формы в восстановленную и обратно. Это используют для определения уровня окислительно-восстановительных процессов в клетке. При окрашивании клеток витальные красители проникают в клетку, собираются в цитоплазме в виде гранул, ядро при этом не окрашивается.
Большая часть сведений о клетке была получена на стабильном фиксированном материале. Задачи фиксации – убить клетку, прекратить активность внутриклеточных ферментов, предотвратить распад клеточных компонентов, избежать потери структур и веществ, препятствовать появлению артефактных структур.
Химическая фиксация заключается в быстрой обработке ткани растворами с целью сохранить структуру убитых клеток по возможности неизменными. Леофилизация ткани, при которой происходит быстрое замораживание ткани при температуре жидкого азота, затем высушивание в вакууме, позволяет избежать многих недостатков химической фиксации, обеспечивает мгновенную остановку всех процессов жизнедеятельности.
Окрашивание позволяет выявить большинство клеточных органоидов и структур. Применяют натуральные и синтетические красители. Натуральные красители употребляют в сочетании с протравами (окислы различных металлов), с которыми они образуют комплексные соединения. Синтетические красители бывают кислые и основные. В зависимости от этого они могут окрашивать различные участки клеток в разные цвета и тем самым повышать контрастность клеточных и внеклеточных компонентов. Наиболее часто используемые красители – эозин, гематоксилин, азур, метиленовый синий, бриллиантовая зелень, фуксин.
В среднем на окрашивание одного препарата требуется 40 минут. Качество окраски элементов клеточных структур зависит от:
1) вида и состава красителя;
2) концентрации красителя, которая не всегда определяет красящую способность;
3) продолжительности окраски;
4) возраста окрашиваемого препарата. Препараты от 6 часов и до нескольких дней давности в большинстве случаев теряют мелкие структуpные тонкости;
5) pH среды оказывает сильное влияние на окрашиваемость и тон окраски.
Не обнаружено никаких различий окрашиваемости от температуры холодильника до комнатной температуры.
При правильном проведении окраски мазков наблюдается окрашивание клеточных элементов мазка. Так, гематоксилин окрашивает ядра всех клеток в сине-фиолетовый цвет, от светлого до темного, почти черного. Эталоном правильной окраски служат ядра лейкоцитов, в этом случае в них видна тонкая сеть хроматина. Бриллиантовая зелень окрашивают цитоплазму клеток, обладающую базофилией. Так, цитоплазма молодых клеток цилиндрического, кубического, плоского эпителия, альвеолярных макрофагов, лейкоцитов окрашивается в зеленый цвет, от светлого зеленовато-голубого до интенсивного изумрудного. Эозин окрашивает оксифильную цитоплазму клеток, от светло-розового до интенсивного розового.
Имеется ряд специфических приемов окрашивания, с помощью которых можно определить специфические химические вещества: белки, нуклеиновые кислоты, полисахариды, липиды, аминокислоты и т. д. Это цитохимические методы. Существует целая группа цитохимических реакций, связанная с обнаружением ферментов.
