
- •Содержание
- •Введение
- •1 Основные понятия и законы химии
- •1.1 Основные понятия химии
- •1.2 Основные законы химии
- •2 Основные классы неорганических соединений
- •2.1 Простые вещества
- •2.2 Сложные вещества
- •3 Растворы
- •3.1 Общие свойства растворов
- •3.1.2 Способы выражения состава растворов
- •3.1.3 Физико-химические процессы образования растворов
- •3.1.4 Экстракция
- •3.2 Растворы неэлектролитов
- •3.2.1 Законы Рауля
- •3.2.2 Осмос
- •3.3 Растворы электролитов
- •3.3.1 Электролитическая диссоциация
- •3.3.2 Сильные и слабые электролиты
- •3.4 PH водных растворов
- •4 Ионно-обменные реакции
- •4.1 Необратимые ионно-обменные реакции
- •4.2 Обратимые ионно-обменные реакции
- •5 Гидролиз солей
- •5.1 Различные случаи гидролиза
- •2) Гидролиз соли образованной сильным основанием и слабой кислотой
- •3) Гидролиз соли образованной слабым основанием и слабой кислотой
- •5.2 Константа гидролиза
- •5.3 Смещение равновесия при гидролизе
- •6. Окислительно-восстановительные реакции
- •6.1 Составление уравнений окислительно-восстановительных реакций
- •6.2 Прогнозирование окислительно-восстановительных свойств веществ по степеням окисления элементов
- •6.3 Основные типы окислительно-восстановительных реакций
- •6.4 Взаимодействие металлов с водой, кислотами и щелочами
- •7 Гальванические элементы
- •7.1 Принцип работы гальванического элемента
- •7.2 Водородный электрод сравнения. Электрохимический ряд
- •8 Электролиз
- •8.1 Электролиз расплавов
- •8.2 Электролиз водных растворов
- •8.3 Количественные расчёты в электролизе
- •8.4 Химические источники электрической энергии
- •9 Коррозия металлов
- •9.1 Виды и типы коррозии
- •9.2 Способы защиты металлов от коррозии
- •9.2.1 Изолирование металлов от внешней среды
- •9.2.2 Изменение состава коррозионной среды
- •9.2.3 Рациональное конструирование
- •9.2.4 Электрохимические способы защиты от коррозии
- •10 Термодинамика
- •10.1 Внутренняя энергия и энтальпия. Закон Гесса
- •Или через промежуточный продукт (со) в две реакции:
- •10.2 Энтропия
- •10.3 Энергия Гиббса
- •11 Химическая кинетика Химическая кинетика – учение о скоростях и механизмах протекания химических реакций.
- •11.1 Скорость реакции
- •Основные факторы, влияющие на скорость реакции:
- •12 Строение атома
- •12.1 История развития учения о строении атома
- •12.1.1 Модель атома по Резерфорду
- •12.1.2 Модель атома по Бору
- •12.2 Современные представления о строении атома
- •13 Периодический закон и периодическая таблица д.И. Менделеева
- •14 Химическая связь и строение молекул
- •14.1 Химическая связь
- •14.1.1 Квантово-механическое описание модели молекулы водорода
- •14.1.2 Основные характеристики химической связи
- •Валентный угол – это угол между двумя химическими связями. Он отражает геометрию молекулы.
- •14.1.3 Типы химических связей Ковалентная связь – это связь между двумя атомами за счет образования общей электронной пары.
- •14.2 Состав и строение молекул
- •15 Типы кристаллических решеток
- •16.1 Общая характеристика s-элементов первой и второй групп
- •16.2 Свойства воды
- •16.2.1 Строение молекулы воды
- •16.2.2 Физические свойства воды
- •16.2.3 Химические свойства воды
- •16.3 Жесткость воды
- •18 Комплексные соединения
- •18.1 Состав комплексных соединений
- •18.2 Реакции с участием комплексных соединений
- •19.8.1 Элементы триады железа
- •19.8.2 Платиновые металлы
- •20 Органические соединения
- •20.1 Углеводороды
- •20.2 Кислородсодержащие соединения
- •20.3 Амины и аминокислоты
- •21 Полимеры
- •21.1 Классификации полимеров
- •21.2 Полимеризационные полимеры
- •21.3 Поликонденсационные полимеры
- •21.4 Структура и состояние полимеров
- •22 Рабочие вещества низкотемпературной техники
- •22.2 Хладагенты органического происхождения
- •Список использованных источников
5.2 Константа гидролиза
Гидролиз солей протекает обратимо. Поэтому для процесса гидролиза, как и для любого равновесного процесса, можно записать выражение константы равновесия (Кр).
Например, для гидролиза ацетата натрия:
СН3СОО– + Н+ОН– ↔ СН3СООН + ОН–,
Кр
=
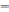

 .
.
В
полученном выражении [НОН]
можно перенесли влево. После умножения
числителя и знаменателя на концентрацию
ионов водорода, получим Кг

 .
Подставив в приведенное выражение
значения ионного произведения воды
10–14
и константы диссоциации уксусной кислоты
~10–5,
получаем Кг~10–9,
т.е. гидролиз протекает незначительно.
.
Подставив в приведенное выражение
значения ионного произведения воды
10–14
и константы диссоциации уксусной кислоты
~10–5,
получаем Кг~10–9,
т.е. гидролиз протекает незначительно.
При
переходе к общему выражению Кг

 видно, что чем слабее кислота, образующаяся
в ходе гидролиза, тем в большей степени
протекает гидролиз.
видно, что чем слабее кислота, образующаяся
в ходе гидролиза, тем в большей степени
протекает гидролиз.
Если
соль гидролизуется по катиону, то в
общем виде константа гидролиза имеет
вид Кг
 .
Из приведенного выражения следует, что
чем слабее основание, образующееся в
ходе гидролиза, тем в большей степени
протекает гидролиз.
.
Из приведенного выражения следует, что
чем слабее основание, образующееся в
ходе гидролиза, тем в большей степени
протекает гидролиз.
В
случае соли, гидролизующейся как по
катиону, так и по аниону, общее выражение
константы гидролиза имеет вид Кг
 .
Так как в знаменатель входит
произведение Кд
слабых кислоты и основания, гидролиз
данных солей протекает в большей степени.
.
Так как в знаменатель входит
произведение Кд
слабых кислоты и основания, гидролиз
данных солей протекает в большей степени.
5.3 Смещение равновесия при гидролизе
Гидролиз является равновесным процессом, поэтому для подавления или усиления гидролиза необходимо оказывать внешнее воздействие, согласующееся с принципом Ле Шателье.
Влияние добавок различных веществ к растворам солей на процесс гидролиза
Рассмотрим данный вопрос на ранее приведенных примерах гидролиза:
1) Если в раствор соли уксусной кислоты, гидролизующейся по аниону (СН3СОО–)
СН3СОО– + Н+ОН– ↔ СН3СООН + ОН–,
добавить щёлочь, т. е. увеличить концентрацию ионов ОН–, то в соответствии с принципом Ле ІІІателье для уменьшения концентрации ионов ОН– равновесие должно сместится влево, т. е. произойдёт подавление гидролиза. Если же в этот раствор добавить кислоту, то концентрация ионов ОН– в растворе уменьшится, вследствие связывания гидроксид-ионов ионами водорода. В результате этого воздействия на систему равновесие гидролиза сместится вправо, т.е. произойдёт усиление гидролиза.
2) В случае соли гидролизующейся по катиону (NH4+)
NH4+ + НОН ↔ NH4OH+ Н+,
добавление сильной кислоты приводит к увеличению концентрации ионов водорода. Для уменьшения концентрации ионов водорода равновесие гидролиза должно сместиться в сторону обратной реакции, что приведет к подавлению гидролиза. Если же в данный раствор добавить щёлочь, то это приведёт к уменьшению концентрации ионов водорода в растворе, из-за связывания их с гидроксид-ионами. Вследствие этого равновесие сместится вправо, т.е. гидролиз усилится.
Добавление сильных оснований (щелочей) или сильных кислот к раствору соли, образованной катионом слабого основания и анионом слабой кислоты, приведет к разрушению гидролизующейся соли. Например:
(NH4)2СО3 + 2КОН ↔ 2NH4OH + К2СО3,
2NH4+ + СО3 2– + 2К+ + 2ОН– ↔ 2NH4OH + 2К+ + СО32–.
2NH4+ + СО3 2– + 2ОН– ↔ 2NH4OH + СО32–.
Влияние температуры на смещение равновесия в процессе гидролиза
Гидролиз – это процесс обратный реакции нейтрализации. Поскольку реакция нейтрализации протекает с выделением тепла, то гидролиз протекает с поглощением тепла. Следовательно, для усиления гидролиза нужно повышать температуру раствора, а для подавления – понижать.
Влияние концентрации гидролизующейся соли
Гидролиз солей, гидролизующихся только по катиону или только по аниону, зависит от концентрации раствора. Разбавление раствора приводит к усилению гидролиза, а концентрированиие к подавление гидролиза.
Гидролиз соли, гидролизующейся одновременно и по катиону, и по аниону, можно подавить, уменьшая температуру раствора.
